钙敏感受体通过G蛋白-PLC-IP3信号途径调节肺动脉张力*
李光伟, 苗宏志, 李 波, 王国忠, 金 莉, 林 岩, 邓志会, 肖 微
(1齐齐哈尔医学院病理生理教研室, 黑龙江 齐齐哈尔 161006; 2齐齐哈尔市第一医院胸心外科,黑龙江 齐齐哈尔 161005)
钙敏感受体通过G蛋白-PLC-IP3信号途径调节肺动脉张力*
李光伟1△, 苗宏志2, 李 波1, 王国忠1, 金 莉1, 林 岩1, 邓志会1, 肖 微1
(1齐齐哈尔医学院病理生理教研室, 黑龙江 齐齐哈尔 161006;2齐齐哈尔市第一医院胸心外科,黑龙江 齐齐哈尔 161005)
目的: 探讨钙敏感受体(calcium-sensing receptor,CaSR)在肺血管张力调节中的作用及信号途径。方法: 采用Ⅱ型胶原酶消化法提取大鼠肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs),激光共聚焦扫描显微镜技术观察不同条件下PASMCs中钙离子浓度的变化,组织浴槽血管环技术观察血管张力的变化。结果: CaSR激动剂(钙、钆)引起剂量依赖性的细胞内钙增加和血管张力增大, U73122和D609(PLC抑制剂)以及2-APB和肝素(IP3受体抑制剂)可减弱CaSR的作用(P<0.05),而U73343(U73122的无生物活性类似物)则无此作用(P>0.05)。结论: CaSR活化导致细胞内钙增加,进而引起肺动脉环收缩,这些过程是通过G蛋白-PLC-IP3信号转导通路实现的。
钙敏感受体; 肺动脉张力; 细胞内钙
钙敏感受体(calcium-sensing receptor,CaSR)是细胞膜上G蛋白偶联受体,其活化后通过引起细胞内钙离子浓度增加进而参与多种细胞活动,如细胞增殖、分化和凋亡等[1]。我们前期研究证实大鼠肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)中有钙敏感受体的表达,缺氧能够活化肺动脉平滑肌细胞的CaSR,并促进其的增殖,进而参与缺氧性肺动脉高压的发生[2-4]。肺动脉收缩和肺动脉平滑肌细胞重构是肺动脉高压发生的两大病理生理学基础。CaSR在肺动脉张力的调节中是否其作用,国内外尚未见报道。本文就上述问题展开研究。
材 料 和 方 法
1 主要试剂和仪器
U73122、U73343、2-APB、GdCl3、NiCl2、CdCl2、Fluo-3/AM及Ⅱ型胶原酶均购自Sigma。
解剖显微镜 (Nikon);激光共聚焦显微镜(Leica);ALC-M离体组织器官实验系统(上海奥尔科特生物科技有限公司)。
2 方法
2.1 肺动脉分离和平滑肌细胞培养 肺动脉分离和平滑肌细胞提取、培养参照文献[5]进行。在解剖显微镜下分离大鼠肺动脉,采用Ⅱ型胶原酶消化法提取原代平滑肌细胞,第3~5代生长状态良好的细胞用于实验。
2.2 细胞内钙离子浓度测定 细胞弃培养液,含钙Krebs洗涤。Fluo-3/AM(5 μmol/L)37 ℃避光孵育40 min;去除负载液,含钙Krebs洗涤,备用。用激光扫描共聚焦显微镜实时监测[Ca2+]i的变化,激发波长为488 nm[6]。
2.3 肺动脉环张力的测定 Wister大鼠2%戊巴比妥钠腹腔注射麻醉(2 mg/kg)。开胸取心脏和肺脏,置于4 ℃盛有HEPES液的培养皿中,显微解剖镜下,游离直径0.3~0.7 mm肺内肺动脉,除去血管周围脂肪和结缔组织,剪成长度约为3 mm血管环,悬挂在2根钨丝三角环上,一端挂在塑料支架下面的铁钩上,置于盛有4 mL Krebs液恒温浴槽内,另一端挂在张力换能器的电极上,持续通以95% O2-5% CO2混合气。在30 min内逐渐给肺动脉环负荷0.3 g的基础张力,平衡1 h后,分别测定不同条件下的血管张力[7]。
3 统计学处理
实验数据以均数±标准差(mean±SD)表示,统计学处理使用SPSS 17.0软件进行。采用配对t检验方法判断其差异显著性,以P<0.05为差异有统计学意义。
结 果
1 [Ca2+]O增加引起[Ca2+]i增加
如图1所示,当[Ca2+]O从5 mmol/L增加到12.5 mmol/L时,PASMCs内荧光强度呈剂量依赖性增加,当[Ca2+]O达到10 mmol/L时,进入平台期与基础浓度比较,差异有统计学意义(P<0.05)。
2 [Ca2+]O增加引起[Ca2+]i增加是通过CaSR活化所介导的
如图2所示,10 mmol/L CaCl2引起[Ca2+]i增加(P<0.05),在0.1 mmol/L NiCl2(钠-钙交换阻断剂)和0.02 mmol/L CdCl2(L型钙通道阻断剂)预孵育组[Ca2+]iFI/FI0有所降低,但仍高于对照组(P<0.05),10 μmol/L NPS2390(CaSR阻断剂)预孵育组出现类似的变化。而NiCl2、CdCl2及NPS2390共同预孵育情况下,[Ca2+]iFI/FI0明显降低,与control组比较无显著差异(P>0.05)。
3 U73122、U73343、2-APB、D609及肝素(heparin)对CaSR 活化所致PASMCs [Ca2+]i变化的影响
10 μmol/L U73122(PLC抑制剂)及100 μmol/L D609(PLC抑制剂)预处理后,CaCl2引起[Ca2+]i增加的作用被明显减弱(P<0.05),而10 μmol/L U73343(无生物效应的U73122的类似物)预处理则没有引起上述变化;另外75 μmol/L 2-APB(IP3抑制剂)及50 μmol/L肝素(IP3受体抑制剂)亦可明显减弱CaCl2引起[Ca2+]i增加的作用(P<0.05)。300 μmol/L GdCl3能够引起类似的反应,见图3、4。
4 [Ca2+]O增加引起肺动脉环张力的变化
以0.3 g的基础张力作为100%(control)。如图5所示,细胞外Ca2+浓度在0.5~2.5 mmol/L时,肺动脉环不发生收缩,当细胞外Ca2+浓度升高到5~12.5 mmol/L时,出现了剂量依赖性的血管收缩(P<0.05)。在0.1 mmol/L NiCl2(钠-钙交换阻断剂)和0.02 mmol/L CdCl2(L-型钙通道阻断剂)预孵育组肺动脉收缩有所降低,10 μmol/L NPS2390(CaSR阻断剂)预孵育组出现类似的变化。而NiCl2、CdCl2及NPS2390共同预孵育情况下,肺动脉环收缩显著降低。
5 U73122、U73343、2-APB、D609及肝素对CaSR 活化引起肺动脉环收缩的影响
U73122及D609预处理后,肺动脉环收缩作用明显减弱(P<0.05),U73343预处理则没有引起上述变化;2-APB及肝素同样引起肺动脉环收缩减弱(P<0.05)。GdCl3能够引起类似的反应,见图6、7。
讨 论
肺动脉高压发生的两大病理生理学基础是肺血管收缩和肺血管重构,我们前期研究证实CaSR可以促进缺氧性肺动脉平滑肌细胞增生进而可以促进肺动脉高压的发生。然而,CaSR在肺血管收缩中是否起作用,国内外未见报道。

Figure 1.The effect of different extracellular calcium concentrations ([Ca2+]o) on the intracellular calcium concentrations ([Ca2+]i ) in the PASMCs.
CaSR是1993年新发现的G蛋白偶联受体[1]。其激动剂为多价阳离子,如Ca2+、Gd3+及带有芳香族侧链的氨基酸[8]。文献报道,Ca2+活化CaSR的EC50是3~4 mmol/L[9]。我们的实验观察到,[Ca2+]o在1.8~2.5 mmol/L并没用引起细胞内钙离子浓度的变化,当[Ca2+]o升高到5~12.5 mmol/L时,细胞内钙离子的荧光强度以剂量依赖的形式增加。这就意味着在肺动脉平滑肌细胞CaSR活化能够引起[Ca2+]i增加。另外,在NiCl2和CdCl2预处理的情况下,[Ca2+]i的荧光强度降低,但仍高于对照组,NPS2390预处理也可以使[Ca2+]i的荧光强度降低,而在NiCl2、CdCl2以及NPS2390共同存在时,[Ca2+]i的荧光强度明显降低,与对照组无显著差异。这些结果提示:CaSR和L型钙通道及钠钙交换蛋白一起,共同参与了[Ca2+]o增加导致[Ca2+]i增加这一过程。
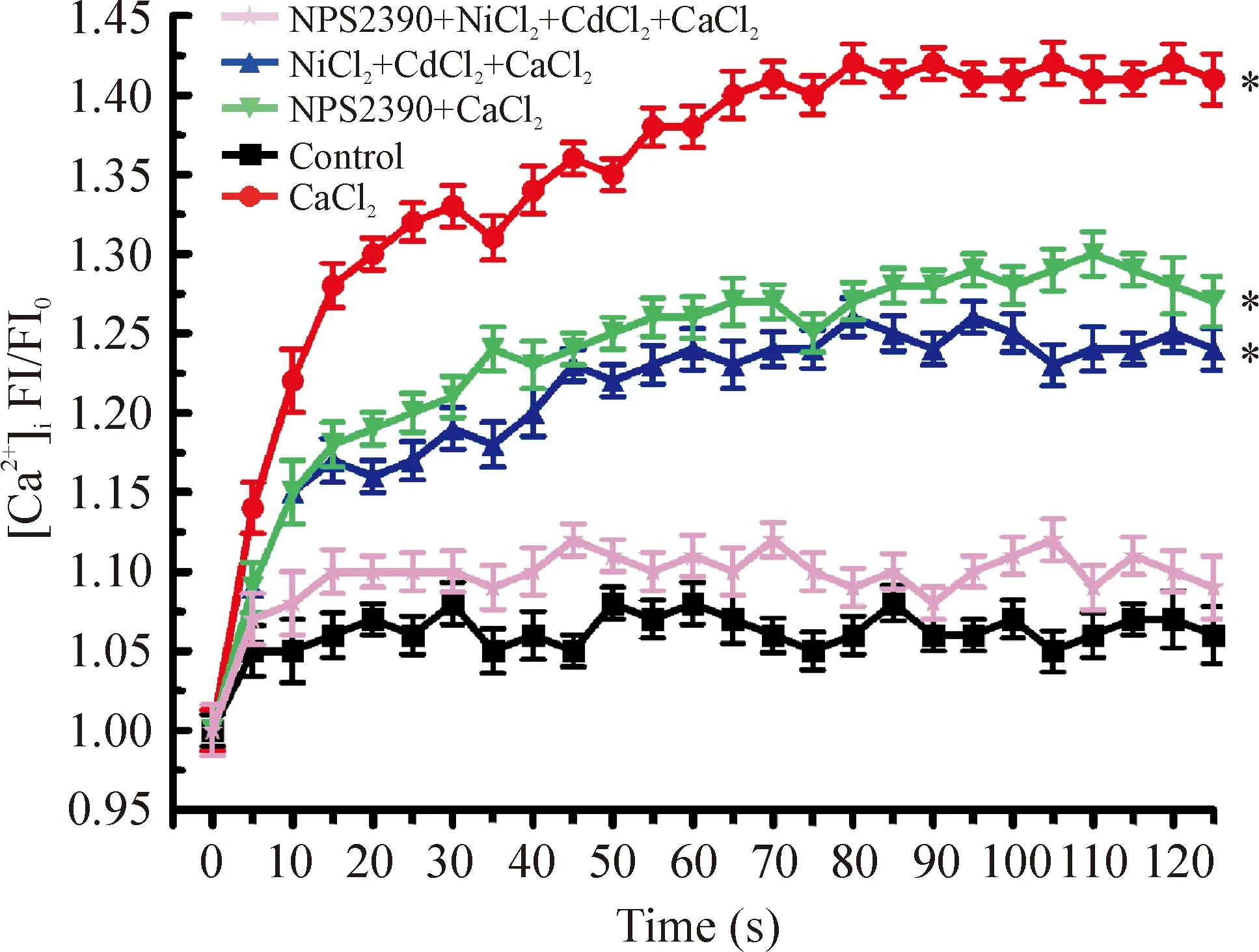
Figure 2.The effects of different inhibitors on the change of [Ca2+]i in the PASMCs induced by activated CaSR. Mean±SD. n=20. *P<0.05 vs control.

Figure 3.The effects of U73122, U73343, D609, 2-APB and heparin on the change of [Ca2+]i induced by CaCl2 in the PASMCs. Mean±SD. n=20. *P<0.05 vs control.

Figure 4.The effects of U73122,U73343,D609,2-APB and heparin on the change of [Ca2+]i induced by GdCl3 in PASMCs. Mean±SD. n=20. *P<0.05 vs control.

Figure 5.The effects of different inhibitors on constriction of pulmonary artery ring induced by increased [Ca2+]o . Mean±SD. n=8. **P<0.01 vs control; ## P<0.01 vs CaCl2 .
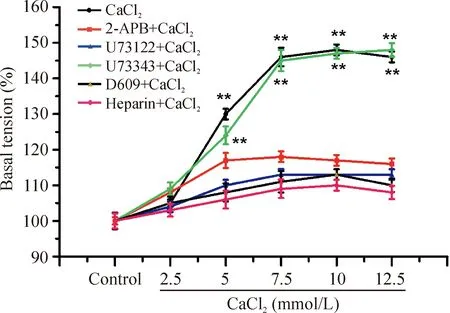
Figure 6.The effects of U73122, U73343, D609, 2-APB and heparin on constriction of pulmonic ring induced by CaCl2. Mean±SD. n=8. **P<0.01 vs control.

Figure 7.The effects of U73122, U73343, D609, 2-APB and heparin on vasoconstriction of pulmonary artery ring induced by GdCl3. Mean±SD. n=8. **P<0.01 vs control.
Wang等[10]证实细胞外钙增加、Gd3+及精胺能够引起大鼠心肌细胞肌浆网通过G蛋白-PLC-IP3信号转导通路释放Ca2+。我们发现,U73122和D609(PLC抑制剂)以及2-APB和肝素(IP3抑制剂)可以显著减弱Ca2+及Gd3+诱导的细胞内钙增加的作用,而U73122的无生物效应类似物U73343则对这种细胞内钙增加则无显著作用。此结果充分说明在肺动脉平滑肌细胞CaSR活化诱导的细胞内钙增加是通过G蛋白-PLC-IP3信号转导通路实现的。
我们知道,细胞内钙作为兴奋-收缩偶联因子参与心肌收缩和血管张力的调节。Wonneberger等[11]发现,在沙土鼠的蜗旋动脉,细胞外钙离子从1 mmol/L增加到10 mmol/L能够引起细胞内钙增加,并且可以相平行地引起血管收缩。在血管环实验中,我们观察到细胞外钙离子浓度在5~12.5 mmol/L 时,肺动脉环出现了剂量依赖性的收缩,Gd3+可以引起类似的变化。另外,这种血管收缩可以被NiCl2、CdCl2及NPS2390的预处理所减弱,提示Gd3+和Ca2+诱导的血管收缩至少部分是通过CaSR引起的。
文献报道,CaSR的细胞内信号转导通路与胞浆钙库相关联[12]。因此我们在测定血管张力时发现,Gd3+和Ca2+诱导的肺动脉收缩作用能够被U73122、D609、2-APB及肝素所抵消,而U73343则无上述作用,进一步说明CaSR活化所诱导的肺动脉收缩是通过G-PLC-IP3信号转导通路实现的。
上述实验结果提示:CaSR活化引起细胞内钙增加,进而导致肺动脉环收缩,这一过程是通过G蛋白-PLC-IP3信号转导通路实现的。由于肺动脉收缩是缺氧性肺动脉高压发生的潜在机制之一,因此CaSR可能成为防治肺动脉高压的新靶点。
[1] Brown EM, Gamba G, Riccardi D,et al. Cloning and characterization of an extracellular Ca2+-sensing receptor from bovine parathyroid[J]. Nature, 1993, 366(6455): 575-580.
[2] Li GW, Xing WJ, Bai SZ, et al. The calcium-sensing receptor mediates hypoxia-induced proliferation of rat pulmonary artery smooth muscle cells through MEK1/ERK1,2 and PI3K pathways[J]. Basic Clin Pharmacol Toxicol, 2011, 108(3):185-193.
[3] 李光伟,邢文婧,郝静辉,等. 钙敏感受体在缺氧诱导的大鼠肺动脉平滑肌细胞增殖中的作用[J]. 中国病理生理杂志, 2010, 26(12):2433-2437.
[4] 李光伟,李 波,康美佳,等. 钙敏感受体通过PI3K信号途径介导缺氧诱导的大鼠肺动脉平滑肌细胞增殖[J]. 中国病理生理杂志,2012, 28(9):1549-1553.
[5] Li YM, Li Q, Wang ZG, et al. 15-HETE suppresses K+channel activity and inhibits apoptosis in pulmonary artery smooth muscle cells[J]. Apoptosis, 2009, 14(1):42-51.
[6] 孙 健,于金凤,栾海荣,等. 小鼠胚胎干细胞钙敏感受体的表达和其对细胞增殖的影响[J]. 中国病理生理杂志, 2014, 30(30):651-657.
[7] Chu XJ, Tang XB, Guo L, et al. Hypoxia suppresses KV1.5 channel expression through endogenous 15-HETE in rat pulmonary artery[J]. Prostaglandins Other Lipid Mediat,2009, 88(1-2):42-50.
[8] Handlogten ME, Shiraishi N, Awata H, et al. Extracellular Ca2+-sensing receptor is a promiscuous divalent cation sensor that responds to lead[J]. Am J Physiol Renal Physiol, 2000, 279(6):F1083-F1091.
[9] Zhang W, Xu C. Calcium sensing receptor and heart di-seases[J]. Pathophysiology, 2009,16(4): 317-323.
[10]Wang R,Xu C,Zhao W, et al. Calcium and polyamine regulated calcium-sensing receptors in cardiac tissues[J].Eur J Biochem, 2003, 270(12):2680-2688.
[11]Wonneberger K,Scofield MA,Wangemann P.Evidence for a calcium-sensing receptor in the vascular smooth muscle cells of the spiral modiolar artery[J].J Member Biol,2000,175(3):203-212.
[12]Treiman M, Caspersen C, Christensen SB. A tool coming of age: thapsigargin as an inhibitor of sarco-endoplasmic reticulum Ca2+-ATPases[J]. Trends Pharmacol Sci, 1998, 19(4): 131-135.
Calcium-sensing receptor modulates pulmonary artery tension through G-protein-PLC-IP3pathways
LI Guang-wei1, MIAO Hong-zhi1, LI Bo1, WANG Guo-zhong1, JIN Li1, LIN Yan1, DENG Zhi-hui1, XIAO Wei1
(1DepartmentofPathophysiology,QiqiharMedicalUniversity,Qiqihar161006,China;2DepartmentofCardiothoracicSurgery,TheFirstHospitalofQiqiharCity,Qiqihar161005,China.E-mail:qiqihaerlgw@163.com)
AIM: To observe the role of calcium-sensing receptor (CaSR) in the regulation of pulmonary artery tension. METHODS: The intracellular calcium concentration ([Ca2+]i) was detected by laser-scanning confocal microscopy, and the pulmonary artery tension was determined by the pulmonary arterial ring technique. RESULTS: Increased levels of [Ca2+]oor Gd3+(an agonist of CaSR) induced the increase in [Ca2+]iand pulmonary artery constriction in a concentration-dependent manner. Additionally, the effects of Ca2+and Gd3+were inhibited by U73122 and D609 (specific inhibitor of PLC), and 2-APB and heparin (specific antagonist of IP3receptor). However, U73343 (U73122 inactive analogue) did not take effect. CONCLUSION: CaSR may be involved in the regulation of pulmonary artery tension by increasing [Ca2+]ithrough G-protein-PLC-IP3pathway.
Calcium-sensing receptor; Pulmonary artery tension; Intracellular calcium
1000- 4718(2015)01- 0018- 05
2014- 07- 23
2014- 10- 30
黑龙江省教育厅资助项目(No. 12511618)
△通讯作者 Tel: 0452-2663161; E-mail: qiqihaerlgw@163.com
R363
A
10.3969/j.issn.1000- 4718.2015.01.004

