大脑老化对大规模皮层网络拓扑结构的影响
林岚,张柏雯,徐小亭,付振荣,吴水才
北京工业大学 生命科学与生物工程学院,北京100124
大脑老化对大规模皮层网络拓扑结构的影响
林岚,张柏雯,徐小亭,付振荣,吴水才
北京工业大学 生命科学与生物工程学院,北京100124
随着世界范围内老年人口寿命的增加,人口老龄化已成为越来越严重的社会问题。大脑老化会导致记忆、执行功能、注意力、运动及感觉器官等功能的衰退,但不同个体和不同脑区间的网络变化规律和机制还不是特别清楚。在这里,我们通过对75个健康受试者(50~70岁)的T1磁共振影像进行皮层厚度测量,来构建大规模的脑结构网络。大脑网络通过对68个脑区的皮层厚度的相关矩阵阈值化来进行构建,并运用图论方法进行分析。结果显示,大脑结构网络的小世界特性与hub节点在不同年龄段存在一定差异,并且这种变化规律并不是一个线性关系。这些网络特性随年龄而变化的基本机制目前尚不清楚,但我们认为这可能是认知储备对大脑萎缩所造成的网络效率下降的一种补偿。对于大脑皮层网络拓扑结构的研究可以帮助我们更好地认识大脑的老化规律及认知储备对认知衰退的补偿作用。
磁共振成像;脑连接组;图论分析;认知储备;脑老化
0 前言
人口老龄化已经成为当今世界最为突出的社会问题。作为世界上老龄人口最多的国家,中国已经进入快速老龄化阶段。据第六次人口普查结果显示, 我国60岁及以上的老年人口已达1.82亿,约占人口总数的13.3%。预计到2030年,我国65岁以上的老年人口比例将超过日本,成为全球老龄化程度最高的国家[1]。在个体的衰老过程中,不可回避会发生物理、生物、化学以及心理水平的改变。大脑作为人体最为复杂的系统,也不能幸免于难。随着年龄的增长,大脑的结构、形态和功能都会发生了一系列变化,在认知上表现为不同程度的认知功能衰退[2]。各种类型的神经退行性疾病,随着大脑的老化逐渐开始出现。并且脑老化与多种神经退行性疾病具有相互重叠的临床和神经病理特征,相似的病因和病理学基础,进而推测,脑老化可能是神经退行性疾病的最初级阶段[3]。从认知角度而言,老年人群可以被分为成功老龄、常态老龄和病态老龄三类:成功老龄是指那些随着年龄的增长,认知功能基本不改变或改变甚微的老年人群;而常态老龄指的是虽然认知功能随增龄而有所改变,但并未达到病理变化的老年人群。根据流行病学的调查结果显示,世界范围内成功老龄的比例占到了老年人群的20%~40%[4-5]。对大脑老化的研究,可以加深我们对认知功能成功老龄化的理解,实现对神经退行性疾病的早期发现和早期干预,改善和提高老年人的认知水平和生活质量。
随着计算机技术的不断进展,基于结构磁共振图像的形态测量学方法被广泛应用于人脑老化过程中脑区形态学的研究中。基于体素的形态测量学方法(Voxel Based Morphometry,VBM)[6]可以检测正常老化所导致的脑萎缩,其研究结果显示左右脑岛、额顶叶脑回、中央沟和扣带沟区域与年龄相关的脑萎缩最为明显[7]。Alexander等[8]发现APOE ε4基因会对其中青年携带者的大脑结构带来改变,导致这一人群在老年期患阿尔茨海默病(Alzheimer’s disease, AD)的风险更高。Salat等[9]通过基于皮层厚度的形态学测量方法发现:年龄的增长在一定程度上还影响了大脑皮层的厚度。近年来,基于动物模型的大脑磁共振显微成像也被用于探索研究大脑老化及相关的神经退行性疾病[10-11]的研究中。当前结构磁共振影像的研究主要集中在识别随年龄增长而引起的大脑结构形态的变化中,但关于这些脑区结构是如何连接在一起,它们之间有怎样的联系以及存在怎样的运作关系的研究还比较少。老年人随年龄增长而发生的认知改变与老化的程度并不平行,这可能与脑网络的差异表达有关。认知活动通常不是由单一的神经回路或者脑区完成的,而是需要通过不同的神经回路或者脑区之间协同作用来完成认知工作。因此,从脑网络的层次上研究年龄对大脑的影响,可以加深我们对于大脑健康和病态老化的认识。
脑连接组是指大脑神经之间的结构连接的完整集合[12]。这些连接并不是随机存在的。在一个人的一生中,通过学习和经验的累积,不断建立、修剪、强化或减弱这些连接,最终使大脑(神经)可以进行储存记忆、并且可以调节身体反应和完成各类认知功能。2007年,He等[13]通过脑区皮层厚度之间的相关性,首次提出了用形态学指标构建大脑结构连接组的思想,证实了该结构连接组的“小世界”属性,为结构连接网络分析提供了一种新的途径。我们推测,年龄会改变大脑结构网络的拓扑结构,这种改变可以通过脑区皮层厚度区域相关性所建立的脑结构网络模型得到反映。本文中,我们首先通过T1结构像计算大脑皮层厚度的形态学指标,随后计算这些指标之间的线性相关性,完成脑结构网络的形态学构建。并通过小世界参数、hub节点等网络参数观察年龄对于脑皮层网络拓扑结构的影响。
1 材料与方法
1.1 T1 磁共振加权影像
75例年龄范围在50~70岁之间右利手的健康老年人被作为受试对象,其中39例女性,36例男性。75例对象的平均年龄为(60.5±5.2)岁。受教育程度12~20年之间,平均受教育程度为(16.6±2.2)年。MMSE评分的范围在25~30分之间,平均评分是(29.3±1.0)分,具体对象特征如表1所示。所有的磁共振影像数据都在美国亚利桑那大学附属医院采集。受试者纳入标准:无精神异常史及其它影响中枢神经系统的疾病,简易精神状态量表检查评分均≥25分,汉密尔顿抑郁评定量表≤10分。采用GE SignaⅡ 3.0T核磁共振扫描仪,基于三维扰相梯度回波序列(3D-SPGR)采集204张连续冠状面T1加权像(T1WI),扫描参数如下:TR 5.3 ms,TE 2.0 ms,TI 500 ms,翻转角度15°,矩阵:256×256,FOV=256 mm×256 mm,层厚 1 mm。
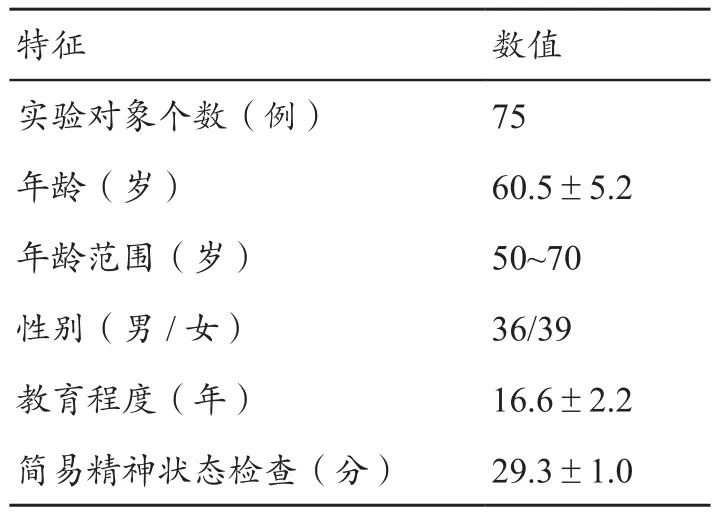
表1 实验对象特征表
1.2 DTI 大脑结构连接组构建
所有数据均通过基于Ubuntu平台的工作站,调用FreeSurfer (http://surfer.nmr.mgh.harvard.edu)软件包[14-16]进行自动化分析处理。分析处理过程分为体积处理流程与表面处理流程两大部分。体积处理流程包括图像灰度标准化、不均匀磁场的校正、到Talairach 空间的配准[17]、非脑组织的去除和白质(White Matter,WM)与灰质(Grey Matter,GM)的分割等。表面处理流程包括对白质曲面进行三维重建,从白质曲面出发,沿着灰质梯度方向向外膨胀得到灰质外表面曲面。定义灰质曲面和白质曲面间的距离为脑皮层厚度,采用T-average算法计算皮层厚度[18]。灰质外表面向外膨胀,得膨胀曲面。膨胀曲面经过球状形变后与模板进行高维配准,依据Desikan-Killiany图谱对皮层进行自动分区[19],同时计算每个区域皮层的厚度。Desikan-Killiany图谱将全脑分为70个脑区(左右半脑各35个),其中胼胝体没有灰质厚度,因此最后得到68个脑区(左右半脑各34个)的皮层厚度。每个脑区的皮层厚度为该脑区所有点的厚度的平均值。
Desikan-Killiany模板所划分的68个脑区被定义为脑网络中的节点,脑区间皮层厚度的皮尔逊相关系数代表网络的边。将75例对象按照年龄分为四组,即50~55岁(11例)、55~60岁(26例)、60~65岁(18例)、65~70岁(20例)。每组每个样本每个脑区的皮层厚度先通过回归去除脑区平均厚度、年龄和性别的影响,用残差作为原始的皮层厚度进行后续计算。随后,计算任意两个脑区皮层厚度的皮尔逊相关系数得到相关系数矩阵。

其中,xi表示其中一个脑区皮层厚度的第i个样本值,表示该脑区皮层厚度的平均值;yi表示另一个脑区皮层厚度的的第i个样本值,表示此脑区皮层厚度的平均值;n为样本值数量,这里n为75。
相关性分析后,得到相关系数连接矩阵。这里得到的相关系数有正有负,对所有的相关系数取绝对值得到矩阵Cij(i,j=1,2,3……68),接着选定阈值对Cij进行二值化,即若Cij大于阈值则置1,反之则置0,这样就得到二值化矩阵Aij(i,j=1,2,3……68)。每一组的皮层厚度网络G有N个节点K条边,N=68,如果所有组取相同的阈值进行二值化,那么二值化后每个组皮层厚度网络G边的数量有可能不同,对应不同的网络拓扑结构,这样就不能很好的比较组间年龄的变化对网络拓扑结构的影响。我们这里利用Desikan等[19]提出的网络稀疏度概念解决了这一问题。稀疏度S被定义为网络中实际存在的边数与最大可能存在的边数的比值,即S=K/[N(N-l)/2]。选定同一个稀疏度二值化所有相关矩阵Cij后,网络G有相同的节点数和边数。目前稀疏度值的选择还不存在金标准。因此,我们在一定范围内(5%~40%)每隔1%选取一个稀疏度,既使得所有的网络全连通,又保证其满足小世界属性。如果稀疏度太小,可能使得边的数量太少而形成一个稀疏连接的图,存在孤立节点,不能全连通;如果稀疏度太大,可能使得边的冗余量太大,不满足小世界属性[20]。至此完成大脑皮层厚度网络的构建(图1)。
1.3 网络分析
完成大脑皮层厚度网络构建后,选用图论分析法计算网络的拓扑属性。本文主要用到节点度、节点的聚类系数、节点的最短路径长度、节点的中介中心性这样一些拓扑属性。小世界网络介于规则网络和随机网络之间,它既具有与规则网络类似的较高的聚类系数,又具有与随机网络类似的较短的最短路径长度(图2)。在每个稀疏度下,计算出网络的平均最短路径长度Lp和平均聚类系数Cp。然后,随机获得100个与实际网络具有相同节点数、度分布的随机网络。Lr、Cr为这些随机网络的平均聚类系数和平均最短路径长度。对四组对象的平均最短路径长度Lp、平均聚类系数Cp以及小世界特征λ=Lp/Lr和γ=Cp/Cr进行比较。

图1 皮层厚度测量和结构网络构建流程图

图2 规则网络、小世界网络和随机网络的连接示意图
Hub节点是指网络中最为重要的节点,网络中许多其它节点之间的信息传输都需要经过该节点。本文选用归一化的中介中心性BCi来定义hub节点。归一化的中介中心性BCi定义为:

这里,Bi是某个节点的节点中介中心性,表示网络中所有节点中介中心性的平均值。
当BCi满足以下公式时,其对应的节点即为hub节点。

其中mean为网络中所有节点归一化的中介中心性BCi的平均值,SD为网络中所有节点归一化的中介中心性BCi的标准差,本文中取n=2。
网络的全局效率Eglob定义为网络中所有节点最短路径倒数的平均值,全局效率衡量全局信息在整个网络中传递的快慢。网络脆弱性广泛用于定量测量网络节点的假设缺失对网络性能的影响。
任意节点i的脆弱性定义为移除节点i和与其相连的边前后网络全局效率的改变:

由于移除节点后网络拓扑结构存在变化,造成网络脆弱性的值有正有负,不便于后续的分析与理解。本研究定义网络的脆弱性为随机移除节点与移除hub节点后网络全局效率的改变,即:

标准化的网络脆弱性的定义为:

这里M为网络中hub节点的数量。
2 结果
四组对象的相关矩阵都比较复杂,但也有一定的相似性。左右半球的同源脑区和位于同一半球的相邻脑区往往有较强的相关性。根据得到的相关系数矩阵,需要选取阈值,确定稀疏度的范围。当稀疏度S=9%时,第四组对象(65~70岁)的大脑网络出现了孤立的节点;而当S=10%时,四组对象的网络中均无孤立节点存在。当S>30%,四组对象的小世界参数γ、λ的变化基本收敛。因此稀疏度的范围被选定为10%≤S≤30%。在这个范围内每隔1%计算一次四组对象的网络拓扑参数Cp、Lp、γ、λ,如图3所示。

图3 四组对象的网络拓扑参数Cp、Lp、γ、λ随稀疏度S的变化规律
在10%~30%的区间内,四组对象的Cp随着稀疏度的增加而增加,而Lp、γ、λ随稀疏度的增加而下降。从图中我们可以看出55~60岁对象组的Cp值低于50~55岁对象组的Cp值;而60~65岁对象组Cp值高于55~60岁对象组的Cp值,却低于50~55岁对象组的Cp值;65~70岁对象组的Cp值低于60~65岁对象组的Cp值,高于55~60岁对象组的Cp值。55~60岁对象组的Lp值低于50~55岁对象组的Lp值;60~65岁组的Lp值与65~70岁组的Lp值相近,均高于55~60岁对象组的Lp值。当稀疏度增加时,γ值迅速下降,但 λ值仅略有改变。四组对象的σ=γ/λ值随着稀疏度的增加而减少,反映了小世界属性的减弱。四组对象的γ值大小关系为:50~55岁对象组>60~65岁对象组>65~70岁对象组>55~60对象组>1。四组对象的λ值随着稀疏度的增加而接近于1,其大小关系为:50~55岁对象组>60~65岁对象组,65~70岁对象组与55~60对象组λ值相近,四组对象的λ≈1。
在稀疏度10%≤S≤20%范围内,对四组对象的Cp、Lp、γ、λ进行单因素方差分析(One-Way ANOVA),结果如图4所示。对于Cp而言,四组对象方差齐性检验相伴概率为0.027,各组总体方差不相等。ANOVA结果(F(3,40)=34.587,P<0.001)显示, 四组对象间存在显著性差异。Dunnett T3非参数检验结果显示除60~65岁对象组和65~70岁对象组外,其它组两两之间均存在显著性差异。对于平均最短特征路径长度Lp,四组对象间均不存在显著性差异(F(3,40)=0.17,P>0.05)。对于小世界网络属性γ而言,方差齐性检验相伴概率为0.047,各组总体方差不相等,ANOVA结果(F(3,40)=5.509,P<0.05)显示四组对象间存在显著性差异。Dunnett T3非参数检验结果显示50~55岁对象组和55~60岁对象组间存在显著性差异(P=0.025)。而对于λ而言,方差齐性检验相伴概率为0.015,各组总体方差不相等。ANOVA分析结果(F(3,40)=6.528,P<0.05)显示,四组对象间存在显著性差异。Dunnett T3非参数检验结果显示50~55岁对象组与55~60岁对象组、55~60岁对象组与65~70岁对象组的相伴概率分别为0.012、0.005,两两之间存在显著性差异。同理,在稀疏度10%≤S≤30%范围内,对四组对象的网络拓扑参数Cp、Lp、γ、λ进行ANOVA分析,结果如图5所示。与稀疏度10%≤S≤20%相比,小世界网络属性λ组间不存在显著性差异。这可能是由于随着稀疏度的增加,大脑网络的小世界属性逐渐减弱,致使其随着年龄增长的所发生的改变不是很明显。这些结果意味着皮层网络的小世界参数结构随年龄变化而发生了明显改变。

图4 稀疏度为10%≤S≤20%时,不同年龄段对象组的网络参数(Cp、Lp、γ、λ)比较

图5 稀疏度为10%≤S≤30%时,不同年龄段对象组的网络参数(Cp、Lp、γ、λ)比较
为了比较不同年龄段对象的大脑皮层厚度网络hub节点的差异,本文在稀疏度10%下对所有网络进行二值化处理。在该稀疏度下,大脑网络各节点全连通并且具有小世界属性,而且假阳性路径的数量最少。如果节点的归一化的中介中心性BCi值大于mean+2SD,则该节点为网络中的hub节点,表2为网络中的hub节点在不同对象组的变化趋势。
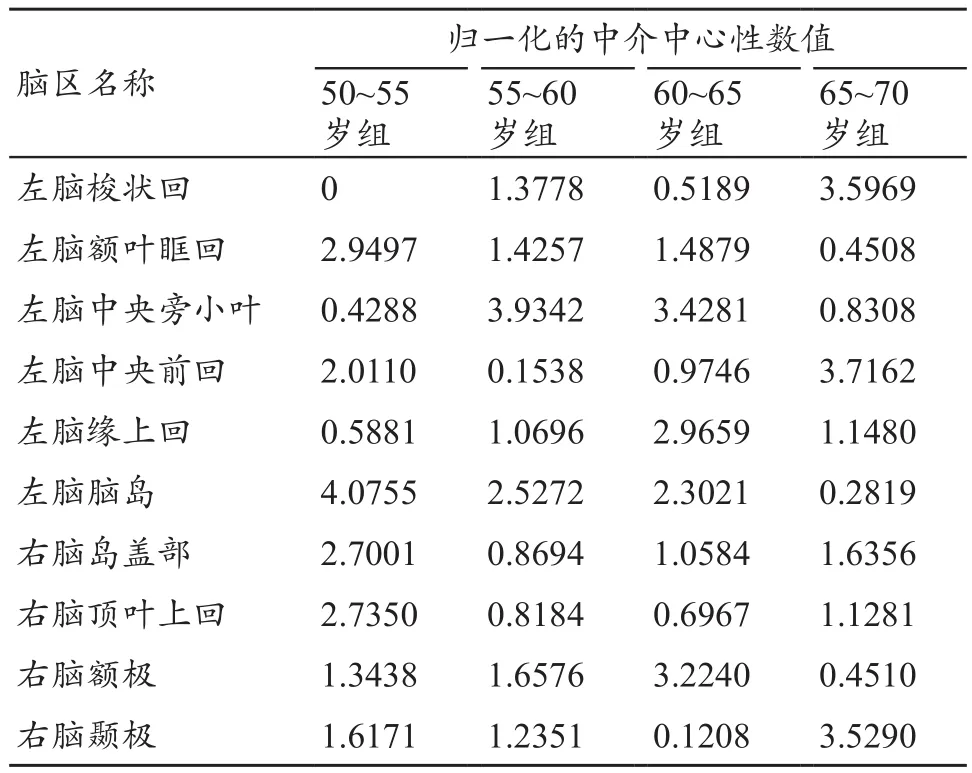
表2 4组对象的hub节点
这些脑区中有的脑区随着年龄的增长由非hub节点转换为hub节点,有的脑区随着年龄的增长由hub节点转换为非hub节点。该结果与Zhu等[20]发现中年人与老年人在基于灰质体积构建的结构网络中,hub节点存在较大差异类似。
稀疏度为10%时计算四组对象构建的标准化的网络脆弱性并对其进行统计分析,结果如图6所示。四组对象方差齐性检验相伴概率为0.000,小于显著性水平0.05,因此认为各个组总体方差是不相等的,ANOVA结果显示(F(3,396)=211.968,P<0.001),说明四组对象间存在显著性差异,Dunnett T3非参数检验结果显示50~55岁对象组与60~65岁对象组、50~55岁对象组与65~70岁对象组、55~60岁对象组与60~65岁对象组、55~60岁对象组与65~70岁对象组的相伴概率分别为0.000、0.000、0.000、0.001、0.000,均小于显著性水平0.05,说明两两之间存在显著性差异。

图6 稀疏度为10%时,不同年龄段对象组的标准化的网络脆弱性比较
3 讨论
我国在未来几十年所面临的社会老龄化问题是前所未有的重大挑战,与之相应的脑老化及其相关疾病也就成为人们关注的焦点之一。人脑是一个高效复杂的“小世界”网络,不同的状态或疾病都会导致网络属性异常,大脑老化也不例外。从脑网络的角度研究大脑老化进程可以帮助我们了解大脑网络随年龄的变化,以便于未来制定针对性地相应的策略,为减轻老龄化社会做出贡献。
4 结论
在本研究中,我们采用 MRI 皮质厚度测量显示了大型脑结构网络与年龄的相关变化。主要结论如下:① 小世界网络特性随年龄增长而发生变化;② 网络中心节点随年龄增长而发生变化。这些网络特性随年龄而变化的基本机制目前尚不清楚,我们认为这可能反映了认知储备对于大脑萎缩所造成的网络效率下降的补偿作用;③ 网络中心节点随年龄增长对网络的贡献呈增大趋势,移除中心节点对标准化的网络脆弱性的影响在50~60岁间和60~70岁间存在显著不同。随年龄增加,脑网络变得更加脆弱。对于T1结构MRI而言,目前研究仍在集中在群体数据,个体网络构建及个体差异分析仍为盲点。未来的网络构建应考虑如何体现个体差异,这将在临床应用中有着更为重要的价值。另外,多模态脑连接组分析是脑网络分析未来研究的一个发展方向。来自结构磁共振图像、 弥散磁共振图像、 功能磁共振图像等多种模式的影像数据组合会帮助我们从新的视角研究人类人脑。
[1] 陈社英,刘建义,马箭.积极老龄化与中国:观点与问题透视[J].南方人口,2010,4(2378):2-23.
[2] 杨艺,隋建峰.脑老化及其相关研究进展[J].山西医科大学学报, 2012,43(2):154-57.
[3] Singh S,Mistry S,Jefferson S,et al.A magnetic resonance spectroscopy study of brain glutamate in a model of plasticity in human pharyngeal motor cortex[J].Gastroenterology,2009,136(2): 417-424.
[4] Row eJW,Kahu RL.Human aging:usual and successful[J].Science, 1987,237(4811):143-149.
[5] Hering A,Rendell PG,Rose NS,et al.Prospective memory training in older adults and its relevance for successful aging[J].Psychol Res,2014,78(6):892-904.
[6] Ashburner J,Friston KJ.Voxel-based morphometry—the methods[J].NeuroImage,2000,11(6 Pt 1):805-821.
[7] Good CD,Johnsrude IS,Ashburner J,et al.A voxel-based morphometric study of ageing in 465 normal adult human brains[J].NeuroImage,2001,14(1 Pt 1):21-36.
[8] Alexander GE,Bergfield KL,Chen K,et al.Gray matter network associated with risk for Alzheimer's disease in young to middleaged adults[J].Neurobiol Aging,2012,33(12):2723-2732.
[9] Salat DH,Buckner RL,Snyder AZ,et al.Thinning of the cerebral cortex in aging[J].Cereb Cortex,2004,14(7):721-730.
[10] Lin L,Fu Z,Xu X,et al.Mouse brain magnetic resonance microscopy:Applications in Alzheimer disease[J].Microsc Res Tech,2015,78(5):416-424.
[11] Lin L,Wu S.An automated template-based adaptive threshold approach for measuring ventricular volume enlargement in mouse brain MR microscopy[J].J Microsc,2012,248(3):260-265.
[12] Sporns O,Tononi G,Kötter R.The human connectome:a structural description of the human brain[J].PLoS Comput Biol, 2005,1(4):e42.
[13] He Y,Chen Z,Evans AC.Small-world anatomical networks in the human brain revealed by cortical thickness from MRI[J].Cereb Cortex,2007,17(10):2407-2419.
[14] Dale AM,Fischl B,Sereno MI.Cortical surface-based analysis.I.Segmentation and surface reconstruction[J].Neuroimage, 1999,9(2):179-194.
[15] Fischl B,Sereno MI,Dale AM.Cortical surface-based analysis.Ⅱ:Inflation,flattening,and a surface-based coordinate system[J].Neuroimage,1999,9(2):195-207.
[16] Fischl B.Freesurfer[J].NeuroImage,2012,62(2):774-781.
[17] Talaraich J,Tournoux P.Co-planar stereotaxic atlas of the human brain[M].George Thieme Verlag,Stuttgart,1988.
[18] Fischl B,Dale AM.Measuring the thickness of the human cerebral cortex from magnetic resonance images[J].Proc Natl Acad Sci USA,2000,97(20):11050-11055.
[19] Desikan RS,Ségonne F,Fischl B,et al.An automated labeling system for subdividing the human cerebral cortex on MRI scans into gyral based regions of interest[J].Neuroimage,2006, 31(3):968-980.
[20] Zhu W,Wen W,He Y,et al.Changing topological patterns in normal aging using large-scale structural networks[J].Neurobiol Aging,2012,33(5):899-913.
In fl uence of Brain Ageing on Topological Patterns of Large-Scale Cortical Networks
LIN Lan, ZHANG Bai-wen, XU Xiao-ting, FU Zhen-rong, WU Shui-cai
College of Life Science and Bio-Engineering, Beijing University of Technology, Beijing 100124, China
As life span increases worldwide, ageing population has become more of a social strain. Aging causes declining in memory, executive function, attention, motor function, vision, hearing etc. However, how brain networks differ among individuals and across brain regions remain unclear. In this paper, cortical thickness measurement was used in T1 weighted MRI (Magnetic Resonance Imaging) of 75 healthy volunteers to investigate the large-scale structural brain networks. Brain networks were constructed by thresholding cortical thickness correlation matrices of 68 regions and analyzed using graph theoretical approaches. All age groups fully preserved the small-world architecture and organization. For different age groups, the characteristics of small-world networks exhibited different patterns, and distribution of network hubs altered, suggesting a reorganization of cortical thickness correlation networks. The underlying mechanisms of changing network properties are still unclear. However, authors thought that it might be caused by neural network compensation from cognitive reserve. Study of the cortical network topology can help us to have a better understanding of the brain aging and how cognitive reserve compensates the declining cognition.
MRI; brain connectome; graph theory; cognitive reserve; brain ageing
R197.39
A
10.3969/j.issn.1674-1633.2015.06.003
1674-1633(2015)06-0012-06
2015-03-05
北京市自然科学基金(7143171)资助。
林岚,副教授。
通讯作者邮箱:lanlin@bjut.edu.cn

