退化性椎间盘疾病诊断与治疗技术的研究进展
施长城,姚海
1. 中国科学院重庆绿色智能技术研究院 太赫兹技术研究中心,重庆400714;
2. 克莱姆森大学 生物医学工程系,克莱姆森市,美国 南卡罗莱纳州,29634;
3. 南卡罗莱纳医科大学骨外科系,查尔斯顿市,美国 南卡罗莱纳州,
29425
退化性椎间盘疾病诊断与治疗技术的研究进展
施长城1,2,姚海2,3
1. 中国科学院重庆绿色智能技术研究院 太赫兹技术研究中心,重庆400714;
2. 克莱姆森大学 生物医学工程系,克莱姆森市,美国 南卡罗莱纳州,29634;
3. 南卡罗莱纳医科大学骨外科系,查尔斯顿市,美国 南卡罗莱纳州,
29425

作者介绍:施长城
施长城,助理研究员,中国科学院重庆绿色智能技术研究院太赫兹技术研究中心。研究方向为生物组织与材料中传输学的建模和基于多模态图像技术的测量。

作者介绍:姚海
姚海,副教授,克莱姆森大学/ 南卡罗莱纳医科大学联合生物医学工程研究中心主任。该研究中心的任务是加速基于生物医学工程的新材料,技术和方法向临床诊断和治疗的转化,同时满足高质量研究生教育的需要。研究方向包括软骨组织和细胞的生物力学和生物传输学的建模和测量,及其在软骨组织退化的诊断和再生中的应用。
退化性椎间盘疾病(Degenerative Disc Disease, DDD)是严重影响人们正常生活的重大疾病之一。随着人类现代生活方式的改变,其已呈现了发病率逐年递增与发病人群年轻化的趋势。因此,针对该疾病的诊断与治疗技术亟需不断提高与完善。本文简单介绍了人体椎间盘的解刨学基础与其组织中的生化成分和功能,着重分析了针对该疾病的各种医学诊断技术,包括传统的分级评价系统以及各种定量化磁共振成像技术,重点介绍比较了现今临床上两种主要的手术治疗方法——脊柱融合术与全椎间盘置换术,并最终在总结诊断与治疗方法研究中所存在问题的基础上,对未来研究的发展趋势提出展望。
退化性椎间盘疾病;椎间盘退化分级评价系统;基于扩散的磁共振成像;脊柱融合术;全椎间盘置换术;组织再生
0 前言
下腰痛(Low Back Pain)是一种主要的公共健康问题,并且影响到较广泛的人群。美国卫生研究院于2005 年报道,在美国,超过四千万病人被诊断为下腰痛。该疾病主要发生于30~50 岁的人群,但近年有趋于年轻化的表现,其中男女性受其影响的比例均等。与其相关的医疗与保险花费估计每年达到500 亿美元[1]。
椎间盘退化性疾病与下腰痛有较强的相关性[2],并与坐骨神经痛,椎间盘突出和脱出紧密相关。 退化改变了椎间盘组织的高度以及整个脊柱的力学性能。随着椎间盘的退化,其他脊柱结构(例如:肌肉与韧带)的行为很有可能受到负面的影响。该影响若长期发展可导致椎管狭窄,这也是造成老年人下腰痛和残疾的罪魁祸首。近年来,椎间盘退化性疾病的发病率随着人口结构的变化呈指数上升,同时病患的年龄群体也在增加。此外,相对于其他肌肉骨骼组织,椎间盘的退化会发生在较小的年纪。研究发现早期的尾椎间盘退化发生于11~16 岁的年龄组中,并且约20% 的人会在10 多岁的时候表现出轻微的椎间盘退化[3]。随着年龄的增加,退化程度会大幅度增加,并且男性患者表现更为明显。因此,大约10% 的50 岁与50% 的70 岁患者的椎间盘会有较为严重的退化[4]。
椎间盘的退化将会引起其组织细胞外间质的生物化学变化。例如, 糖胺多糖(Glycosaminoglycan, GAG) 含量会在退化过程中急剧下降,为此引起膨胀倾向,渗透压梯度以及电化学效应(包括流动势能与流动电流)的关联变化[5-6]。有关细胞生物合成与重建的强调节因子(Potent Regulator)也会随之受到影响[7-8]。此外,与椎间盘退化相关联的另一因素是其生长的营养环境。由于营养供给下降所引起的氧含量,葡萄糖含量与酸碱度的降低会影响到椎间盘细胞活性、分裂速率、能量代谢、合成与维持细胞外间质的能力,因此可能最终导致椎间盘的退化。
1 人体椎间盘的组织结构与生化成分
人体椎间盘是一块分割椎骨的纤维软骨,它可使脊柱获取包括伸展,侧向弯曲及旋转在内的灵活性、强度和大范围的力学运动[9]。在脊柱的尾椎区域,椎间盘大约有7~10 mm 的厚度与40 mm 直径。不同的生物化学成分与结构将其分为三个特征区域:纤维环(Annulus Fibrosus, AF),髓核(Nucleus Pulposus, NP)以及软骨终盘(Cartilaginous Endplates, CEP)(图1)。以下将分别就三个特征区域进行简要介绍。
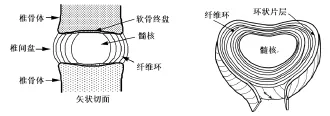
图1 椎间盘组织的解刨学与形态学示意图
1.1 椎间盘的组织结构
纤维环:椎间盘组织中的纤维环是包含15~25 层薄片状结构的厚圆环。每个平行的层结构中包含有整齐排列的胶原纤维束。在每个平行的薄片层中,胶原纤维沿垂直轴向左右各交替约60°。位于薄片层中的弹性纤维可能有助于椎间盘在变形后恢复到原始的排列状态,也或许在它们径向穿越各薄片层时与之黏粘,使各薄片层连成一体。纤维环中的细胞,特别是位于靠外区域,多倾向于薄而细长并且平行于胶原纤维排列的似纤维原细胞,而位于环内侧的细胞会更多成椭圆形。该区域细胞密度大约为9000 细胞/mm3[10]。 纤维环与髓核中的细胞都会有若干个长而薄的胞浆突出( 长度或会超过30 μm)。它们在椎间盘中的功能至今还未明晰,但据称会起到组织中力学压力的传感器与交流器作用[11-12]。
髓核:髓核中部是胶状结构,其主要包含无序排列及波浪状的软骨纤维束和纤维原细胞。无序排列的胶原蛋白纤维与径向排列的弹性蛋白纤维(有时会达到150μm)镶嵌于高度含水的聚集蛋白聚糖(Aggrecan) 的胶状物中。髓核中主要包含密度不高的似软骨细胞(约5000细胞/ mm3)[10],并有时会位于细胞外间质的膜囊中。髓核周围包裹的是纤维环,两者的分界线在年青人中非常明显[13]。
软骨终盘:软骨终盘位于髓核与纤维环的上下表面。每一终盘为一层薄的透明软骨(Hyaline Cartilage)。该终盘将椎间盘与椎骨体分开,并具有0.6 ~1.0 mm的厚度,其中心区域最薄[14]。软骨终盘覆盖了整个髓核与中心部分的纤维环,由于交错复杂的纤维环与终盘纤维,软骨终盘与椎间盘紧密地粘附在一起。在正常健康的人体中,终盘与其他透明软骨一样完全是不含血管与神经的。
1.2 椎间盘中的生化成分及其功能
椎间盘主要由水以及大量的胶原蛋白、蛋白多糖(Proteoglycan)和其他间质蛋白组成[13,15-16]。 椎间盘的细胞外间质带有固定的负电荷,这是导致间盘组织膨胀行为的主要因素。固体间质上固定电荷与细胞间液中的自由离子的相互静电作用可产生动电效应(Electrokinetic Effects)[17]。例如:道南渗透压与膨胀,流动电势与电流等。因此,椎间盘中的膨胀与溶液和溶质的传输特性取决于各种生理化学的因子,例如:含水量,固定电荷密度以及电解液的类型和浓度等[6]。椎间盘的力学功能主要由细胞外间质提供,其成分与组织结构决定了椎间盘的力学响应。起主导力学性能的有两个主要的元素——胶原蛋白纤维(Collagen Fibers)与聚集蛋白聚糖。
胶原蛋白纤维:胶原蛋白网络约占纤维环干重的70%,其类型主要为I 型胶原蛋白,而在髓核与纤维环内侧主要分布II 型胶原蛋白,同时也包含一些III,VI,IX 与XI 型胶原蛋白,这些胶原蛋白为椎间盘提供拉伸强度以及与椎骨的固定连接能力。
聚集蛋白聚糖:聚集蛋白聚糖为椎间盘中蛋白多糖的主要类型,主要起到在渗透压影响下保持组织含水以及吸收压缩力的作用。髓核中包含大量的透明质酸(Hyaluronan)和聚集蛋白聚糖,也存在一定量的其他蛋白多糖,如双糖链蛋白多糖(Biglycan),小分子蛋白多糖(Decorin)和纤调蛋白(Fibromodulin)等。 髓核中的蛋白多糖与水的含量都要高于纤维环。
细胞外间质:椎间盘的细胞外间质是一个完全动态的结构,各种间质大分子的生物合成,分解与积聚间的平衡决定了细胞外间质的质量与完整性,从而决定了椎间盘的力学行为。间质的完整性也对健康椎间盘保持无血管与无神经组织起到了非常重要的作用。
2 退化性椎间盘疾病的临床诊断
退化性椎间盘被认为是引起下腰痛疾病的主要力学因素,其疼痛致病机理可能包括三个方面:① 由于纤维环的膨出(Bulging)所导致的对后方神经的压力;② 由于软骨终盘偏斜而激发疼痛产生因子(Pain Generator);③ 由于间盘内部破裂而流出的糖胺多糖和乳酸。因此可以认为退化性椎间盘疾病中的疼痛是由对其周围神经的化学与力学刺激而产生[18]。此外,营养供给的不足也被认为是一个关键的导致椎间盘退化的因素。在退化过程中,通常伴随着椎间盘组织形态、生物化学成份、功能与材料性能的改变。其中,最为显著的生物化学变化是蛋白多糖的流失[4,19],这也会引起渗透压与组织含水量的减少[20],从而导致了椎间盘负重支撑能力的缺失[21]以及影响到重要营养分子在其间的正常传输[10]。以上所提到的在退化过程中的变化特征也成为针对该疾病临床诊断的重要指标。
2.1 分级诊断系统
计算机断层扫描(Computed Tomography, CT)与磁共振成像(Magnetic Resonance Imaging, MRI)是最为常用的诊断退化性椎间盘疾病的医学技术。近年来,随着MRI 技术的不断发展,它已成为诊断椎间盘退化性疾病最精确的检查手段之一,并具备可定量化、诊断准确率高、无辐射与无损伤等优点[22]。传统的MRI 诊断方法主要依靠Pfirrmann分级系统[23],以T2 加权的MRI 矢状位信号图像与椎间盘结构特征为基础对其退化程度进行分类。值得一提的是,该分级系统是在早期Thompson 分级系统[24]的基础上发展而来,并且根据髓核,纤维环以及软骨终盘的整体形态学信息分为与Thompson 分级系统相对应的5个等级(图2)。
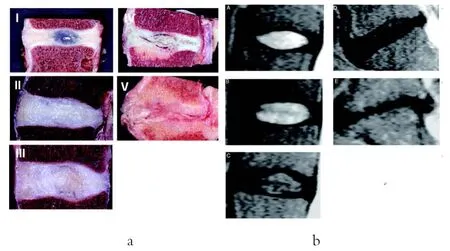
图2 Thompson与Pfirrmann分级系统
Griffith 等人[25]在5 等级Pfirrmann 分级系统的基础上,对椎间盘退化情况进行了更加细致的分级,发展成为8 等级的改良Pfirrmann 分级系统,新系统更加适合于诊断并区分中老年病患的椎间盘退化程度。与此同时,Watanabe 等人[26]发展了一种基于轴向T2 加权MRI 图像的椎间盘退化分级系统,相对于传统的分级系统,该系统可以更好地对早期的退化病变进行诊断。
2.2 定量化诊断方法研究
除各种分级诊断系统外,各种定量化诊断椎间盘退化程度的方法同时也在被深入研究,这些方法包括T1ρ,T2与T2* 弛豫时间( Relaxation Times)与成图技术(Mapping Techniques)[27-32]。该类方法可定量测量椎间盘区域的各项MRI 参数数值,并可进行可视化与定量化的对比,与传统的Pfirrmann 分级系统建立了紧密的相关联系。 更有意义的是Auerbach 与Marinelli 等人[27,29]发现了T1ρ 与T2 弛豫时间数值与椎间盘组织的蛋白多糖与水含量的关联性,进一步为该类定量化诊断方法提供了生理与病理学依据。
2.3 基于扩散磁共振成像(Diffusion MRI)的诊断方法研究
基于扩散的磁共振成像技术主要包括扩散加权成像(Diffusion Weighted Imaging,DWI) 与扩散张量成像(Diffusion Tensor Imaging,DTI)。它们都是通过对水分子扩散运动的测量来诊断人体组织在病变过程中的生化成分与内部组织结构的变化。 例如,在DWI 技术中可用表观扩散系数(Apparent Diffusion Coefficient,ADC)来描述水分子在椎间盘组织中的综合微观运动情况,该参数通常会随着组织含水量的降低而减小,而椎间盘退化的早期表现之一即为组织含水量的降低。因此,DWI 技术已被广泛应用于椎间盘退化疾病的早期诊断研究中。
Kerttula 等人[33]首先运用1.5T 磁共振成像仪测量了健康年青志愿者椎间盘中的ADC 值,并发现胸腰椎间盘的平均ADC 值为(1.5 ± 0.3)×10-3mm2/s,而在腰椎间盘中,头尾方向( Craniocaudal Direction)的ADC 值(ADCZ)远高于与之正交的两个方向上的ADC 值 (ADCX 与ADCY),其结果揭示了椎间盘中水分子扩散的各向异性。该小组进一步比较了正常与退化的椎间盘中ADC 值的差异并发现,较之正常椎间盘,退化椎间盘中的ADCX 与ADCY 值会降低,该研究为椎间盘退化疾病的早期临床诊断提供了新的方法[34]。Antoniou 等人[35]运用相似的方法,发现了椎间盘髓核中ADC 值的降低与其水和糖胺多糖含量降低之间的相关性。Kealey 等人[36]同样发现相对于正常椎间盘,退化椎间盘中的ADC 值有统计意义上的显著降低,更有意思的是,他们发现ADC 值也会随着其所处人体部位的降低而减少,例如,尾椎间盘的ADC 值会低于胸椎间盘。Beattie等人[37]通过对相同病人的重复DWI 测量发现该技术可以稳定而准确地测量髓核中的ADC 值,该技术或许能被发展成为一项诊断椎间盘退化疾病的有效技术。2009 年,Niinimaki等人[38]在对228 位男性中年志愿者的研究中发现中度(四级)退化椎间盘的ADC 值低于正常椎间盘4%,而重度(五级)退化椎间盘的ADC 值反而高于正常椎间盘5%,这可能是由严重退化椎间盘的裂痕中存在自用移动的水分子所致。因此,该研究小组推荐在现有的磁共振技术下,扩散加权磁共振成像技术可能更适用于椎间盘退化流行病学的研究,而非临床诊断研究。
DTI 技术是在DWI 技术基础上进一步发展的新的磁共振成像技术,它可在测量活体组织中水分子ADC 数值的同时对其扩散的方向性进行三维测量,而这种方向性通常可以用于定量描述组织的内部结构特征(例如胶原纤维的分布)。因此,Hsu 和Setton[39]于1999 年首先运用扩散张量成像技术刻画了猪椎间盘中的纤维环薄层结构与三维各项异性的(Anisotropic)水分子扩散性质。Carballido-Gamioa等人[40]运用临床磁共振成像仪(1.5T与3.0T)验证了扩散张量成像技术在椎间盘中的应用可行性,并发现DTISSFSE(DTI with single-shot fast spin-echo)可成为诊断椎间盘的候选DTI临床测量序列,其单次测量时间<4min。最近,Zhang 等人[41]对30位不同年龄的健康志愿者(25 至67 岁)中85 个椎间盘进行临床DTI(3 T)测量并发现随着年龄的增长,平均扩散系数(Mean Diffusivity)下降11%,而部分各向异性(Fractional Anisotropy)值增加20%。他们同时发现这些与老年化相关的椎间盘变化在传统的T2 加权成像技术中无法获得。因此,随着磁共振成像技术的不断发展,DTI 或将成为早期诊断椎间盘退化疾病的一项有效技术。
最新的扩散峰度成像技术(Diffusional Kurtosis Imaging,DKI)是DTI 技术的一个延伸。其主要技术特点在于采用了非正态的概率分布函数来刻画水分子的运动,而DTI 技术中仅假设水分子运动满足正态概率分布[42]。DKI 技术中的重要参数之一,峰度值(Kurtosis)可用来描述水分子运动偏离正态分布的程度,它可对人体组织内部各项异性的微观结构进行表达,由此可定量化地对组织病变进行诊断。Jensen 与Helpern 等人认为,在探测组织微观结构变化方面,DKI 技术拥有比DTI 技术更高的灵敏度,可用于中风和老年痴呆的早期临床诊断[43-45]。DKI 技术用于诊断退化性椎间盘疾病的研究工作还处于非常初期的阶段,但随着该技术的不断发展与相关研究的不断深入,DKI 技术或有希望也成为一项针对该疾病的有效诊断技术。
3 退化性椎间盘疾病的治疗方法
现今针对退化性椎间盘疾病的治疗方法主要分为保守治疗与手术治疗。其中保守治疗通常包括各种物理疗法,休息与药物的结合。而一般在保守治疗不能带来对病症的缓解时,医生会推荐病人考虑进行手术治疗。 最常用的手术治疗包括脊柱融合术(Spinal Fusion)与全椎间盘置换术(Total Disc Replacement)。
3.1 脊柱融合术
脊柱融合手术是在全部切除退化椎间盘后植入融合物或使用骨钉与骨板将上下椎骨固定的手术。该手术往往只能减少由于椎间盘突出引起的疼痛,而对于恢复椎间盘的力学功能没有太多帮助,同时还可能由于对脊柱力学性能的改变而导致邻近节段椎间盘的进一步退化(此为脊柱融合术最主要的并发症)[46]。 近年随着接受脊柱融合治疗病人数量与年龄的增加,治疗过程中的并发症有增加的趋势,相关报道指出该治疗方法需要加强对术中与术后对病人并发症与康复的重视与防治[47]。
3.2 全椎间盘置换术
全椎间盘置换术是在全部切除退化椎间盘后植入人工椎间盘假体(Artificial Intervertebral Disc)并将其与椎骨固定。该手术相对于脊柱融合术最大的优点是最大限度地保持脊柱的运动力学特性与降低对邻近节段椎间盘的不利影响。美国食品与药物监督局分别于2004 年10 月以及2006年1月通过了对两种人工椎间盘假体用于临床治疗的审批,这两种人工椎间盘假体分别为Charité III(Depuy 公司,马塞诸塞州)与ProDisc II(Synthes 公司,宾夕法利亚州),见图3。这些人工假体可以为病人脊柱带来一定的灵活性,但无法承受持续性的压力加载,这可能会引起椎骨上的压力屏蔽,从而导致人工假体的植入失败[48]。
Charité III 与ProDisc II 人工椎间盘假体都有两部分相似的结构组成:① 两片与上下椎骨表面相连的由钴铬合金制成的终盘;② 一片合于两终盘之间的超高分子质量的聚乙烯(Ultra-high Molecular Weight Polyethylene, UHMWPE)核心。其中,UHMWPE 核心与终盘可帮助重建正常椎间盘在两椎骨之间的生理高度,而核心中的半球形结构可以允许在植入体部位的灵活移动。

图3 人工椎间盘假体
用于全椎间盘置换术的Charité III 与ProDisc II 人工椎间盘假体之间的主要区别包括初始固定原理、手术技术,植入方法以及器械的运动学特性等。首先,Charité III 人工假体在每个终盘表面拥有6 个起到固定作用的尖钉(图3.a)而ProDisc II 仅拥有1 个用于固定的中心龙骨(图3.b),这些不同的固定原理揭示了两个假体在初始固定力度,器械移位与失败率方面的区别;其次,在手术技术方面,两者也存在着相对的不同,例如假体插入手术钳上不同的倾斜手柄等;此外,在器械动力学方面,不同的器械约束原理或会为脊柱小平面关节(Facet Joints)带来不同的应变与加载,从而导致位于置换节段的小平面关节在长期有不同程度的退化,退化程度也会因植入器械的不同而各异[49]。
近来,Kishen 等人[50]在对比研究脊椎融合术与全椎间盘置换术的基础上建议这两类针对椎间盘退化性疾病的治疗手段都应在各种保守治疗无效的前提下考虑实施。从短期临床效果来看,两种手术方法有相近的功效,但全椎间盘置换术在减少邻近节段椎间盘退化方面有潜在的优势,该优势需要有长期随访研究来进一步分析验证[51]。
4 问题与展望
4.1 问题
随着现代化生活方式的改变,电脑相关使用量的增多以及人口老龄化,退化性椎间盘疾病的发病率有逐年递增与年轻化的趋势。因此,与该疾病相关的诊断与治疗方法研究亟需不断提高。首先在致病机理方面,创伤与长期不正常的力学加载都会引起椎间盘的退化,椎间盘营养供给的不足同样也被认为是导致其退化的主要因素之一,但其根本的导致椎间盘组织退化的原因还未被彻底揭示,因此,这需要有各学科(如:生物力学,传输学,生物化学与分子生物学等)进步一地联合深入研究。
其次,准确、高效而早期地对退化性椎间盘疾病进行诊断也是亟待解决的问题。常用的CT 或者MRI 技术通常从形态学上进行分析诊断,但该类方法只能有效检测中度与重度的椎间盘退化,对于早期退化病变的探测能力有限,然而基于扩散的磁共振成像技术在这方面有较强潜力。在治疗手段方面,针对该疾病无创无损的保守治疗方法亟需不断发展,以提高该类治疗手段对于早中期退化病变的有效治疗。手术治疗主要针对较重的退化性椎间盘疾病。在两类主要的手术治疗中,脊柱融合术存在局限正常人体力学与运动学性能的缺点,而全椎间盘置换术同样也存在邻近节段椎间盘退化的手术并发症,因此亟需研究更加有效的治疗方法。
4.2 趋势展望
随着现代医学,工程科学与材料科学等的不断进步,针对退化性椎间盘疾病的诊断与治疗方法研究将会不断进步。首先,定量化的MRI 诊断方法或会渐渐替代传统的分级诊断系统,成为临床主要的诊断方案,而基于扩散的MRI 技术也将被进一步研究,并与椎间盘组织生化成分与纤维结构改变相关联,在未来发展出针对早期退化病变的有效诊断技术。其次,手术治疗方面的发展方向包括手术方案的不断完善,人工植入假体设计的不断合理化以及制作人工假体材料的不断改进,以达到进一步保持脊柱运动学特性以及降低手术并发症的目的。
更加值得期待的是随着现代生物工程与再生医学的不断发展,多种新兴的针对椎间盘退化性疾病的治疗方法正在进行动物试验与少量的初期临床试验研究,这些新的治疗方法主要包括生长因子治疗(Injection of Growth Factor)[52]、基因治疗(Gene Therapy)[53]、组织工程(Tissue Engineering)与再生椎间盘(Regenerated Intervertebral Disc)[54-55]以及细胞植入治疗(Cell Transplantation)[56]等。这些新的治疗方法都会明显地减少由于传统手术所带来的创伤,并降低由于植入人工假体所带来的不利影响,因此可能会成为未来治疗椎间盘退化性疾病的重要突破口。
[1] Andersson GB,An HS,Oegema TR,et al.Intervertebral disc degeneration.Summary of an AAOS/NIH/ORS workshop,September 2005[J].J Bone Joint Surg Am, 2006,88(4):895-899.
[2] Luoma K,Riihimaki H,Luukkonen R,et al. Low back pain in relation to lumbar disc degeneration[J].Spine (Phila Pa 1976), 2000,25(4):487-492.
[3] Boos N,Weissbach S, Rohrbach H,et al.Classification of age-related changes in lumbar intervertebral discs:2002 Volvo Award in basic science[J].Spine (Phila Pa 1976),2002,27(23):2631-2644.
[4] Miller JA,Schmatz C,Schultz AB.Lumbar disc degeneration:correlation with age,sex,and spine level in 600autopsy specimens[J]. Spine (Phila Pa 1976),1988,13(2):173-178.
[5] Gu WY,Mao XG,Rawlins BA,et al.Streaming potential of human lumbar anulus fibrosus is anisotropic and affected by disc degeneration[J].J Biomech,1999,32(11):1177-1182.
[6] Urban JP,Maroudas A.Swelling of the intervertebral disc in vitro[J].Connect Tissue Res,1981,9(1):1-10.
[7] Bayliss MT,Urban JP, Johnstone B,et al. In vitro method for measuring synthesis rates in the intervertebral disc[J].J Orthop Res,1986,4(1):10-17.
[8] Urban JP.The role of the physicochemical environment in determining disc cell behaviour[J].Biochem Soc Trans, 2002,30(Pt 6):858-864.
[9] Phillips FM,Lauryssen C. The Lumbar Intervertebral Disc[C].In: Phillips FMaCL Ed.,Illustrated ed:Thieme,2009:305.
[10] Maroudas A,Stockwell RA,Nachemson A, et al. Factors involved in the nutrition of the human lumbar intervertebral disc: cellularity and diffusion of glucose in vitro[J].J Anat, 1975,120(Pt 1): 113-130.
[11] Marchand F,Ahmed AM. Investigation of the laminate structure of lumbar disc anulus fibrosus[J].Spine (Phila Pa 1976),1990, 15(5):402-410.
[12] Roberts S,Menage J,Sivan S, et al.Bovine explant model of degeneration of the intervertebral disc[J].BMC Musculoskelet Disord,2008(9):24-29.
[13] RajPP.Intervertebraldisc:anatomy-physiology -pathophysiology-treatment[J].Pain Pract,2008,8(1):18-44.
[14] Roberts S,Menage J,Urban JP.Biochemical and structural properties of the cartilage end-plate and its relation to the intervertebral disc[J].Spine (Phila Pa 1976),1989,14(2):166-174.
[15] Horner HA,Roberts S,Bielby RC,et al.Cells from different regions of the intervertebral disc:effect of culture system on matrix expression and cell phenotype[J].Spine (Phila Pa 1976),2002,27(10):1018-1028.
[16] Setton LA,Chen J.Cell mechanics and mechanobiology in the intervertebral disc[J].Spine (Phila Pa 1976),2004,29(23):2710-2723.
[17] Donnan FG.The Theory of Membrane Equilibria[J].ChemRev, 1924,(1):73-90.
[18] Cox JM.Low Back Pain: Mechanism,Diagnosis and Treatment[M].Sixth Edition Edition.Maryland,Williams &Wilkins,1999:28.
[19] Lyons G,Eisenstein SM,Sweet MB.Biochemical changes in intervertebral disc degeneration[J].Biochim Biophys Acta, 1981,673(4):443-453.
[20] Urban JP,McMullin JF.Swelling pressure of the lumbar intervertebral discs:influence of age,spinal level, composition,and degeneration[J].Spine (Phila Pa 1976),1988,13(2):179-187.
[21] Adams MA,McNally DS,Dolan P.'Stress'distributions inside intervertebral discs.The effects of age and degeneration[J].JBone Joint Surg Br,1996,78(6):965-972.
[22] Majumdar S,Link TM,Steinbach LS,et al.Diagnostic tools and imaging methods in intervertebral disk degeneration[J].Orthop Clin North Am,2011,42(4):501-511,viii.
[23] Pfirrmann CW,Metzdorf A, Zanetti M,et al.Magnetic resonance classification of lumbar intervertebral disc degeneration[J].Spine (Phila Pa 1976),2001,26(17):1873-1878.
[24] Thompson JP,Pearce RH,Schechter MT,et al.Preliminary evaluation of a scheme for grading the gross morphology of the human intervertebral disc[J].Spine (Phila Pa 1976),1990,15(5):411-415.
[25] Griffith JF,Wang YX,Antonio GE, et al. Modified Pfirrmann grading system for lumbar intervertebral disc degeneration[J].Spine (Phila Pa 1976),2007,32(24): E708-712.
[26] Watanabe A,Benneker LM,Boesch C,et al.Classification of intervertebral disk degeneration with axial T2 mapping[J].AJR Am J Roentgenol,2007,189(4):936-942.
[27] Auerbach JD, Johannessen W, Borthakur A, et al. In vivo quantification of human lumbar disc degeneration using T(1rho)-weighted magnetic resonance imaging[J].Eur Spine J, 2006,15(Suppl 3):S338-344.
[28] Perry J,Haughton V,Anderson PA,et al.The value of T2 relaxation times to characterize lumbar intervertebral disks: preliminary results[J].AJNR Am J Neuroradiol,2006,27(2):337-342.
[29] Marinelli NL, Haughton VM, Munoz A, et al. T2 relaxation times of intervertebral disc tissue correlated with water content and proteoglycan content[J].Spine (Phila Pa 1976),2009, 34(5):520-524.
[30] Blumenkrantz G,Zuo J,Li X,et al.In vivo 3.0-tesla magnetic resonance T1rho and T2 relaxation mapping in subjects with intervertebral disc degeneration and clinical symptoms[J].Magn Reson Med,2010,63(5):1193-1200.
[31] Trattnig S,Stelzeneder D,Goed S,et al.Lumbar intervertebral disc abnormalities:comparison of quantitative T2 mapping with conventional MR at 3.0 T[J].Eur Radiol,2010,20(11):2715-2722.
[32] Welsch GH,Trattnig S,Paternostro-Sluga T,et al.Parametric T2 and T2⋆ mapping techniques to visualize intervertebral disc degeneration in patients with low back pain: initial results on the clinical use of 3.0 Tesla MRI[J].Skeletal Radiol,2011,40(5):543-551.
[33] Kerttula LI,Jauhiainen JP,Tervonen O,et al.Apparent diffusioncoefficient in thoracolumbar intervertebral discs of healthy young volunteers[J].J Magn Reson Imaging,2000,12(2):255-260.
[34] Kerttula L,Kurunlahti M,Jauhiainen J,et al. Apparent diffusion coefficients and T2 relaxation time measurements to evaluate disc degeneration. A quantitative MR study of young patients with previous vertebral fracture[J].Acta Radiol,2001,42(6):585-591.
[35] Antoniou J,Demers CN,Beaudoin G,et al. Apparent diffusion coefficient of intervertebral discs related to matrix composition and integrity[J].Magn Reson Imaging,2004,22(7):963-972.
[36] Kealey SM,Aho T,Delong D,et al.Assessment of apparent diffusion coefficient in normal and degenerated intervertebral lumbar disks: initial experience[J].Radiology,2005,235(2):569-574.
[37] Beattie PF,Morgan PS,Peters D.Diffusion-weighted magnetic resonance imaging of normal and degenerative lumbar intervertebral discs: a new method to potentially quantify the physiologic effect of physical therapy intervention[J].J Orthop Sports Phys Ther,2008,38(2):42-49.
[38] Niinimaki J,Korkiakoski A,Ojala O,et al. Association between visual degeneration of intervertebral discs and the apparent diffusion coefficient[J].Magn Reson Imaging,2009,27(5):641-647.
[39] Hsu EW,Setton LA.Diffusion tensor microscopy of the intervertebral disc anulus fibrosus[J].Magn Reson Med,1999, 41(5):992-999.
[40] Carballido-Gamio J,Xu D,Newitt D,et al. Single-shot fast spin-echo diffusion tensor imaging of the lumbar spine at 1.5 and 3 T[J].Magn Reson Imaging,2007,25(5):665-670.
[41] Zhang Z,Chan Q,Anthony MP,et al.Age-related diffusion patterns in human lumbar intervertebral discs: a pilot study in asymptomatic subjects[J].Magn Reson Imaging,2012,30(2):181-188.
[42] Jensen JH,Helpern JA,Ramani A,et al. Diffusional kurtosis imaging: the quantification of non-gaussian water diffusion by means of magnetic resonance imaging[J].Magn Reson Med,2005,53(6):1432-1440.
[43] Helpern JA,Adisetiyo V,Falangola MF, et al.Preliminary evidence of altered gray and white matter microstructural development in the frontal lobe of adolescents with attentiondeficit hyperactivity disorder:a diffusional kurtosis imaging study[J].J Magn Reson Imaging,2011,33(1):17-23.
[44] Jensen JH, Falangola MF, Hu C, et al. Preliminary observations of increased diffusional kurtosis in human brain following recent cerebral infarction[J].NMR Biomed,2011,24(5):452-457.
[45] Jensen JH,Hui ES,Helpern JA.Double-pulsed diffusional kurtosis imaging[J].Nmr in Biomedicine,2014,27(4):363-370.
[46] Cowan JA,Jr.,Dimick JB,Wainess R,et al.Changes in the utilization of spinal fusion in the United States[J].Neurosurgery,2006,59(1):15-20.
[47] Pumberger M,Chiu YL,Ma Y,et al.National in-hospital morbidity and mortality trends after lumbar fusion surgery between 1998 and 2008[J].Journal of Bone and Joint Surgery-British Volume,2012,94B(3):359-364.
[48] Shuff C,An HS.Artificial disc replacement: the new solution for discogenic low back pain? [J].Am J Orthop (Belle Mead NJ), 2005,34(1):8-12.
[49] Shim CS,Lee SH,Shin HD,et al.CHARITE versus ProDisc:a comparative study of a minimum 3-year follow-up[J].Spine (Phila Pa 1976),2007,32(9):1012-1018.
[50] Kishen TJ,Diwan AD.Fusion versus disk replacement for degenerative conditions of the lumbar and cervical spine: quid est testimonium?[J].Orthop Clin North Am,2010,41(2):167-181.
[51] Nandyala SV,Marquez-Lara A,Fineberg SJ,et al.Comparison Between Cervical Total Disc Replacement and Anterior Cervical Discectomy and Fusion of 1 to 2 Levels From 2002 to 2009[J].Spine (Phila Pa 1976),2014,39(1):53-57.
[52] Chujo T,An HS, Akeda K,et al. Effects of growth differentiation factor-5 on the intervertebral disc--in vitro bovine study and in vivo rabbit disc degeneration model study[J].Spine (Phila Pa 1976),2006,31(25):2909-2917.
[53] Wallach CJ,Sobajima S,Watanabe Y,et al. Gene transfer of the catabolic inhibitor TIMP-1 increases measured proteoglycans in cells from degenerated human intervertebral discs[J].Spine (Phila Pa 1976),2003,28(20):2331-2337.
[54] Sakai D,Nakai T,Mochida J,et al.Differential phenotype of intervertebral disc cells: microarray and immunohistochemical analysis of canine nucleus pulposus and anulus fibrosus[J].Spine (Phila Pa 1976),2009,34(14):1448-1456.
[55] Werner BC,Li XD,Shen FH.Stem cells in preclinical spine studies[J].Spine Journal,2014,14(3):542-551.
[56] Ganey T,Libera J,Moos V,et al. Dis chondrocyte transplantation in a canine model: a treatment for degenerated or damaged intervertebral disc[J].Spine (Phila Pa 1976),2003,28(23):2609-2620.
Diagnosis and Treatment Technology for Degenerative Disc Disease
SHI Chang-cheng1,2, YAO Hai2,3
1. Research Center for Terahertz Technology, Chongqing Institute of Green and Intelligent Technology, Chinese Academy of Sciences, Chongqing 400714, China; 2. Clemson-MUSC Joint Bioengineering Program, Department of Bioengineering, Clemson University, Clemson, SC, USA 29634; 3. Department of Orthopaedic Surgery, Medical University of South Carolina (MUSC), Charleston, SC, USA 29425
Degenerative disc disease (DDD) is a major health concern which signi fi cantly a ff ects people’s daily activities due to limited functionality of the spine. Considering modern ways of living and working, the annual incidence of DDD has been continuously increasing as well as afflicting an increasingly younger age group. Therefore, the technologies for the diagnosis and treatment of DDD need to be further developed. The basic anatomy of the human intervertebral disc (IVD) as well as its biochemical components and their related functions are brie fl y introduced in this review. Furthermore, the di ff erent diagnostic techniques for DDD are summarized and compared, including the conventional IVD grading system as well as varied quantitative magnetic resonance imaging (MRI) methods. In addition, two current surgical treatments, e.g., spinal fusion and total disc replacement, were discussed and analyzed. After evaluating the literatures and identifying existing issues involving available diagnostic techniques and clinical treatment options for DDD, the future directions of DDD related research and studies were presented.
degenerative disc disease (DDD); intervertebral disc (IVD) degeneration grading system; diffusion magnetic resonance imaging (diffusion MRI) ; spinal fusion; total disc replacement (TDR); tissue regeneration
R681.5+3
A
10.3969/j.issn.1674-1633.2015.03.001
1674-1633(2015)03-0001-07
2014-09-17
2014-10-07
姚海,副教授。
通讯作者邮箱:haiyao@clemson.edu

