糖尿病大鼠背根神经节JNK的表达水平对足部皮肤组织学变化的影响*
倪桂莲, 崔 融, 陈干明, 吴仲敏
(临海市第一人民医院 1神经内科, 2内分泌科,浙江 临海 317000; 3台州学院医学院人体解剖学教研室,浙江 台州 318000)
糖尿病大鼠背根神经节JNK的表达水平对足部皮肤组织学变化的影响*
倪桂莲1, 崔 融1, 陈干明2, 吴仲敏3△
(临海市第一人民医院1神经内科,2内分泌科,浙江 临海 317000;3台州学院医学院人体解剖学教研室,浙江 台州 318000)
目的: 观察糖尿病(DM)大鼠皮肤组织学改变,探讨背根神经节(DRG)内c-Jun氨基端激酶(JNK)蛋白在其中的可能作用机制。方法: 雄性SD大鼠腹腔注射链脲佐菌素制备DM模型,分别取正常对照(control)组、DM 2周(DM2)组、DM 4周(DM4)组和DM 8周(DM8)组大鼠足底皮肤标本进行PGP 9.5免疫组化染色和HE染色,观察皮肤PGP 9.5免疫阳性神经末梢和皮肤组织结构变化;同时采用Western blotting法分别检测上述各组大鼠足底皮肤组织内PGP 9.5蛋白和脊髓腰5~6(L5,6)、骶1(S1)节段DRG内JNK和p-JNK蛋白的表达。结果: 大鼠足底皮肤PGP 9.5免疫阳性神经末梢主要分布于表皮基底层和真皮乳头层,与正常对照组比较,DM4组大鼠表皮阳性神经末梢密度减少,分布稀疏,DM8组大鼠表皮阳性神经末梢分布明显减少,神经直径变细,长度变短,走形扭曲;组织学观察可见,DM4组大鼠表皮组织变薄,表皮细胞层次减少,细胞分布及排列不均匀,DM8组大鼠表皮细胞层次明显减少,细胞肿胀模糊,细胞间隙增大,部分表皮缺乏复层排列, 真皮层胶原纤维萎缩、变性,皮下脂肪明显减少。蛋白印迹检测发现皮肤组织内PGP 9.5蛋白的表达随病程呈渐进性减弱;同时L5,6-DRG和S1-DRG内p-JNK蛋白的水平呈现渐进性增强趋势。DM大鼠皮肤PGP 9.5免疫阳性神经末梢吸光度值与L5,6-DRG和S1-DRG内的p-JNK蛋白灰度值之间呈负相关(P<0.01);与表皮厚度值之间呈显著正相关。结论: DM大鼠皮肤组织和皮肤神经均存在明显形态结构改变,同时存在L5,6-DRG和S1-DRG内p-JNK蛋白的渐进性高表达,DM大鼠皮肤PGP 9.5免疫阳性神经末梢密度变化与L5,6-DRG和S1-DRG内p-JNK蛋白水平的变化之间呈负相关;与表皮厚度的变化呈显著正相关。皮肤神经形态结构的改变可能与背根神经节细胞JNK/SAPK通路活化有关,阻断或抑制JNK/SAPK通路可以起到延缓糖尿病周围神经病变,减轻皮肤组织病变发生的作用。
背根神经节; c-Jun氨基端激酶; 糖尿病; 皮肤组织; 皮肤神经
糖尿病(diabetes mellitus,DM)的并发症是引起糖尿病患者致死、致残的主要原因,在各种糖尿病诱发的并发症中,末梢神经病变和皮肤病变的发病率非常高。据有关资料显示,约50%的糖尿病患者出现末梢神经病变[1-2]。而糖尿病患者罹患皮肤病的比例达30%[3],末梢神经病变是肢体保护性的机械性感觉丧失、创伤性溃疡损伤并因此截肢的主要原因。皮肤病变可加重糖尿病病情,甚至导致十分严重的后果[4]。因此,研究糖尿病早期皮肤组织和神经的病变特点,并予以早期治疗干预,对于防治糖尿病并发症和提高患者生活质量有着重要的意义。
本研究采用链脲佐菌素腹腔注射制备糖尿病大鼠模型,采用PGP 9.5免疫组化染色和HE染色方法观察实验大鼠足底皮肤神经和皮肤组织形态结构的变化,并通过检测大鼠足底皮肤组织内PGP 9.5蛋白及对应的腰5、6(lumbar 5,6,L5,6)背根神经节(dorsal root ganglia, DRG)和骶1(sacral 1,S1)-DRG内c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)和p-JNK蛋白的表达变化,探讨背根神经节JNK活化对糖尿病大鼠皮肤组织和皮肤神经形态结构的影响。
材 料 和 方 法
1 材料
链脲佐菌素(Sigma),临用前用0.1 mol/L柠檬酸钠缓冲液,pH 4.5,4 ℃配制成2%溶液;兔抗PGP 9.5抗体(Santa Cruz);兔抗JNK和p-JNK抗体(Sigma);SP免疫组化染色试剂盒(福州迈新公司)。
2 方法
2.1 糖尿病大鼠模型的建立及分组 雄性SD大鼠60只,体重(200±20)g,购自浙江省实验动物中心;适应性喂养1周,取尾静脉血0.1 mL,测定随机血糖后,大鼠按随机数字表随机分为正常对照组(control组,30只)和DM模型组(DM组,30只)。大鼠造模前禁食至少12 h,DM组大鼠按55 mg/kg一次性腹腔注射链脲佐菌素,control组则注射等体积柠檬酸钠缓冲液,1周后尾静脉采血测定血糖,同时监测体重,若诱导前血糖水平<6 mmol/L,诱导后血糖水平>11.2 mmol/L,随机抽样的胰腺组织学观察证实胰岛细胞被破坏,即可视为糖尿病模型诱导成功。再将造模成功后的大鼠按饲养时间随机分为2周组(DM2)、4周组(DM4)和8周组(DM8),每组10只。实验期间全部大鼠予普通饲料喂养,自由进食和水。
2.2 足部皮肤组织HE染色 在造模成功后的第2、4、8周,分别随机取control组和DM组大鼠各5只经腹腔注射1%戊巴比妥钠60 mg/kg麻醉,4%多聚甲醛灌注固定后,随机选取足底皮肤全层组织,按常规方法作HE染色,观察皮肤全层厚度、表皮细胞层次、排列和结构的变化。采用C5 型目镜测微尺(上海第三光学仪器厂)测量表皮厚度,每个活检标本有5张切片参加测量,每张切片在3个显微镜视野下进行观察,最后取其平均值,表皮厚度以表皮-真皮交界处与颗粒细胞层最外层之间的垂直距离表示[5]。
2.3 足部皮肤组织内PGP 9.5免疫组化染色 上述各组大鼠多聚甲醛灌注固定后,随机选取1 cm×1 cm左右的足底全层皮肤做连续冰冻切片,切片角度为垂直皮肤表面,常规方法进行PGP 9.5免疫组化染色。切片分为2套,其中1套在呈色后进行苏木素复染,另1套不复染。所有切片经自然干燥后常规脱水,透明,封片。Nikon显微镜下观察并摄片。阴性对照切片用PBS液替代I抗,其余实验步骤不变。取无复染的图片做显微图像分析(采用OPTIMAS 6.5 图像分析软件),得出各组大鼠足底皮肤内PGP 9.5阳性神经末梢的图像吸光度(A)值。
2.4 足部皮肤组织内PGP 9.5蛋白和背根神经节内JNK和p-JNK蛋白的检测 在造模成功后的第2、4、8周,分别随机取control组和DM组大鼠各5只经腹腔注射1%戊巴比妥钠60 mg/kg深麻醉后,随机选取足底皮肤全层组织以及L5,6-DRG、S1-DRG,冰浴中分别抽提总蛋白,BCA法测定蛋白浓度。分别取20 μg蛋白进行10% SDS-PAGE并转膜。5%脱脂奶粉封闭1 h后,加入目标蛋白I抗(1∶1 000)或β-actin I抗(1∶500),4 ℃反应过夜。次日洗膜,加入1∶1 000辣根过氧化物酶标记的II抗,室温孵育1 h,洗膜后加ECL显色剂,X片显影,所得结果以β-actin为内参照,用Quantity One 软件对反应条带进行半定量分析,记录所测的灰度值,并以和同组β-actin灰度值的比值表示目的蛋白的相对表达量。
3 统计学处理
各组数据以均数±标准差(mean±SD)表示,统计处理用SPSS 17.0软件进行分析,两组间比较采用t检验,多组间比较采用单因素方差(one-way ANOVA)分析,进一步两两比较采用LSD检验,相关性分析采用Spearman相关分析。以P<0.05为差异有统计学意义。
结 果
1 正常对照组、糖尿病模型组大鼠体重、血糖变化
造模前2组大鼠体重无明显差异,造模后大鼠每日饮水、饮食以及尿量显著增多,体重下降,DM组大鼠体重增长缓慢,与control组比较差异有统计学意义(P<0.01),见表1。造模后糖尿病大鼠血糖明显升高,与control组比较差异有统计学意义(P<0.01),见表2。

表1 大鼠体重的变化
**P<0.01vscontrol group.

表2 大鼠血糖的变化
**P<0.01vscontrol group.
2 足部皮肤PGP 9.5免疫阳性神经末梢形态分布变化
如图1所示,大鼠足底皮肤PGP 9.5免疫阳性神经末梢主要分布于表皮基底层和真皮乳头层,呈树枝状或念珠状分布,大多成束走行,长短不一,有的呈结节状膨大。PGP 9.5免疫组化图像A值测定结果表明,DM组PGP 9.5免疫阳性神经末梢分布密度随病程推移呈现进行性下降趋势,与同时期C组比较差异有统计学意义(P<0.01); 各时点control组的PGP 9.5免疫阳性神经末梢分布密度差异无统计学意义,各时点DM组对应值差异有统计学意义(P<0.01),进一步做LSD两两比较发现,DM8组明显低于DM2组(P<0.01)和DM4组(P<0.05),见表3。

Figure 1.Distribution of PGP 9.5 immunoreactive nerve terminals in the plantar skin of rats (HE counterstaining, ×400).

表3 大鼠足底皮肤PGP 9.5免疫组化图像吸光度(A)值的变化
**P<0.01vscontrol group;△△P<0.01vsDM2 group;#P<0.05vsDM4 group.
3 足部皮肤组织内PGP 9.5蛋白表达变化
如图2所示,与同时点control组比较,DM各组大鼠足底皮肤组织内PGP 9.5蛋白表达呈进行性减弱,PGP 9.5蛋白表达的变化趋势与足底皮肤PGP 9.5免疫阳性神经末梢密度变化趋势相吻合。

Figure 2.The changes of PGP 9.5 expression in the plantar skin of the rats. Mean±SD. n=5. ** P<0.01 vs control group; △△P<0.01 vs DM2 group; ##P<0.01 vs DM4 group.
4 足部皮肤厚度和组织结构变化
DM大鼠表皮厚度较同时期C组明显变薄(P<0.01),control组各时点表皮厚度无明显差异,DM组表皮厚度随着病程延长而变薄,各时点间差异有统计学意义(P<0.01),进一步作LSD两两比较发现,DM8组明显低于DM2组和DM4组(P<0.01),见表4。如图3所示,DM4组大鼠表皮组织变薄,表皮细胞层次减少,DM8组大鼠表皮组织明显变薄,表皮细胞层次明显减少,细胞肿胀模糊,细胞间隙增大,且部分表皮缺乏复层排列,真皮层胶原纤维萎缩、变性,皮下脂肪明显减少。

Figure 3.The changes of the plantar skin epidermal thickness and cell morphology in the rats (HE staining, ×200).

表4 大鼠足底皮肤厚度值的变化
**P<0.01vscontrol group;△△P<0.01vsDM2 group;##P<0.01vsDM4 group.
5 背根神经节内JNK和p-JNK蛋白表达变化
如图4所示,与同时点C组比较,DM各组大鼠L5,6-DRG和S1-DRG内p-JNK水平呈渐进性增强,p-JNK/JNK比值不断增高,差异有统计学意义(P<0.01);DM组各时点p-JNK水平的差异有统计学意义(P<0.01),进一步LSD两两比较发现,DM8组大鼠p-JNK的水平明显高于DM2组与DM4组(P<0.01),见表5。

表5 大鼠背根神经节JNK和p-JNK蛋白水平的变化
**P<0.01vscontrol group;△△P<0.01vsDM2 group;##P<0.01vsDM4 group.
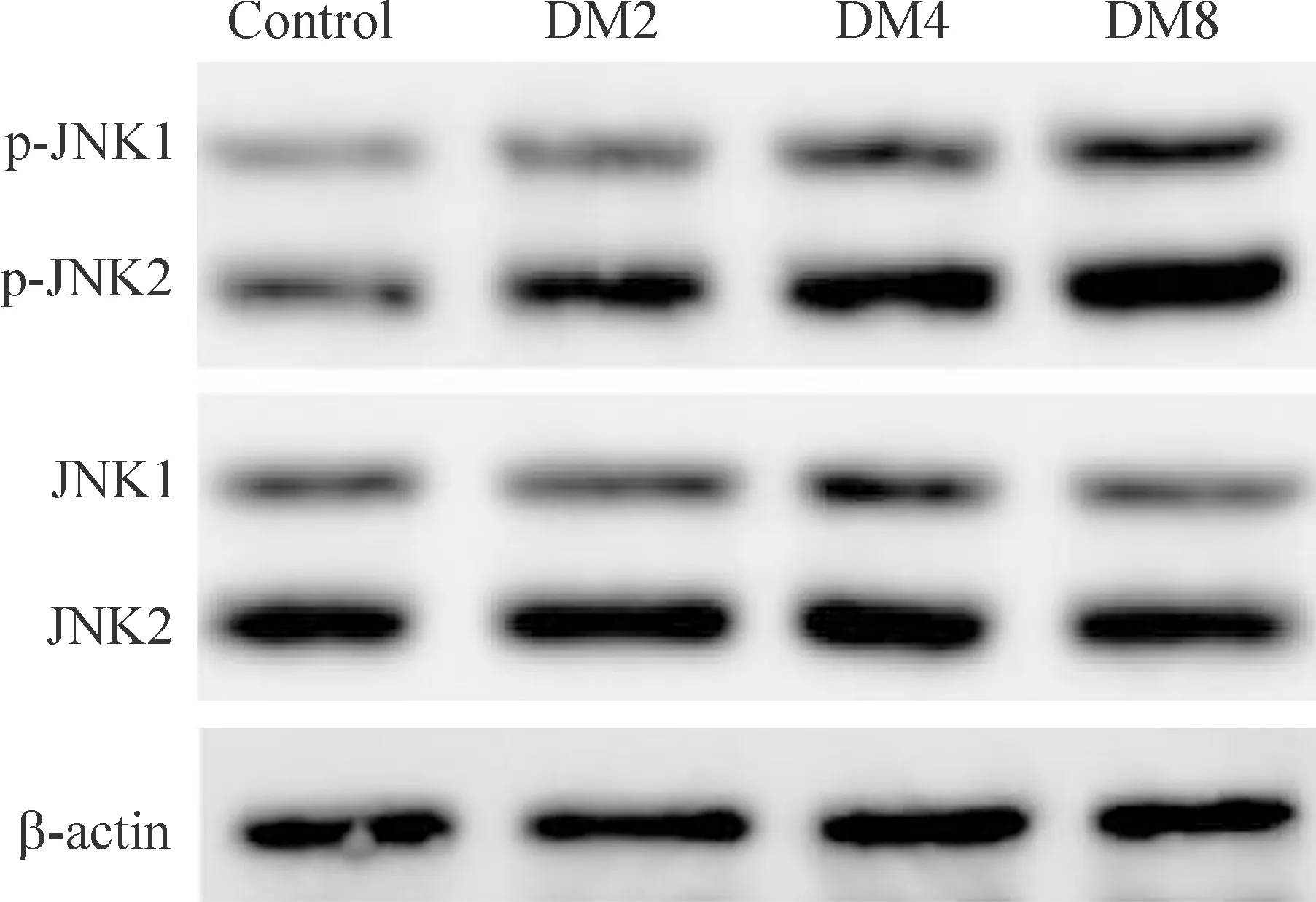
Figure 4.The changes of JNK and p-JNK protein levels in L5-DRG, L6-DRG and S1-DRG of the rats.
6 足部皮肤神经密度、皮肤厚度和背根神经节内p-JNK蛋白表达的相关性分析
Spearman相关分析显示,DM大鼠皮肤PGP 9.5免疫阳性神经末梢密度与皮肤表皮厚度(P<0.01)之间呈显著正相关(图5),与L5,6-DRG、S1-DRG内p-JNK(P<0.01)蛋白水平之间呈负相关(图6)。
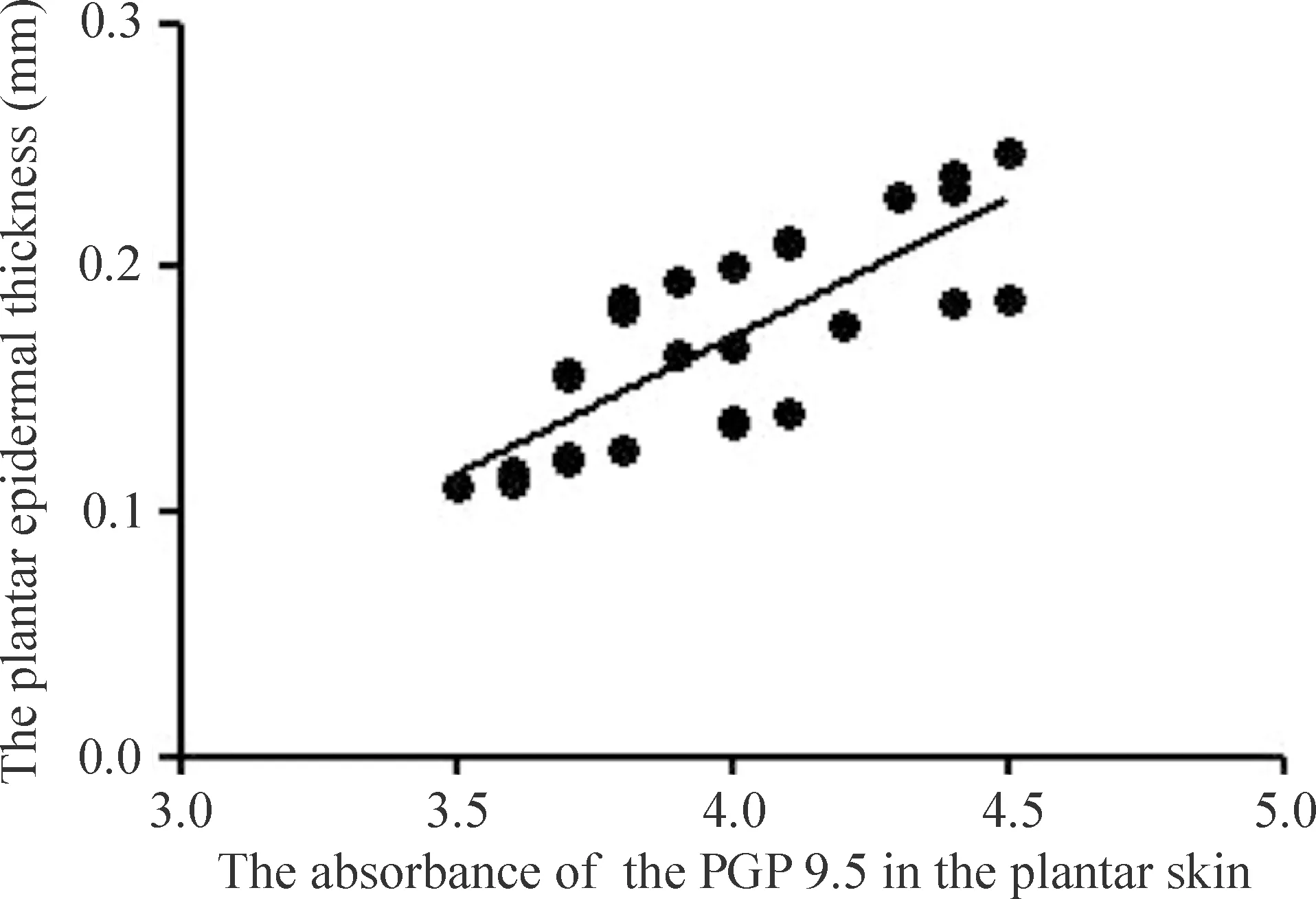
Figure 5.Correlation between the absorbance of the PGP 9.5 and epidermal thickness of the plantar skin in DM group after injection of streptozotocin.

Figure 6.Correlation between the absorbance of the PGP 9.5 and gray level of the p-JNK in DM group after injection of streptozotocin.
讨 论
众所周知,糖尿病本身并不可怕,可怕的是伴随而来的各类并发症,在糖尿病诱发的并发症中,以末梢神经病变和皮肤病变最为常见。糖尿病患者出现皮肤感觉功能障碍常常诱发肢体的慢性溃疡,造成临床治疗中许多患者难以愈合,最终不得不截肢。因此,针对糖尿病皮肤神经和皮肤组织病变关系及其机制的研究越来越受到人们的重视[6]。既往研究认为皮肤神经损害是糖尿病皮肤病变等慢性并发症发生的机理之一。研究发现糖尿病大鼠表皮厚度变化与皮肤神经病变相关[7-8]。支配皮肤(包括表皮)的神经纤维源于背根神经节,主要C类和Aa纤维,皮肤神经通过释放神经肽等参与皮肤完整性的保持和修复,外周神经损害可伴发皮肤营养机能和愈合能力改变导致皮肤溃疡和坏死。本研究发现,糖尿病大鼠足底皮肤神经的分布密度与正常对照组相比明显减少,皮肤神经分布密度减少的同时伴随着皮肤表皮厚度的变薄以及皮肤组织结构的改变,两者之间存在显著正相关,提示皮肤神经病变与皮肤组织结构改变之间有一定的内在联系。
关于糖尿病皮肤神经病变的发病机制至今尚未完全阐明,一般认为与糖尿病引起的皮肤神经结构和功能障碍有关。胰岛素缺乏和高血糖是始动因素,神经缺血、多元醇通路活性增高、神经营养因子减少、自身免疫等共同参与其发病过程。有研究报道,大鼠L5脊神经结扎后能诱导L5-DRG中JNK的激活,且主要位于小型的C纤维神经元中;在L5-DRG中注射JNK抑制剂D-JNKI-1能阻止却不能逆转SNL引起的触诱发痛;提示DRG中JNK的激活在神经性疼痛的产生和维持中担任重要角色[9-10]。我们在前期的实验中发现,糖尿病性神经痛大鼠背根神经节内p-JNK免疫阳性神经元明显增多,提示糖尿病大鼠皮肤痛觉过敏可能与背根神经节相关神经元JNK的激活有关[11]。
JNK是一类丝氨酸/苏氨酸蛋白激酶,属于丝裂原活化蛋白激酶家族,通过信号级联使底物磷酸化,从而调节细胞功能。当细胞受到刺激时,JNK信号通路可被不同的受体激活,调节细胞的发育、分化、凋亡等,大量研究显示其活化与神经病理性疼痛的发生发展有关[12]。本研究发现,随着糖尿病病程的延长,糖尿病大鼠皮肤神经、表皮厚度和皮肤组织结构出现渐进性病理改变,同时存在初级感觉神经元p-JNK蛋白表达的进行性增强。相关性分析显示,糖尿病大鼠皮肤PGP 9.5免疫阳性神经末梢分布密度与L5,6-DRG、S1-DRG内p-JNK的水平变化呈负相关;与表皮厚度的变化呈显著正相关。我们认为,背根神经节JNK活化与糖尿病大鼠皮肤神经和皮肤组织病变有关。
综上所述,糖尿病大鼠足底皮肤神经的分布密度明显减少,神经直径变细,长度变短,走行扭曲,同时皮肤表皮厚度明显变薄,表皮细胞层次明显减少,表皮细胞肿胀模糊,细胞间隙增大,真皮层胶原纤维萎缩、变性,皮下脂肪进行性减少,相关性分析显示,糖尿病大鼠皮肤神经末梢分布密度变化与表皮厚度变化之间呈显著正相关,提示皮肤神经病变和皮肤组织结构改变之间存在密切关系。本研究同时发现,支配足底皮肤的腰骶段背根神经节内p-JNK蛋白的水平呈现进行性增加,且背根神经节内p-JNK蛋白水平的变化与大鼠足底皮肤组织内PGP 9.5阳性神经末梢的分布密度变化呈负相关,提示背根神经节JNK活化与糖尿病大鼠皮肤神经病变有关,阻断或抑制JNK/SAPK通路可以起到延缓糖尿病周围神经病变,进而减轻皮肤组织病变发生作用。具体作用机制有待进一步探讨。
[1] 侯瑞芳,汤正义,宁 光.糖尿病周围神经病变的检查方法及其诊断效率[J].国际内分泌代谢杂志,2006,26(4):270-272.
[2] 徐迎胜,郑菊阳,张 朔,等.糖尿病周围神经病的小纤维损害[J].中国神经精神疾病杂志,2008,34(10):591-593.
[3] 侯麦花,朱文元.糖尿病与皮肤病[J].临床皮肤科杂志,2006, 35(2):122-124.
[4] 朱 平,严 励,陈黎红,等.MMP-9/MMP-1表达在糖尿病鼠皮肤伤口愈合过程中的变化及意义初探[J].中国病理生理杂志,2008,24(11):2204-2208.
[5] 凌 丽,江新梅,薛金伟,等.糖尿病患者表皮厚度和汗腺神经分布的变化[J].中国老年学杂志,2009,29(4):455-457.
[6] Jong CW, Sang SK, Kyung SK, et al. Current status of diabetic peripheral neuropathy in Korea: report of a hospital-based study of type 2 diabetic patients in Korea by the Diabetic Neuropathy Study Group of the Korean Diabetes Association[J]. Diabetes Metab J, 2014, 38(1):25-31.
[7] 林炜栋,陆树良,陈向芳,等.糖尿病大鼠皮肤的组织化学改变[J].中国病理生理杂志,2005,21(2):230-233.
[8] 王 琳,李国锋,胡文军,等.糖尿病大鼠皮肤的组织学改变及其对糖皮质激素药物经皮吸收的影响[J].药学学报,2010,45(1):114-119.
[9] Middlemas A, Delcmix JD, Sayers NM, et al. Enhanced activation of axonaly transported stress-activated protein kinases in peripheral nerve in diabetic neuropathy is prevented neurotrophin-3[J]. Brain, 2003, 126(7):1671-1682.
[10]Zhuang ZY, Wen YR, Zhang DR, et al. A peptide c-Jun N-terminal kinase (JNK) inhibitor blocks mechanical allodynia after spinal nerve ligation: respective roles of JNK activation in primary sensory neurons and spinal astrocytes for neuropathic development and maintenance[J]. J Neurosci, 2006, 26(13):3551-3560.
[11]冯荧娣,倪桂莲,汪利琼,等.加巴喷丁对糖尿病性神经痛大鼠机械痛敏和背根神经节神经元JNK及p-JNK表达的影响[J].医学研究杂志,2013,42(10):68-72.
[12]吴 艳,俞陈陈,曹 红.内质网应激蛋白BiP在姜黄素抗2型糖尿病神经病理性疼痛大鼠的作用[J].中国病理生理杂志,2012,28(10):1796-1801.
Effect of JNK expression in dorsal root ganglia on histological change of foot skin in diabetic rats
NI Gui-lian1, CUI Rong1, CHEN Gan-ming2, WU Zhong-min3
(1DepartmentofNeurology,2DepartmentofEndocrinology,FirstPeople’sHospitalofLinhaiCity,Linhai317000,China;3DepartmentofAnatomy,TaizhouUniversitySchoolofMedicine,Taizhou318000,China.E-mail:wzmbest@163.com)
AIM: To observe the change of skin histology in diabetic rats and to investigate the possible me-chanism of c-Jun N-terminal kinase (JNK) protein in the dorsal root ganglion (DRG) during the process. METHODS: Diabetic animal model was established in the male SD rats by intraperitoneal injection of streptozotocin. Plantar skin specimens of the rats were collected from control group, DM 2-week group (DM2), DM 4-week group (DM4), and DM 8-week group (DM8). Immunohistochemical staining and HE staining were used to observe the change of PGP 9.5 immunoreactive nerve terminals and the structures of the skin tissues. The protein expression of PGP 9.5 in the plantar skin tissues, and JNK and p-JNK protein in the DRG within lumbar 5, 6 (L5, 6), and sacral 1 (S1) spinal cord segments were detected by Western blotting. RESULTS: PGP 9.5 immunoreactive nerve terminals of the plantar skin of the rats mainly distributed in the basal layer of the epidermis and papillary dermis. Compared with control group, PGP 9.5 positive nerve terminals in DM4 group showed reduced density and sparse distribution. PGP 9.5 positive nerve terminals in DM8 group showed significantly reduced distribution, thinner nerve diameter, shorter length and distorted shape. Histological changes of the thinner epidermal tissue, reduced epidermal cell layers, uneven cell distribution and arrangement in DM4 group, and significantly reduced epidermal cell layers, swollen and blurred cells, increasing cell gap, lack of stratified epidermis arrangement for part of epidermis, atropal and degenerated dermal collagen fiber, significantly decreased subcutaneous fat in DM8 group were observed. The results of Western blotting showed that the protein expression of PGP 9.5 in the plantar skin tissue of DM rats was progressively decreased along with the disease, while the protein level of p-JNK in L5, 6-DRG or S1-DRG showed a gradual increasing trend. PGP 9.5 immunoreactive positive nerve terminal density of plantar skin in DM rats had a negative correlation with the protein level of p-JNK in L5, 6-DRG and S1-DRG (P<0.01), but showed a significant positive correlation with the plantar skin thickness (P<0.01). CONCLUSION: The protein level of p-JNK within L5, 6-DRG or S1-DRG in DM rats shows a progressive enhancement. At the same time, there is a significant change in the skin tissue density and structure. The changes of skin tissue and nerve morphology in DM rat may be related to the activation of JNK/SAPK pathway in L5, 6-DRG or S1-DRG cells. Blocking or inhibiting JNK/SAPK pathway may delay the diabetic peripheral neuropathy and reduce the risk of skin lesions.
Dorsal root ganglia; c-Jun N-terminal kinase; Diabetes mellitus; Skin tissue; Skin nerve
1000- 4718(2015)03- 0415- 06
2014- 09- 15
2015- 01- 08
浙江省医学会临床科研基金(No. 2012ZYC-A101); 台州市科技局科研基金(No. 1301ky53); 临海市科技局科研基金(No. 12N12)
△通讯作者 Tel: 0576-88665198; E-mail: wzmbest@163.com
R587.1; R363
A
10.3969/j.issn.1000- 4718.2015.03.006

