肺癌患者血清中IL-2、IFN-γ、TNF-α、NKG2D的表达及临床意义
李高,蔡仁中,蔡用清
(海南省人民医院胸外科,海南海口570311)
肺癌患者血清中IL-2、IFN-γ、TNF-α、NKG2D的表达及临床意义
李高,蔡仁中,蔡用清
(海南省人民医院胸外科,海南海口570311)
目的探讨肺癌患者血清中白细胞介素2(IL-2)、γ干扰素(IFN-γ)、肿瘤坏死因子α(TNF-α)、自然杀伤细胞活化受体2D(NKG2D)的表达及其临床意义。方法选择2010年1月至2013年12月期间52例肺癌患者为研究对象,其中肺鳞癌22例,肺腺癌18例,小细胞肺癌12例;肺癌Ⅰ~Ⅱ期20例,Ⅲ~Ⅳ期32例。另选择健康者56例为对照组。检测受试者血清IL-2、IFN-γ、TNF-α、NKG2D水平,并对血清IL-2、IFN-γ、TNF-α、NKG2D水平与年龄、烟龄、病程、肺癌分期、病理类型、BMI进行相关性分析。结果肺癌组患者血清IL-2、IFN-γ、NKG2D水平均低于对照组,差异均有显著统计学意义(P<0.01),而血清TNF-α水平则高于对照组,差异有显著统计学意义(P<0.01);不同类型肺癌之间血清IL-2、IFN-γ、TNF-α、NKG2D等指标水平比较差异均无统计学意义(P>0.05),而不同分期肺癌血清IL-2、IFN-γ、TNF-α、NKG2D水平比较则差异均有统计学意义(P<0.05)。随着肺癌分期的增加,血清IL-2、IFN-γ、NKG2D水平呈下降趋势,且三组间两两比较差异均有显著统计学意义(P<0.01);随着肺癌分期的增加,血清TNF-α水平呈上升趋势,且三组间两两比较差异均有显著统计学意义(P<0.01);血清IL-2、IFN-γ、NKG2D水平与肺癌分期呈负相关(P<0.05),血清TNF-α与肺癌分期呈正相关(P<0.05);血清IL-2、IFN-γ、TNF-α、NKG2D等指标与年龄、烟龄、病程、病理类型、BMI等因素无明显相关性(P>0.05)。结论IL-2、IFN-γ、NKG2D在肺癌患者血清中呈现低表达,而TNF-α在肺癌患者血清中呈现上升趋势,IL-2、IFN-γ、TNF-α、NKG2D与肺癌发病及进展密切相关,因此联合检测IL-2、IFN-γ、TNF-α、NKG2D等指标对肺癌的诊断具有重要意义。
肺癌;IL-2;IFN-γ;TNF-α;NKG2D;相关性
肺癌为常见呼吸系统恶性肿瘤,近年来其患病率呈上升趋势,严重危害患者健康,给家庭及社会带来沉重负担,因此对肺癌进行尽早诊治具有重要意义[1]。Th1细胞为重要的细胞因子,在炎症、免疫调节方面均起重要作用[2]。白细胞介素2(IL-2)、γ干扰素(Interferon gamma,IFN-γ)、肿瘤坏死因子α(Tumor necrosis factor-α,TNF-α)主要由Th1细胞分泌,自然杀伤细胞(NK)活化受体2D(Natural-killer group2,NKG2D)为NK细胞活化性受体,近期研究显示,IL-2、IFN-γ、TNF-α和NKG2D的异常表达与恶性肿瘤的发病相关[3-6]。本研究通过检测肺癌患者血清IL-2、IFN-γ、TNF-α和NKG2D含量,旨在探讨其在肺癌患者中的表达情况及联合检测上述指标对肺癌诊断的价值。
1 资料与方法
1.1 一般资料选择2010年1月至2013年12月期间我院收治的52例肺癌患者为研究对象,年龄45~75岁,中位年龄41岁。52例患者均经我院病理科病理确诊为肺癌。52例肺癌中肺鳞癌22例,肺腺癌18例,小细胞肺癌12例。根据UICC国际TNM标准[1],肺癌分期Ⅰ~Ⅱ期20例;Ⅲ~Ⅳ期32例。本研究均获受试者知情并签署知情同意书。另选择同期在我院体检的健康者56例作为对照组,年龄47~73岁。除烟龄外,两组受试者在年龄、性别、体重指数(BMI)方面比较差异均无统计学意义(P>0.05),见表1。
表1 两组受试者的基本资料比较(±s)
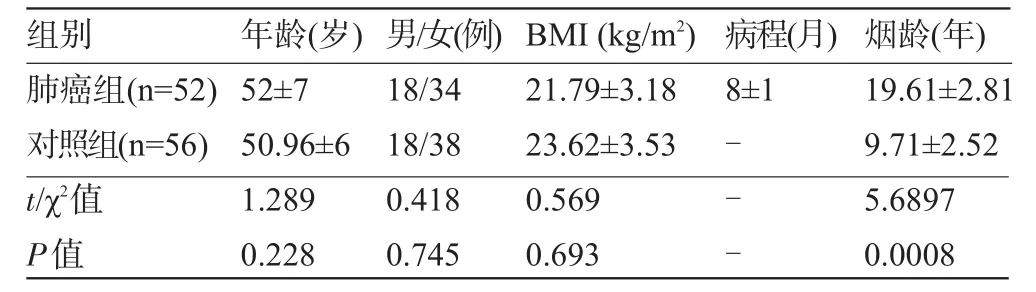
表1 两组受试者的基本资料比较(±s)
注:-表示无该项数据。
组别年龄(岁)男/女(例) B M I ( k g / m2)病程(月)烟龄(年)肺癌组( n = 5 2 )对照组( n = 5 6 ) t / χ2值P值5 2 ± 7 5 0 . 9 6 ± 6 1 . 2 8 9 0 . 2 2 8 1 8 / 3 4 1 8 / 3 8 0 . 4 1 8 0 . 7 4 5 2 1 . 7 9 ± 3 . 1 8 2 3 . 6 2 ± 3 . 5 3 0 . 5 6 9 0 . 6 9 3 8 ± 1 ---1 9 . 6 1 ± 2 . 8 1 9 . 7 1 ± 2 . 5 2 5 . 6 8 9 7 0 . 0 0 0 8
1.2 纳入和排除标准
1.2.1 纳入标准[1]年龄45~75岁;符合原发性肺癌、各病理类型及分期的诊断标准[1];预计生存期在12个月以上;无严重心血管疾病;患者知情同意。
1.2.2 排除标准[1]近期急性感染者;脑血管意外者;肺结核者;有精神疾病史;近3个月内接受过放化疗及免疫治疗者;自身免疫性疾病;糖尿病者;其他系统恶性肿瘤者;有酒精药物滥用史;未完成随访者。
1.3 研究方法
1.3.1 标本采集于清晨空腹状态下抽取受试者外周静脉血5 ml,3 500 r/min离心10 min,上清液-80℃保存待测。
1.3.2 标本检测采用流式细胞仪检测NKG2D;采用CBA法检测IL-2、IFN-γ、TNF-α,试剂盒购自于上海华大科技有限公司,严格按照说明书操作[1]。
1.4 观察指标统计受试者血清IL-2、IFN-γ、TNF-α、NKG2D水平,并对血清IL-2、IFN-γ、TNF-α、NKG2D水平与年龄、烟龄、病程、肺癌分期、病理类型、BMI进行相关性分析。
1.5 统计学方法应用SPSS19.0统计软件进行数据分析,计量资料以均数±标准差±s)表示,两组间比较采用t检验,多组间比较采用方差分析,不同病理类型肺癌、不同分期肺癌组间两两比较采用Newman-Keuls法,采用Pearson检验进行相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 两组受试者血清IL-2、IFN-γ、TNF-α和NKG2D水平比较肺癌组患者的血清IL-2、IFN-γ、NKG2D水平低于对照组,差异均有显著统计学意义(P<0.01),而血清TNF-α水平高于对照组,差异也有显著统计学意义(P<0.01),见表2。
表2 两组受试者的血清IL-2、IFN-γ、TNF-α、NKG2D水平比较(±s)
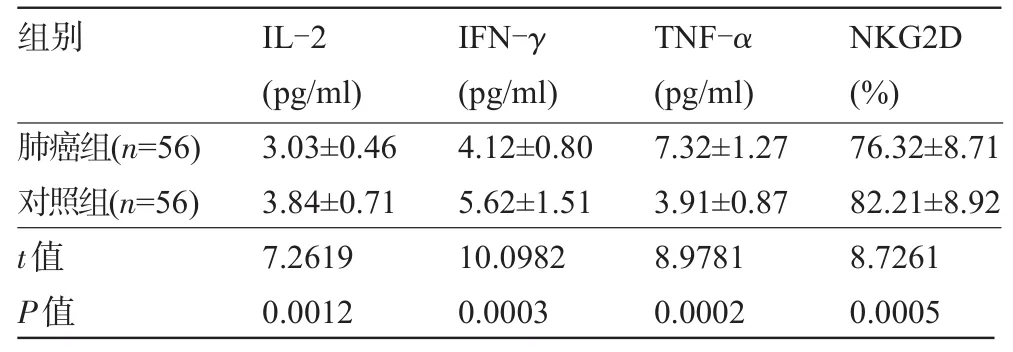
表2 两组受试者的血清IL-2、IFN-γ、TNF-α、NKG2D水平比较(±s)
组别肺癌组( n = 5 6 )对照组( n = 5 6 ) I L -2 ( p g / m l ) 3 . 0 3 ± 0 . 4 6 3 . 8 4 ± 0 . 7 1 I F N -γ ( p g / m l ) 4 . 1 2 ± 0 . 8 0 5 . 6 2 ± 1 . 5 1 T N F -α ( p g / m l ) 7 . 3 2 ± 1 . 2 7 3 . 9 1 ± 0 . 8 7 N K G 2 D ( % ) 7 6 . 3 2 ± 8 . 7 1 8 2 . 2 1 ± 8 . 9 2 7 . 2 6 1 9 0 . 0 0 1 2 t值P值1 0 . 0 9 8 2 0 . 0 0 0 3 8 . 9 7 8 1 0 . 0 0 0 2 8 . 7 2 6 1 0 . 0 0 0 5
2.2 不同病理类型肺癌患者血清IL-2、IFN-γ、TNF-α和NKG2D水平比较不同病理类型肺癌之间血清IL-2、IFN-γ、TNF-α、NKG2D等指标水平差异均无统计学意义(P>0.05),见表3。
表3 不同病理类型肺癌患者血清IL-2、IFN-γ、TNF-α和NKG2D水平比较(±s)
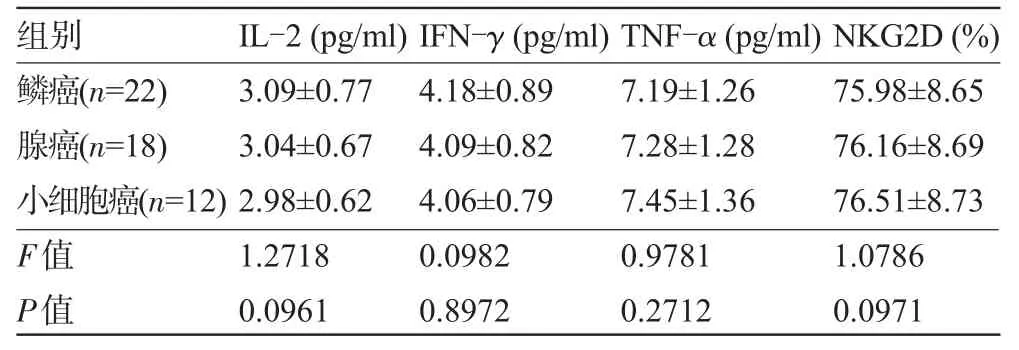
表3 不同病理类型肺癌患者血清IL-2、IFN-γ、TNF-α和NKG2D水平比较(±s)
组别I L -2 ( p g / m l ) I F N -γ ( p g / m l ) T N F -α ( p g / m l ) N K G 2 D ( % )鳞癌( n = 2 2 )腺癌( n = 1 8 )小细胞癌( n = 1 2 ) F值P值3 . 0 9 ± 0 . 7 7 3 . 0 4 ± 0 . 6 7 2 . 9 8 ± 0 . 6 2 1 . 2 7 1 8 0 . 0 9 6 1 4 . 1 8 ± 0 . 8 9 4 . 0 9 ± 0 . 8 2 4 . 0 6 ± 0 . 7 9 0 . 0 9 8 2 0 . 8 9 7 2 7 . 1 9 ± 1 . 2 6 7 . 2 8 ± 1 . 2 8 7 . 4 5 ± 1 . 3 6 0 . 9 7 8 1 0 . 2 7 1 2 7 5 . 9 8 ± 8 . 6 5 7 6 . 1 6 ± 8 . 6 9 7 6 . 5 1 ± 8 . 7 3 1 . 0 7 8 6 0 . 0 9 7 1
2.3 不同分期肺癌患者血清IL-2、IFN-γ、TNF-α和NKG2D水平比较不同分期肺癌患者血清IL-2、IFN-γ、TNF-α、NKG2D水平比较差异均有显著统计学意义(P<0.01)。随着肺癌分期的增加,血清IL-2、IFN-γ、NKG2D水平呈下降趋势,且三组间两两比较差异均有显著统计学意义(P<0.01);随着肺癌分期的增加,血清TNF-α水平呈上升趋势,且三组间两两比较差异均有显著统计学意义(P<0.01),见表4。
表4 不同分期肺癌患者血清IL-2、IFN-γ、TNF-α和NKG2D水平比较(±s)
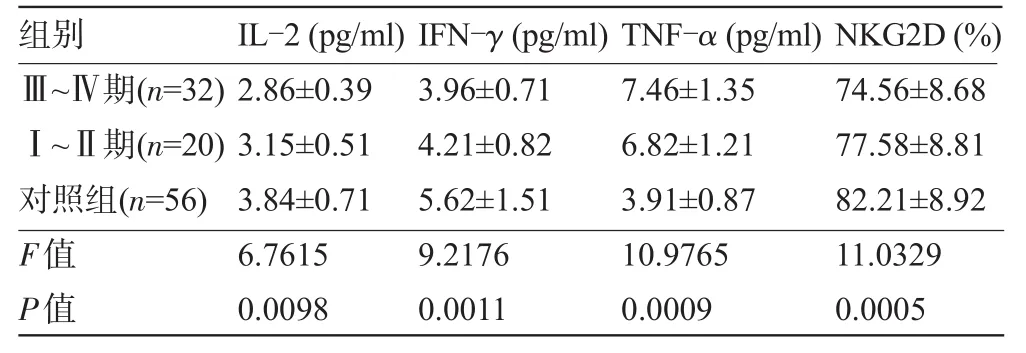
表4 不同分期肺癌患者血清IL-2、IFN-γ、TNF-α和NKG2D水平比较(±s)
组别Ⅲ~Ⅳ期( n = 3 2 )Ⅰ~Ⅱ期( n = 2 0 )对照组( n = 5 6 ) I L -2 ( p g / m l ) 2 . 8 6 ± 0 . 3 9 3 . 1 5 ± 0 . 5 1 3 . 8 4 ± 0 . 7 1 I F N -γ ( p g / m l ) 3 . 9 6 ± 0 . 7 1 4 . 2 1 ± 0 . 8 2 5 . 6 2 ± 1 . 5 1 T N F -α ( p g / m l ) 7 . 4 6 ± 1 . 3 5 6 . 8 2 ± 1 . 2 1 3 . 9 1 ± 0 . 8 7 N K G 2 D ( % ) 7 4 . 5 6 ± 8 . 6 8 7 7 . 5 8 ± 8 . 8 1 8 2 . 2 1 ± 8 . 9 2 F值P值6 . 7 6 1 5 0 . 0 0 9 8 9 . 2 1 7 6 0 . 0 0 1 1 1 0 . 9 7 6 5 0 . 0 0 0 9 1 1 . 0 3 2 9 0 . 0 0 0 5
2.4 各项检验指标与年龄、烟龄、病程、肺癌分期、病理类型和BMI的相关性对血清IL-2、IFN-γ、TNF-α、NKG2D等指标与年龄、烟龄、病程、肺癌分期、病理类型、BMI等因素进行相关性分析,结果显示,血清IL-2、IFN-γ、NKG2D与肺癌分期呈负相关(P<0.05),血清TNF-α与肺癌分期呈正相关(P<0.05);血清IL-2、IFN-γ、TNF-α、NKG2D等指标与年龄、烟龄、病程、病理类型、BMI等因素无明显相关性(P>0.05),见表5。
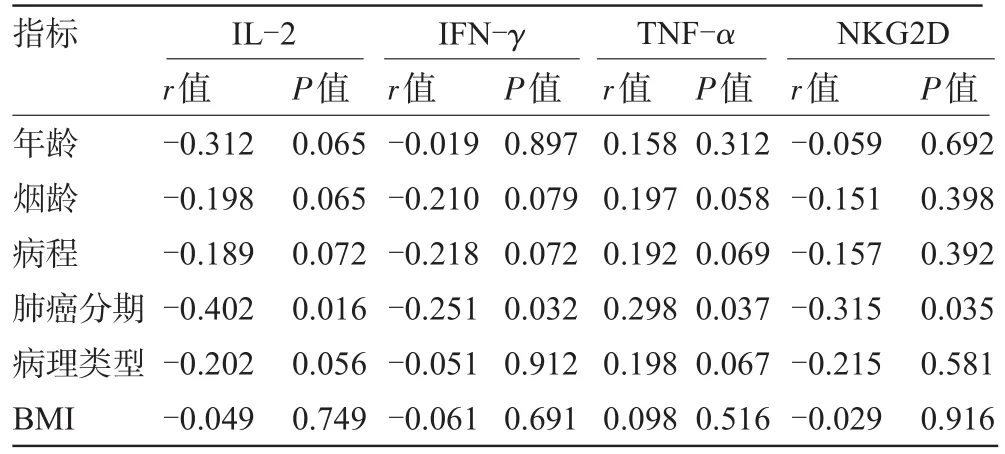
表5 各项检测指标与年龄、烟龄、病程、肺癌分期、病理类型和BMI的相关性
3 讨论
肺癌发病率呈现逐年上升趋势[7],其发病机制复杂,可由多种因素诱发。研究显示,免疫反应和炎症反应与恶性肿瘤的发病及进展密切相关,在恶性肿瘤的进展过程中起重要作用[8-11]。Th1细胞为Th细胞重要的亚群之一,在炎症反应及免疫过程中起重要调节作用;IL-2、IFN-γ、TNF-α主要由Th1细胞分泌,NKG2D由NK细胞分泌,为NK细胞活化性受体[12]。研究显示,IL-2、IFN-γ、TNF-α、NKG2D在免疫性疾病及恶性肿瘤发病及进展中均起作用[12-15]。本研究重点探讨IL-2、IFN-γ、TNF-α、NKG2D在肺癌发病、进展过程中可能起的作用。
IL-2是一种T细胞生长因子,具有免疫调节功能,主要由CD4+T细胞分泌,IL-2在免疫调节过程中可通过诱导B细胞、巨噬细胞的表达发挥调节作用。研究显示,恶性肿瘤进展时,机体Th淋巴细胞功能受损,IL-2表达受到抑制,免疫调节功能减弱,机体免疫水平下降[1]。因此,IL-2在恶性肿瘤进展过程中其水平可呈现下降趋势。本研究中,肺癌患者血清IL-2水平低于健康者,随着肺癌分期的增加,IL-2呈现下降趋势,但不同病理类型肺癌间IL-2的表达并无明显差异,表明血清IL-2的表达与肺癌的发生及进展相关,而与病理类型关系不显著。本研究中随着肺癌的进展,IL-2呈现下降趋势,可能与肺癌患者免疫活性受到抑制有关。IL-2抗肿瘤的可能机制有:(1)刺激、活化其效应细胞,抑制肿瘤细胞增殖;(2)提高淋巴细胞粘附分子水平,介导淋巴细胞和癌细胞的结合,诱导、杀伤靶细胞[1]。
TNF-α为炎症反应的始动因子,可放大和加重炎症反应。机体严重创伤时其血清水平可明显升高,在高表达同时亦可对机体免疫功能产生抑制作用,进而增加机体进一步损伤的风险。本研究显示,肺癌患者血清TNF-α水平明显高于健康人群,不同病理类型肺癌间TNF-α的表达差异无统计学意义,但随着肺癌分期的增加,TNF-α呈现升高趋势,表明血清TNF-α的表达与肺癌自身的发生及进展相关。本研究中随着肺癌的进展,TNF-α呈现上升趋势,可能与肺癌患者免疫活性受到抑制有关,机体巨噬细胞在肺癌微环境中被激活后可产生TNF-α,TNF-α表达增强可进一步促进巨噬细胞分泌IL-6,IL-6与肺癌细胞表面IL-6受体结合,进而作用于VEGF,促进肺癌微血管形成,这可能是肺癌发生及进展的可能机制之一[2]。
本研究中肺癌患者血清IFN-γ水平低于健康人群,不同病理分型肺癌间血清IFN-γ水平差异无统计学意义,但随着肺癌的进展,IFN-γ水平呈现下降趋势,表明IFN-γ亦参与了肺癌的发病及进展过程。本研究中随着肺癌的进展,IFN-γ水平呈现下降趋势,推测与肺癌患者免疫功能受到抑制有关。IFN-γ抗肿瘤的可能机制有:IFN-γ参与肿瘤免疫编辑,最初识别癌细胞的IFN-γ可促进免疫系统分泌IL-12等化学物质,这些物质可趋化更多的固有免疫细胞到达癌症病灶,进而抑制肿瘤血管生成及癌细胞增殖[5]。
恶性肿瘤中机体表达的NKG2D具有重要的免疫监视功能,NKG2D介导的免疫监视功能在抑制癌症发生过程中起重要作用[7]。本研究中肺癌患者血清NKG2D表达较健康者弱,不同病理类型肺癌间NKG2D的表达差异无统计学意义,但随着肺癌分期的增加,NKG2D的表达呈减弱趋势。表明血清NKG2D的表达与病理类型关系不显著,与肺癌自身的发生及病情进展密切相关。本研究中随着肺癌的进展,IL-2、IFN-γ、TNF-α、NKG2D呈现异常表达,可能与下述因素相关:(1)肺癌患者免疫调节功能紊乱;(2)在肺癌尤其是中晚期肺癌患者体内,肺癌组织多伴有炎性反应和免疫紊乱,导致炎症因子出现异常表达;(3)随着肺癌的进展,Thl细胞释放的IL-2、IFN-γ等细胞因子减少,对NK细胞的刺激作用变弱,NKG2D生成减少,肺癌患者体内NK细胞对肺癌细胞的反应性降低,抑制性受体占主导作用,进一步抑制了NK细胞的活性,上述因素可形成正反馈,引起机体免疫功能受损加重[7]。
对血清IL-2、IFN-γ、TNF-α、NKG2D等指标与年龄、烟龄、病程、肺癌分期、病理类型、BMI等因素进行相关性分析,结果显示,血清IL-2、IFN-γ、NKG2D与肺癌分期呈负相关(P<0.05),血清TNF-α与肺癌分期呈正相关(P<0.05)。由此可以看出:血清IL-2、IFN-γ、TNF-α、NKG2D与肺癌发病密切相关,随着肺癌的进展,血清IL-2、IFN-γ、TNF-α、NKG2D水平呈上升或下降趋势。表明IL-2、IFN-γ、TNF-α、NKG2D在肺癌发病及进展中起重要作用,因此建议对肺癌高危人群或肺癌患者宜定期检测血清IL-2、IFN-γ、TNF-α、NKG2D含量,以监测肺癌发病风险及进展。
有关IL-2、IFN-γ、TNF-α、NKG2D表达与肺癌发病及病情进展的研究较少,因此本研究具有一定的创新性。本研究不足之处是入组对象较少、规模较小,因此在一定程度上可能影响研究的结果及精确性。因此,仍然需要更大规模的临床研究进一步验证。IL-2、IFN-γ、NKG2D在肺癌患者血清中呈现低表达,而TNF-α在肺癌患者血清中呈现上升趋势,IL-2、IFN-γ、TNF-α、NKG2D与肺癌发病及进展密切相关。因此,联合检测IL-2、IFN-γ、TNF-α、NKG2D等指标对肺癌的诊断具有重要意义。
[1]Yokomise H,Liu D,Ishikawa S,et al.Chemotherapy followed by surgery on the basis of biomarker examination for patients with advanced non-small cell lung cancer[J].Anticancer Res,2013,33 (12)∶5597-5602.
[2]Gong L,Cumpian AM,Caetano MS,et al.Promoting effect of neutrophils on lung tumorigenesis is mediated by CXCR2 and neutrophil elastase[J].Mol Cancer,2013,12(1)∶154.
[3]刘晶,王朝霞.慢性炎症与肺癌发病关系的研究进展[J].中华结核和呼吸杂志,2013,36(8)∶603-605.
[4]Ostheimer C,Bache M,Güttler A,et al.A pilot study on potential plasma hypoxia markers in the radiotherapy of non-small cell lung cancer.Osteopontin,carbonic anhydrase IX and vascular endothelial growth factor[J].Strahlenther Onkol,2014,190(3)∶276-282.
[5]Nava-Villalba M,Aceves C.6-iodolactone,key mediator of antitumoral properties of iodine[J].Prostaglandins Other Lipid Mediat, 2014,112∶27-33.
[6]朱洪,巫翠萍,符火,等.肺癌化疗前后血清SIL-2R、IL-6、TNF-α浓度变化及临床价值[J/CD].中华临床医师杂志(电子版), 2014,9∶1597-1600.
[7]Nie Y,Du L,Mou Y,et al.Effect of low frequency magnetic fields on melanoma∶tumor inhibition and immune modulation[J].BMC Cancer,2013,13∶582.
[8]Komatsu H,Mizuguchi S,Izumi N,et al.Sialyl Lewis X as a predictor of skip N2 metastasis in clinical stage IA non-small cell lung cancer[J].World J Surg Oncol,2013,11∶309.
[9]张岱,任伟宏,高云,等.血清Pentraxin-3在肺癌诊断及疗效评估中的价值研究[J].中华检验医学杂志,2013,36(11)∶997-1001.
[10]王汉萍,张力,梁智勇,等.正确看待细胞病理学在肺癌诊断中的意义[J].中华病理学杂志,2013,42(11)∶726-728.
[11]贺帅,李华.不同类型肺癌患者血清肿瘤标志物的表达及其意义[J].海南医学,2012,23(18)∶76-77.
[12]Oxnard GR,Nguyen KS,Costa DB.cGermline mutations in driver oncogenes and inherited lung cancer risk independent of smoking history[J].J Natl Cancer Inst,2014,106(1)∶djt361.
[13]李艳平,王群,赵姿红,等.联合检测肿瘤标志物在肺癌诊断中的临床价值[J].中华核医学与分子影像杂志,2013,33(5)∶336-339.
[14]Guimaraes M,Schonholz C,Hannegan C,et al.Radiofrequency wire for the recanalization of central vein occlusions that have failed conventional endovascular techniques[J].J Vasc Interv Radiol,2012, 23(8)∶1016-1021.
[15]Masuda E,Sista AK,Pua BB,et al.Palliative procedures in lung cancer[J].Semin Intervent Radiol,2013,30(2)∶199-205.
Expression of serum IL-2,IFN-γ,TNF-α,NKG2D in patients with lung cancer and its clinical significance.
LI Gao,CAI Ren-zhong,CAI Yong-qing.Department of Thoracic Surgery,People's Hospital of Hainan Province,Haikou 570311,Hainan,CHINA
ObjectiveTo study expression of serum IL-2,IFN-γ,TNF-α,NKG2D in patients with lung cancer and its clinical significance.MethodsFrom January 2010 to December 2013,52 patients of lung cancer were selected as the research subjects(lung cancer group),including 22 patients of lung squamous carcinoma,18 patients of lung adenocarcinoma and 12 patients of small cell lung cancer.Among the patients,20 patients were of stageⅠ~Ⅱlung cancer,and 32 cases were of stageⅢ~Ⅳlung cancer.Fifty-six healthy volunteer were selected as control group. Serum levels of IL-2,IFN-γ,TNF-α,NKG2D were detected,and the correlation between serum IL-2,IFN-γ, TNF-α,NKG2D levels and age,smoking history,course of the disease,lung cancer staging,pathological type and body mass index(BMI)were analyzed.ResultsSerum IL-2,IFN-γ,NKG2D level in lung cancer group were significantly lower than those in the control group(P<0.01),but serum TNF-α level in lung cancer group significantlywas higher(P<0.01).There was no statistically significant difference in IL-2,IFN-γ,TNF-α,NKG2D levels between different types of lung cancer(P>0.05).However,statistically significant differences were found in the levels between different lung cancer stages(P<0.05),With the increase of lung cancer staging,serum IL-2,IFN-γ, NKG2D level were on decline and serum TNF-α level was on rise,with statistically significant difference betweenⅠ~Ⅱgroup,Ⅲ~Ⅳgroup and the control group(P<0.01).Serum IL-2,IFN-γ,NKG2D were negatively correlated with lung cancer staging(P<0.05),while serum TNF-α was positively associated with lung cancer staging(P<0.05). Serum IL-2,IFN-γ,TNF-α,NKG2D showed no significant correlation with age,smoking history,course of the disease,pathology type,and BMI(P>0.05).ConclusionIL-2,IFN-γ,NKG2D show decreased expression in serum of patients with lung cancer,while TNF-α shows increased expression.IL-2,IFN-γ,TNF-α,NKG2D are closely associated with the development and progress of lung cancer.Combined detection of IL-2,IFN-γ,TNF-α,NKG2D is of great significance to the diagnosis of lung cancer.
Lung cancer;IL-2;IFN-γ;TNF-α;NKG2D;Correlation
R734.2
A
1003—6350(2015)12—1728—04
2014-11-13)
李高。E-mail:drligao@163.com
doi∶10.3969/j.issn.1003-6350.2015.12.0620

