术前新辅助化疗结合肠内营养对胃癌患者肿瘤细胞增殖活性的影响*
黄晋熙,杨铁军,王程虎,周一,陈小兵,原伟伟
[郑州大学附属肿瘤医院(河南省肿瘤医院)1.普外科;2.泌尿外科;3.麻醉科;4.肿瘤内科,河南 郑州450003]
胃癌是常见的消化道恶性肿瘤,大多数患者在就诊时就已诊断为进展期。作为胃癌综合治疗的一种方法,新辅助化疗(neoadjuvant chemotheraphy,NAD)已得到越来越多的关注。进展期胃癌患者在就诊时一般合并有低蛋白血症等营养不良状况,给予营养支持已成为共识。但在NAD时给予个体化的肠内营养(enteral nutrition,EA)后,胃癌患者肿瘤细胞的增殖活性是否变化,是本研究探讨的目的。
1 资料与方法
1.1 一般资料
选择2011年10月-2012年10月之间在普外科治疗的进展期胃癌患者,按NRS2002评价系统评分,总分≥3分的共66人,根据随机数字表随机分成3组:①对照组(n=22),为确诊后直接手术;②单纯NAD组(n=20),为NAD后直接手术;③NAD+EA组(n=24),为在行术前NAD的同时加用EA支持。所有入组患者术前均有内镜活检病理,并将活检标本及术后标本存液氮备用。三组患者的性别、年龄、病理类型以及TNM分期等基本资料见表1。
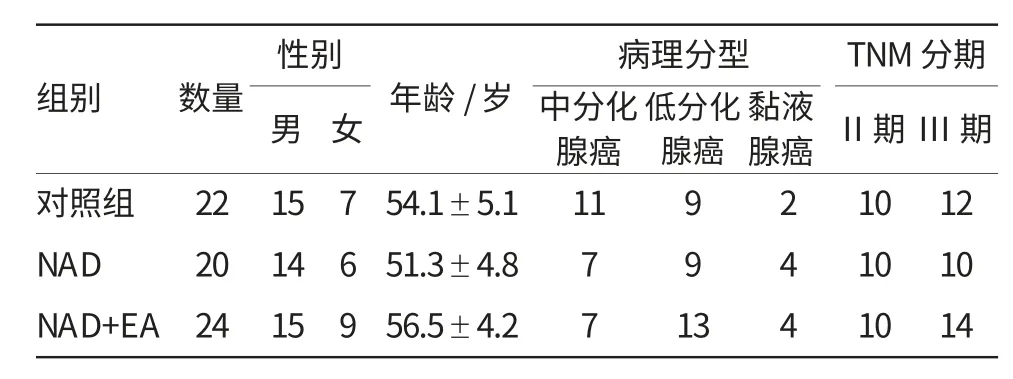
表1 66例胃癌患者的一般临床特征
1.2 化疗方法
采用多西他赛联合奥沙利铂及卡培他滨方案:第1天静脉滴注奥沙利铂130mg/m2;1~14 d,每天分2次口服卡培他滨1 000mg/m2。每3周1个疗程,进行2个疗程后行手术治疗。
1.3 肠内营养
NAD+EA组的肠内营养采用高脂肪、低糖类、含ω-3脂肪酸的营养制剂。保证热量供给为62.76~83.68 kJ/(kg·d)。对照组及单纯化疗组自然进食。
1.4 实验方法
手术切除的肿瘤标本迅速进行液氮冷冻并保存在液氮罐中。具体步骤为:将液氮冻存的组织捣碎后加入放有酶溶液的EP管进行消化,溶液作用20~30min并不断震荡EP管,使酶与组织充分接触。然后收集细胞并制备单细胞悬液进行荧光染色后,立即用Beckman Coulter Epics XL流式细胞仪(美国COULTER公司)检测。检测参数采用DNA非整倍体肿瘤DI值,S期SPF值,S+G2+M期PI值。
1.5 统计学方法
采用STATA 11.0统计软件进行分析,年龄、DI、SPF等采用均数±标准差(±s)表示,组内比较应用重复测量资料t检验,组间比较应用两样本均数的t检验;病理类型、TNM分期等计数资料采用χ2检验。双侧P<0.05为差异有统计学意义。
2 结果
2.1 治疗前后组内比较
NAD组治疗后SPF值及PI值较治疗前均显著降低,差异有统计学意义(P<0.05),DI指数治疗前后无明显差异(P>0.05);EA+NAD组治疗后SPF,PI及DI值均较治疗前下降,差异有统计学意义(P<0.05)。
表2 各组患者细胞DNA倍体分析 (±s)
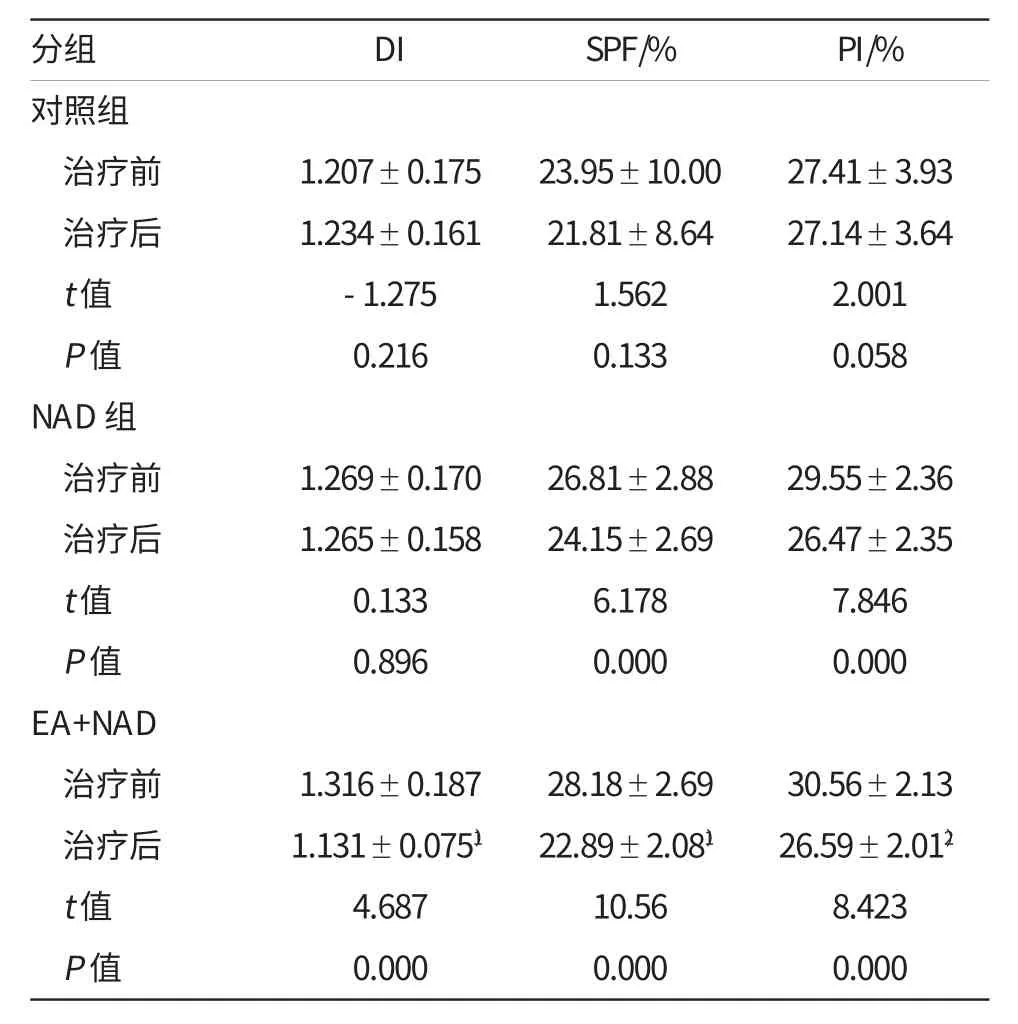
表2 各组患者细胞DNA倍体分析 (±s)
注:1)肠内营养结合新辅助化疗组治疗后DI值、SPF值与对照组或单纯化疗组比较,P<0.05;2)肠内营养结合新辅助化疗组治疗后PI值与单纯化疗组比较,P>0.05
分组对照组DI SPF/% PI/%1.207±0.175 1.234±0.161 t值P值治疗前治疗后23.95±10.00 21.81±8.64-1.275 0.216 27.41±3.93 27.14±3.64 1.562 0.133 2.001 0.058 NAD组治疗前治疗后t值1.269±0.170 1.265±0.158 0.133 26.81±2.88 29.55±2.36 24.15±2.69 6.178 26.47±2.35 7.846 P值EA+NAD 0.896 0.000 0.000 1.316±0.187 1.131±0.0751)t值P值治疗前治疗后28.18±2.69 22.89±2.081)4.687 0.000 30.56±2.13 26.59±2.012)10.56 0.000 8.423 0.000
2.2 治疗后组间比较
EA+NAD组治疗后SPF,DI值与NAD组和对照组比较显著降低,差异有统计学意义(P<0.05),PI值与NAD组和对照组比较无明显差别(P>0.05)。详见表2。

附图 DNA倍体直方图
3 讨论
一般情况下,在细胞分裂的不同时期,细胞核内染色质拷贝数呈现不同的周期性的变化。当DNA含量发生微小的异常变化时,就有可能导致恶性肿瘤。DNA指数(DNA index,DI)是肿瘤样本G0/G1期细胞荧光值的强度与正常人二倍体G0/G1期的荧光强度的比值(见附图)。DI为1意味着二倍体,四倍体细胞的DI为2,亚二倍体细胞的DI<1,而超二倍体细胞的DI>1。在二倍体和四倍体之外的统称为异倍体。既往已有文献报道[1],患者体内肿瘤细胞DNA拷贝数与患者治疗反应率和预期生存期等预后指标存在显著相关性。另外,S期细胞和肿瘤的体积、病理分化程度以及转移情况存在相关性,S期细胞所占比例比反映了细胞的增殖状态[2]。
进展期胃癌患者常存在营养不良,若不予纠正,将影响手术的耐受能力及肿瘤综合治疗的整体效果和预后[3],而此时给予患者EA更符合生理,更容易被患者所接受[4]。但单纯给予营养支持可能刺激胃癌细胞的增殖[5]。从而增加胃癌患者术后复发或转移的风险。
NAD作为进展期胃癌综合治疗的一部分,在延长患者生存期,提高患者生活质量方面有重要的意义。但化疗药物会使部分患者出现不同程度的消化道不良反应,甚至进一步影响患者营养状态,从而增加手术风险和提高手术后并发症的发生率[6-7]。
NAD联合EA支持将弥补两者的缺点,且营养支持可以干扰肿瘤细胞的增殖周期,使大量G0期细胞进入增殖期,从而提高化疗药物对增殖期肿瘤细胞的杀伤效果[8]。
本研究结果提示:单纯使用“奥沙利铂联合希罗达”为方案行术前NAD后,SPF和PI值明显下降,表明化疗有效,但DI值无明显变化,提示休眠期肿瘤细胞未减少,术后可能存在复发风险。而NAD结合EA支持组,DI、SPF及PI值进一步下降,表明加用EA后,肿瘤的增殖活性下降,从而使更多的肿瘤细胞被化疗药物杀死,提高了化疗有效率。
[1]DANESII DT,SPANO M,FABIANO A,et a1.Flow cytometric DNA ploidy,p53,PCNA,and C-erbB-2 protein expressions as predictors of survival in surgically reseeted gastric cancer patients[J].Cytometry,2000,42(1):27-34.
[2]张景芳,张原平,郝风云,等.胃癌DNA倍体分析及其TIMP-2和E-cadherin在胃癌中的表达[J].中国病理生理杂志,2006,22(7):1353-1358.
[3]ARENDS J,BODOKY G,BOZZETTI F,et al.ESPEN guidelines on enteral nutrition:non-surgical oncology[J].Clin Nutr,2007,26(1):161-162.
[4]黎介寿.肿瘤营养学的兴起及临床应用[J].肠外与肠内营养,2004,11(1):1-2.
[5]RIVADENEIRA DE,EVOY D,FAHEY T J,et al.Nutrional support of the cancer patient[J].CA Cancer J Clin,1998,48(2):69-80.
[6]范朝刚,李国力,王绪林,等.辅助性营养支持对胃癌致消化道梗阻病人新辅助化疗的作用[J].肠内与肠外营养,2008,15(4):232-223.
[7]DEWYS WD,BEGG C,LAVIN PT,et al.Prognostic effect of weight loss prior to chemotherapy in cancer patients[J].Am J Med,1980,69(3):491-497.
[8]李乐平,靖昌庆,刘洪俊,等.新辅助化疗联合肠外营养对胃癌细胞增殖活性的影响[J].中国临床营养杂志,2006,14(2):100-103.

