膜芯片快速诊断HBV基因型和耐药性方法的建立*
唐曙明,李爱敏,陈海霞,杨自华
(深圳市人民医院,广东 深圳518020)
根据乙肝病毒(hepatitis B virus,HBV)全基因核甘酸序列异源性≥8%,或S基因区核甘酸序列异源性≥4.2%的标准,HBV可分为A~H 8个基因型[1]。不同HBV基因型具有不同的地理区域性分布特征,在我国流行的HBV基因型主要有B、C、D三种,北方地区以C型为主,约占81.6%,南方地区则以B、C型为主[2]。不同HBV基因型在致病性和病毒学特性上存在明显差异,C、D基因型较B基因型具有更强的致病能力,更容易导致活动性肝病和肝细胞癌[3]。随着拉米夫定(LAM)、阿德福韦酯(ADV)、恩替卡韦(ETV)、替比夫定(LdT)等核苷类抗HBV药物在临床的广泛应用,HBV耐药的问题日益突出,严重地影响了疾病的转归。因此,建立简便、快速、敏感、高通量的HBV基因分型和耐药性检测方法对HBV感染的诊断、治疗、预后判断和流行病学分析具有重要的意义。
1 材料与方法
1.1 材料
1.1.1 标本来源 HBV B、C、D基因型标准株;腺病毒ATCC VR-1079AS/RB(Adenovirus,ADV)、人乳头瘤病毒ATCC VR-2237(human papillomavirus,HPV)和单纯疱疹病毒ATCC VR-1544(herpes simplex virus,HSV)标准株由亚能生物科技有限公司提供,11种标准菌株(包括大肠埃希菌、肺炎链球菌、绿脓假单胞菌、肺炎克雷伯菌、表皮葡萄球菌、草绿色链球菌、金黄色葡萄球菌、变形杆菌、痢疾杆菌、枯草芽孢杆菌、表皮葡萄球菌)从中国生物制品检定所购入,187例HBV DNA阳性患者(103~109copies/ml)血清样本来自本院2012年3月-2012年7月门诊和住院患者。
1.1.2 仪器与试剂 ABI 9700 PCR扩增仪购于美国ABI公司,电泳仪购于北京六一仪器厂,图像分析系统为BIO-RAD公司GEL DOC 2000,分子杂交箱购自韩国FINE PCR公司,HBV核酸定量检测及提取试剂盒购于上海科华公司。
1.2 方法
1.2.1 DNA提取 吸取100μl样本处理液A于0.5ml离心管中,再加入100μl待检血清,振荡混匀,13 000 r/min离心10min,弃上清。加入25μl DNA提取液,震荡数秒充分溶解沉淀,2 000 r/min离心30 s。100℃干浴10min,13000 r/min离心10min备用。11种标准菌株经传代培养后,提取DNA备用。
1.2.2 引物与探针设计 用DNAMAN软件对GeneBank中HBV的序列数据进行多重比对,于HBV基因保守区设计11条特异性探针分别检测HBV-B、C、D和常见耐药突变(rtL180M、rtA181V、rtM204V/I、rtV207I、rtN236T)。另设1条通用探针作为内控点(内对照),以监测整个实验过程的有效性,探针序列见表1。
选择2对保守区片段为扩增引物,其中分型引物为:Prime5':TCGTGTACAGGCGG,Prime3':ACCAC TGAACAAAT,扩增片段长510 bp;耐药引物为:Prime5':GAGTCTAGACTCGTGGTG,Prime3':ATTGA TTGGAAAGT,扩增片段长742 bp。引物的5'用生物素进行标记,引物和探针由上海生工公司合成。
1.2.3 PCR扩增 在25μl反应体系中,dNTP混合物的终浓度为0.2 mmol/L,引物的终浓度均为0.4μmol/L,DNA模板20 ng,Taq DNA聚合酶2.5U。置于PCR仪上按下列条件扩增:50℃3min,93℃预变性6 min,然后按93℃30 s→58℃40 s→72℃45 s扩增,10个循环;93℃30 s→56℃40 s→72℃45 s扩增,10个循环;93℃30 s→55℃40 s→72℃45 s扩增,25个循环,最后72℃延伸7min。取5μl PCR产物进行1%琼脂糖凝胶电泳。
1.2.4 膜芯片制备 尼龙膜浸入5% EDAC 20 min,纯水洗膜,晾干。探针稀释液(5μm/L)点样于膜条上,晾干后,浸于0.1mol/L NaOH作用3min,纯水洗膜,晾干,室温储藏备用。
1.2.5 杂交与显色 将制备好的膜条编号后放入15ml杂交管中,加入扩增产物和6ml杂交缓冲液(2×SSC、0.1%SDS)置于沸水浴10min,放入已预热的杂交箱中,57℃杂交1.5 h。取出膜条,移至装有洗液(0.5×SSC、0.1%SDS)并已预热至57℃的50ml管中,于57℃轻摇洗涤15min。取出膜条,按杂交缓冲液:POD=2 000∶1配制孵育液,室温轻摇孵育30 min,弃去孵育液。用杂交缓冲液室温轻摇洗2次,每次5min。用柠檬酸缓冲液(0.1mol/L)室温洗膜2 min,同时配制显色液(19m l0.1mol/L柠檬酸钠、1 ml 2mg/ml TMB、10μl 3%过氧化氢H2O2),将膜条浸泡于显色液中避光显色10~15min观察结果。
1.2.6 结果判读 膜条在内控点(CC)位置应出现蓝色斑点,提示本次杂交、显色正常工作;其他出现的蓝色斑点表示为相应的HBV基因型和耐药突变类型。

表1 HBV基因分型与耐药突变探针列表
1.2.7 最低检出限确定 从187例临床HBV阳性分离株中随机抽取38例样本和HBV-B、C、D基因型标准株同步用上海科华HBV核酸定量试剂盒定量,然后进行系列稀释,分别制成104、103和102copies/ml浓度稀释液,按1.2.1~1.2.5步骤检测,以确定新建方法的最低检出限。
1.2.8 测序分析 对1.2.7所述38例临床样本和HBV-B、C、D基因型标准株送上海英骏生物技术有限公司进行测序分析,以检验PCR扩增的特异性和膜杂交结果的准确性。
1.2.9 临床样本检测 用新建方法对187例临床样本进行检测,分析深圳地区HBV基因型与耐药突变分布情况。
2 结果
2.1 PCR产物电泳结果
如图1所示,对HBV标准株和187例临床样本PCR 扩增产物进行电泳,在500 bp和750 bp处可见明显阳性条带,与预期片段大小一致。
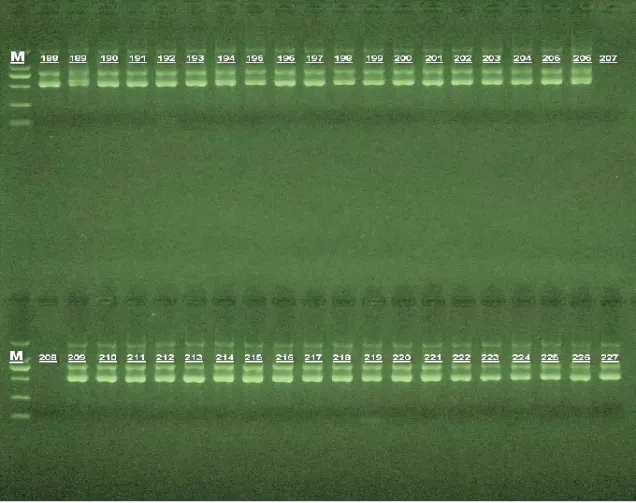
图1 部分PCR产物电泳图
2.2 膜芯片杂交结果
膜条上的探针共两行,探针位置如表2所示,其中CC为内对照,其余位置分别对应相应探针。由图2可见,所有杂交膜条在CC位置均出现蓝色斑点,其余杂交斑点显色清晰,提示本次杂交显色正常。
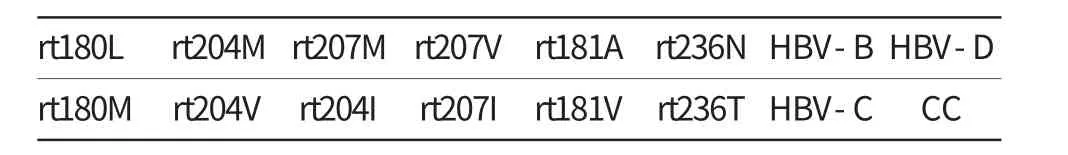
表2 膜条探针位置示意表

图2 部分HBV临床样本与标准株反向斑点杂交结果图
2.3 DNA测序结果
对38例临床样本和HBV-B、C、D基因型标准株进行测序分析,其结果与膜芯片结果完全一致(图3)。
2.4 特异性与最低检出限确定
将ADV、HPV、HSV标准株和11种标准菌株用新建方法检测,结果在膜芯片上未出现阳性反应斑点。HBV-B、C、D标准株和38例临床株分别制成104、103和102copies/ml浓度进行检测,发现各株浓度在103copies/ml时检测结果仍为阳性,当菌液稀释至102copies/ml时,有8例阳性显色已经明显变弱,10例临床株未见阳性显色。
2.5 临床样本检测结果
在187例HBV阳性临床样本中检出B型108例,占57.8%;C型70例,占37.4%;B+C混合型8例,占4.3%;另有1例不能分型,未测出D型。在187例临床样本中共检出耐药突变49例,占26.2%。在49例耐药突变中,20例为rtL180M+rtM204V,占40.8%;13例为rtL180M+rtM204I,占26.5%;8例为rtM204I,占16.3%;4例为rtA181V,占8.2%;2例为rtN236T,占4.1%,1例 为rtA181V+rtN236T,占2.0%;1例为rtV207I,占2.0%。在49例耐药突变中,有32例为HBV-C,占65.3%;17例为HBV-B,占34.7%。
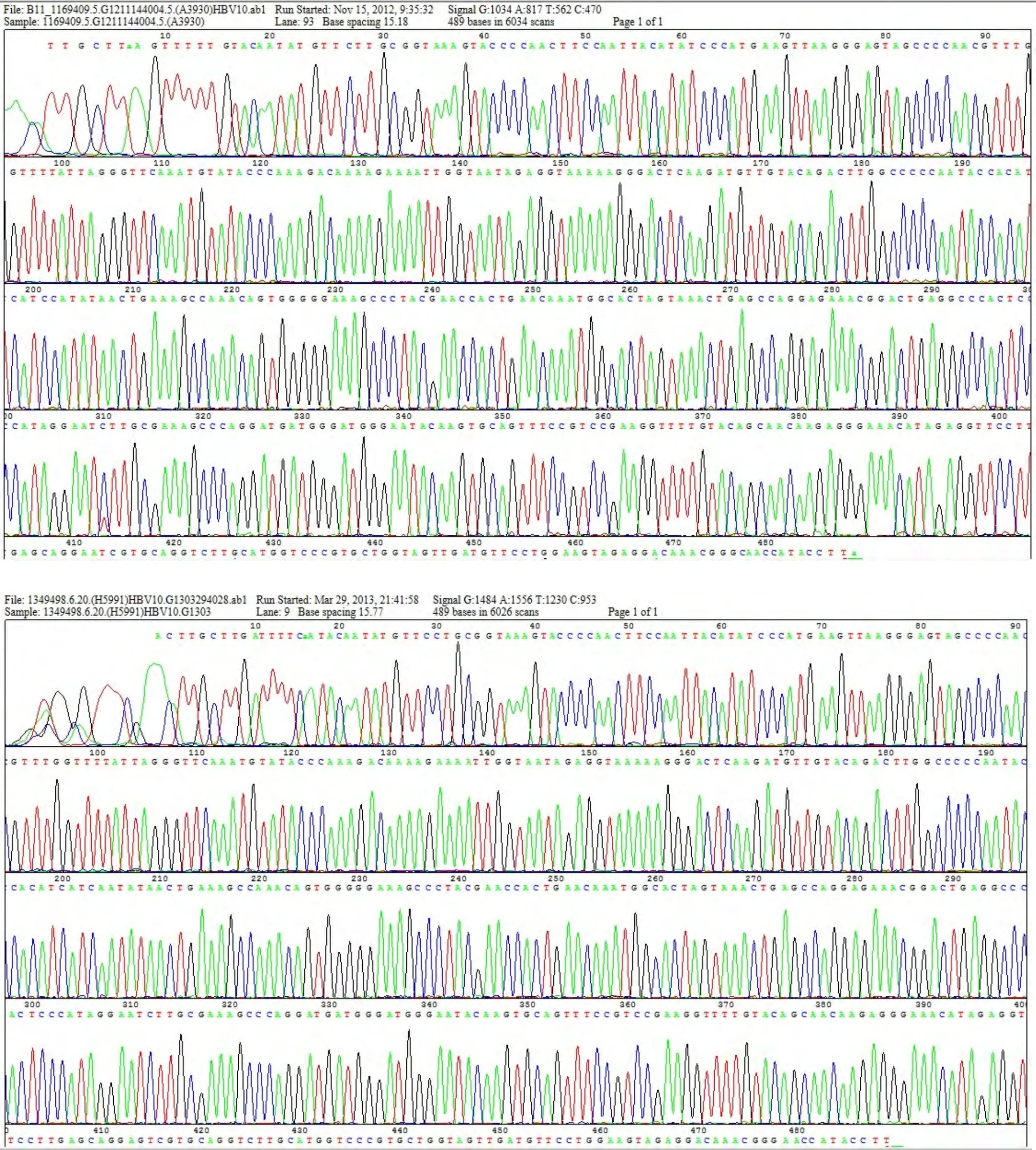
图3 部分HBV临床样本与标准株扩增产物测序结果图
3 讨论
HBV为一不完全环状双链DNA分子,基因组长约3 200 bp,含前-S/S区、前-C/C区、P区和X区共4个主要的开放读码框(ORF)。HBV复制的显著特征是存在一个有逆转录酶参与的、以mRNA为中间体的DNA-RNA-DNA过程。由于HBV逆转录酶缺乏严格的校正机制,故在HBV复制过程中核苷酸错配率高,基因突变频繁发生[4]。研究显示,S区基因序列既含相对稳定的序列保守区,又含相对多态的序列变异区,适用于HBV基因分型[5],而所有核苷(酸)类似物耐药突变位点都位于HBV DNA聚合酶基因区(逆转录酶区),故耐药性检测探针多依据此区序列设计。本研究根据HBV S区基因多重比对结果,于保守区设计1条通用探针作为内对照,另设3条特异性探针分别检测HBV基因型B~D。根据HBV逆转录酶区基因多重比对结果,设计了rt180L、rt180M、rt204M、rt204V、rt204I、rt181A、rt181V、rt207M、rt207V、rt207I、rt236N和rt236T 5个位点共12条探针,基本上涵盖了4种抗HBV核苷(酸)类似物的常见耐药突变。实验中,通过多重PCR扩增,电泳出现预期条带,表明扩增成功。将HBV-B、C、D标准株和38例HBV临床样本的PCR产物与膜条杂交,结果在内控制(CC)位置均有明显杂交信号,表明杂交成功,扩增片段为目的基因片段。在膜芯片相应探针位置出现的阳性显色背景清晰,无交叉反应和其他非特异性反应。将ADV、HPV、HSV和11种标准菌株基因组DNA扩增后杂交,结果均为阴性,其特异性达到了100%。为进一步验证膜芯片对HBV分型和耐药检测的准确性,本研究将HBV-B、C、D标准株和38例临床样本的PCR产物进行测序,并将杂交结果与测序结果进行比较,结果显示,膜芯片结果与测序结果完全一致,准确性达到100%。为确定方法的检测灵敏度,本研究将HBV-B、C、D标准株和38例临床样本用实时定量PCR进行载量确认后,分别制成104、103和102copies/ml浓度进行检测,发现最低检出限达103copies/ml,表明该方法具有较高的检测灵敏度,从而肯定了其在分型和耐药性检测中的应用价值。
目前国际上已统一了HBV耐药位点的定位命名,即从逆转录酶区的上游第一个氨基酸起,分别为rtl~rt344[6]。研究表明,拉米夫定(LAM)最常见的耐药突变为rtM 204I/V±rtL180M,其中rtM204V多与rtL180M联合出现,rtM204I可单独出现,其1~5年累积耐药发生率分别为24%、38%、49%、67%与70%[7]。阿德福韦酯(ADV) 常见的耐药突变为rtN236T与rtA181V/T变异,两个位点变异可单独或联合出现,其1~5年累积耐药发生率分别为0%、3%、11%、18%与29%[8]。恩替卡韦(ETV)常见的耐药突变是在rtM204V+rtL180M变异基础上,再联合aT184、rtS202或aM250三个位点中至少一个位点突变,其1~5年累积耐药发生率分别为0.2%、0.5%、1.2%、1.2%与1.2%[9]。替比夫定(LdT)常见的耐药突变为rtM204I,其1~2年累积耐药发生率分别为4%与22%[10]。
在对187例HBV阳性临床样本检测结果中,检出B型108例,占57.8%;C型70例,占37.4%;B+C混合型8例,占4.3%;未测出D型;另有1例不能分型,分析可能为HBV-B、C、D之外的其他基因型。187例HBV阳性临床样本共检出耐药突变49例,占26.2%。在49例耐药突变中,20例为rtL180M+rtM204V,占40.8%;13例为rtL180M+rtM204I,占26.5%;8例为rtM204I,占16.3%;4例为rtA181V,占8.2%;2例为rtN236T,占4.1%,1例为rtA181V+rtN236T,占2.0%;1例为rtV207I,占2.0%。在49例耐药突变中,有32例为HBV-C,占65.3%;17例为HBV-B,占34.7%。上述结果与以往的研究基本相符[11-12]。
目前常用于HBV基因型与耐药突变的分子检测方法一般都基于PCR、核酸分子杂交、限制性片段长度多态性(RFLP)分析和DNA测序等原理,在已报道的方法中,或因操作步骤复杂、检测位点单一而不适应现代大规模检测与流行病学调查的要求,或因价格昂贵而难以在临床推广应用。本研究以多重PCR和反向线性杂交为基础,建立了膜芯片方法来同步检测HBV的基因型和耐药性。实验结果证实,本方法简便、快捷,具有较强的特异性和较高的敏感性,可大大降低临床HBV基因分型和耐药性检测的成本、缩短检测周期,为研究HBV的流行病学规律、快速制订最佳治疗方案、降低耐药毒株在人群中的播散从而最终控制HBV提供了新的技术平台,适合在临床推广使用。
[1]OKAMOTO H,TSUDA F,TANARA T,et al.Typing Hepatitis B Virus by homology in nucleotide sequence:comparison of surface subtype[J].J Gen Virol,1988,69(10):2575-2583.
[2]ZENG G,WANG Z,WEN S,et al.Geographic distribution,virologic and clinical characteristics of hepatitis Bvirus genotypes in China[J].J Viral Hepat,2005,12(6):609-617.
[3]LIN CL,CHEN JD,LIU CJ,et al.Clinic pathological differences between hepatitis Bviral genotype B-and C-related resectable hepatocellular carcinoma[J].J Viral Hepat,2007,l4(1):64-69.
[4]DIENSTAG JL.Hepatitis Bvirus infection[J].N Engl J Med,2008,359(14):1486-1500.
[5]NORDER H,HAMMAS B,LOFDAL S,et al.Comparison of the amino acid sequence of nine different serotypes of hepatitis B surface antigen and genomic classification of the corresponding hepatitis Bvirus strains[J].J GenVirol,1992,73(5):1201-1208.
[6]乙型肝炎病毒耐药专家委员会.乙型肝炎病毒耐药专家共识[J].中华实验和临床感染病杂志(电子版),2009,3(1):43-47.
[7]LIAW YF,LEUUG N,KAO JH,et al.Asian-Pacific consensus statement on the management of chronic hepatitis B:a 2008 update[J].Hepatol Int,2008,2(3):263-283.
[8]LOK AS,MEMAHON BJ.Chronic hepatitis B[J].Hepatology,2007,45(2):507-539.
[9]European Association for the Study of the Liver.EASL Clinical Practice Guidelines:Management of Chronic Hepatitis B[J].J Hepatol,2009,50(2):227-242.
[10]PAWLOTSKY JM,DUSHEIKO G,HATZAKIS A,et al.Virological monitoring of hepatitis Bvirus therapy in clinical trials and practice:recommendations for a standardized approach[J].Gastroenterology,2008,134(2):405-415.
[11]张书楠,余文辉,周大桥,等.慢性乙型肝炎患者乙型肝炎病毒耐药基因型研究[J].国际检验医学杂志,2011,32(16):1797-1799.
[12]刘妍,王春梅,纪冬,等.1 121例慢性乙型肝炎患者HBV反转录酶区的耐药突变分析[J].解放军医学杂志,2009,34(6):659-662.

