短期颈动脉压力感受器电刺激减轻犬心肌缺血再灌注损伤的机制研究
阳 康,廖 凯,萨仁高娃,黄 兵,陈彩云,鲁志兵,何文博,王松云,江 洪
(武汉大学人民医院心内科,湖北 武汉 430060)
短期颈动脉压力感受器电刺激减轻犬心肌缺血再灌注损伤的机制研究
阳 康,廖 凯,萨仁高娃,黄 兵,陈彩云,鲁志兵,何文博,王松云,江 洪
(武汉大学人民医院心内科,湖北 武汉 430060)
目的 验证短期颈动脉压力感受器电刺激(Carotid baroreceptors stimulation,CBS)是否通过激活迷走神经的胆碱能抗炎通路减轻犬心肌缺血再灌注损伤。方法36只成年杂种犬随机分为三组(n=12):缺血再灌注组(I/R组)、颈动脉压力感受器刺激组(CBS组)和迷走神经干切除术(Vagotomy)组(VAG组)。各个组别的实验犬分别结扎左冠脉前降支1 h和再灌注6 h完成心肌缺血再灌注损伤模型。CBS组在心肌缺血前2 h对右侧颈动脉窦开始进行高频电刺激,直到实验结束,刺激参数:频率50 Hz,脉宽0.5 ms,刺激强度随血压进行调整,以保持血压较刺激前下降10%。VAG组在颈动脉窦刺激前实施双侧颈迷走神经干切除术。于缺血前、缺血15 min、30 min、60 min和再灌注0.5 h、2 h、6 h时记录心率(HR)和平均动脉压(MAP)。各组随机抽取6只犬于再灌注6 h后分别经颈内静脉采血,采用ELISA法检测血清TNF-α、IL-1β、IL-6浓度。采血后,迅速取出缺血区心肌组织,检测髓过氧化物酶(MPO)活性观察中性粒细胞浸润情况。各组剩余6只犬于再灌注6 h后采用依文斯兰—氯化三苯基氮唑(TTC)双染色法检测心肌缺血和心肌梗死面积。结果与I/R组比较,CBS组心肌梗死面积,MPO活性,血清TNF-α、IL-1β、IL-6含量降低(P<0.05);与I/R组比较,VAG组心肌梗死面积,MPO活性,血清TNF-α、IL-1β、IL-6含量差异无统计学意义(P>0.05)。结论短期颈动脉压力感受器电刺激可减轻犬心肌缺血再灌注损伤,抑制中心粒细胞向缺血组织浸润以及抑制全身炎症反应,其机制与短期颈动脉压力感受器电刺激激活迷走神经的胆碱能抗炎通路有关。
颈动脉压力感受器电刺激;心肌缺血再灌注损伤;炎症反应;胆碱能抗炎通路;迷走神经
在全世界范围内每年有500 000人死于心肌梗死[1]。经皮冠状动脉介入治疗和溶栓治疗可及时再通闭塞血管,减少心肌梗死的范围,是目前治疗急性心梗最有效的方法。但是再灌注治疗本身也可以导致心肌损伤,即心肌缺血再灌注损伤。高达50%的最终心肌梗死面积归因于心肌I/R损伤[2]。研究表明,再灌注后炎症反应是心肌I/R损伤重要致病因素之一,抑制炎症反应可以明显减轻心肌I/R损伤[3-4]。近年来,利用CBS治疗心血管疾病是研究的热点领域。长期CBS不仅安全有效,还可以治疗顽固性高血压和心力衰竭[5-9]。CBS可以抑制交感神经活性,提高迷走神经活性[10]。现已证明,激活迷走神经后能够通过胆碱能抗炎通路(Cholinergic anti-inflammatory pathway,CAP)而实现对炎症反应的调控[11]。笔者之前的研究发现短期CBS可抑制中心粒细胞向缺血组织浸润以及抑制全身的炎症反应,从而减轻犬心肌缺血再灌注损伤[12]。因此,笔者推测CBS减轻犬心肌缺血再灌注损伤,其机制与激活迷走神经的胆碱能抗炎通路有关。
1 材料与方法
1.1 实验分组及处理 健康成年杂种犬36只,体重14~22 kg,均为雄性,由武汉大学人民医院动物中心提供。戊巴比妥钠30 mg/kg前肢静脉麻醉,以后每小时追加2 mg/kg维持麻醉状态。气管插管接动物呼吸机,分离一侧股、动静脉置入6F鞘管,动脉通道连接压力换能器监测血压,静脉通道用于滴注生理盐水补液。颈部脱毛备皮消毒后,在左侧锁骨上水平暴露左侧颈内静脉备采血标本。空调室温控制在25℃~30℃,整个实验过程中,犬下方放置电热板以维持犬正常体温。持续记录体表心电图(LEAD2000)。将实验动物36只犬随机分为三组,每组12只:(1)I/R组:首先,暴露双侧颈部皮肤,沿下颚骨正下方气管旁切开皮肤,钝性分离出两侧颈迷走神经干。右颈动脉窦位于右颈总动脉和颈内动脉分叉处的膨大组织。然后,暴露右颈动脉窦,用一小片封口膜隔离周围组织。将一个特制的银-氯化银刺激电极围绕颈动脉窦植入,并连接到脉冲发生器(SEN-7103,日本光电,日本东京)。在3~5 min内预先刺激3~4次确认血压和心率明显下降,然后再妥善安置电极。颈动脉窦的刺激参数为:频率50 Hz,脉宽0.5 ms,刺激强度为引起血压下降10%的电压强度(3~7 V)[13]。最后,经左侧第4肋间开胸,剪开心包,暴露心脏。于冠状动脉左前降支第对角支、第二对角支之间穿针引线(2-0号无创丝线),连同一小段硬质圆钝头的塑料管一起结扎,造成缺血,及时记录心电图的改变。结扎成功的标准:心肌缺血区局部发绀,同步Ⅱ导联ECG显示ST段明显抬高,缺血期间出现室性心律失常。结扎1 h后,在硬质塑料管上切断结扎线,恢复冠脉血流再灌注6 h。再灌注成功的标准:缺血区局部颜色变红,同步Ⅱ导联ECG显示ST段逐渐恢复到缺血前水平,并出现再灌注室性心律失常。(2)CBS组:结扎冠脉前先开启刺激仪,预刺激颈动脉窦2 h,直至再灌注6 h。(3)VAG组:开启刺激仪前先切断双侧颈迷走神经干,然后刺激颈动脉窦2 h,直至再灌注6 h。实验流程见图1。

图1 实验流程示意图
1.2 血流动力学监测 在实验全程中,采用LEDE2000多导电生理仪连续监测犬的HR、动脉收缩压,舒张压、MAP和II导联心电图。记录心肌缺血前的HR和MAP,将该数值作为基础值。然后记录缺血15 min、30 min、60 min和再灌注0.5 h、2 h、6 h的HR和MAP。
1.3 血清炎症因子和心肌MPO活性检测 各组随机抽取6只犬,于再灌注6 h后经颈内静脉采血,采用ELISA法检测血清TNF-α、IL-1β、IL-6的浓度。具体操作步骤完全按照试剂盒说明书进行。采血结束后处死动物,迅速取缺血区心肌组织,并用生理盐水冲洗干净。采用分光光度法测定髓过氧化物酶(MPO)活性,试剂盒均由武汉博士德生物工程有限公司提供。
1.4 心肌梗死面积的测定 各组剩下的6只犬,于再灌注6 h后处死动物,立即取下心脏,用生理盐水冲洗干净。采用依文斯兰-TTC双染色法测定心肌梗死面积。正常非缺血区染为蓝色,梗死区(AN)呈灰白色,缺血非梗死区呈砖红色,缺血心肌面积(AAR)为灰白色和砖红色之和。对获得的数码相片采用Photoshop CS3 Extended软件(Adobe公司,美国)进行测量处理,分别计算各部分的面积。缺血范围用AAR与左室面积之比表示,梗死范围以AN与AAR之比表示。
1.5 统计学方法 所有计量资料首先进行正态分布检验,符合正态分布的计量资料采用均数±标准差(±s)表示。应用SPASS17.0统计软件对实验数据进行分析。多组间比较采用单因素方差分析,组间两两比较应用q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组犬血流动力学检测结果比较 与I/R组比较,CBS组的HR、MAP差异无统计学意义,VAG组大多数时间段的HR、MAP要高于I/R组和CBS组,见表1。
2.2 各组犬再灌注6 h时血清炎症因子浓度比较 I/R组和VAG组心肌再灌注6 h时血清TNF-α、IL-1β和IL-6浓度差异无统计学意义(P均>0.05)。CBS组心肌再灌注6 h时血清TNF-α、IL-1α和IL-6浓度均显著低于I/R组和VAG组(P<0.05),见表2。
表1 各组犬缺血期和再灌注期血流动力学指标(±s)
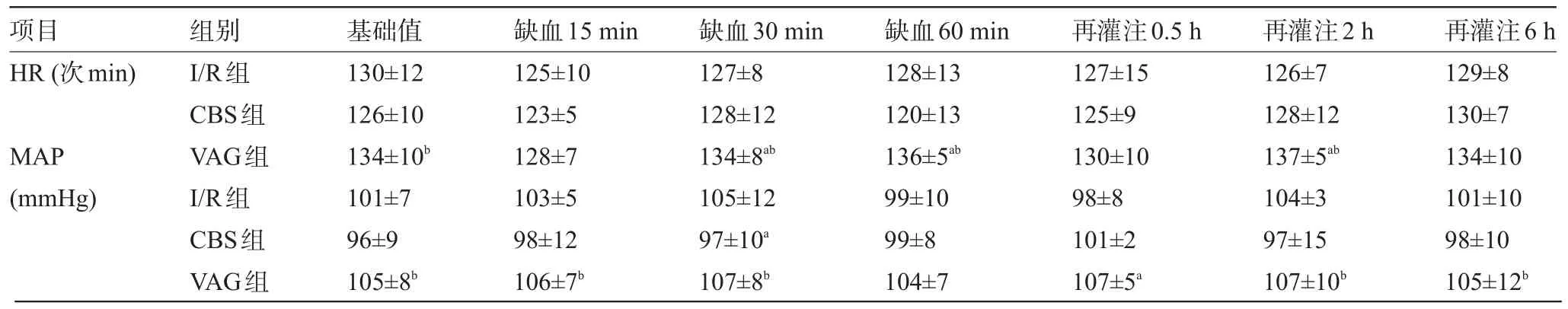
表1 各组犬缺血期和再灌注期血流动力学指标(±s)
注:与I/R组比较,aP<0.05;与CBS组比较,bP<0.05,1 mmHg=0.133 kPa。
项目HR(次min) MAP (mmHg)组别I/R组CBS组VAG组I/R组CBS组VAG组基础值130±12 126±10 134±10b101±7 96±9 105±8b缺血15 min 125±10 123±5 128±7 103±5 98±12 106±7b缺血30 min 127±8 128±12 134±8ab105±12 97±10a107±8b缺血60 min 128±13 120±13 136±5ab99±10 99±8 104±7再灌注0.5 h 127±15 125±9 130±10 98±8 101±2 107±5a再灌注2 h 126±7 128±12 137±5ab104±3 97±15 107±10b再灌注6 h 129±8 130±7 134±10 101±10 98±10 105±12b
表2 各组犬再灌注6h时血清炎症因子浓度比较(n=6,±s)

表2 各组犬再灌注6h时血清炎症因子浓度比较(n=6,±s)
注:与I/R组比较,aP<0.05;与CBS组比较,bP<0.05。
组别I/R组CBS组VAG组IL-6(ng/L) 190.24±20.67 100.54±10.14a185.69±8.43bTNF-α(ng/L) 175.24±5.12 120.29±4.28a170.36±6.14bIL-1β(ng/L) 200.13±20.56 153.47±12.68a195.46±8.67b
2.3 各组犬心肌缺血区中性粒细胞浸润情况比较 I/R组和VAG组可观察大量密集的中性粒细胞浸润到心肌缺血区。CBS组心肌缺血区可见中性粒细胞的浸润程度显著下降。I/R组和VAG组MPO活性差异无统计学意义[(20.14±3.27)vs(20.78±2.56),P>0.05]。CBS组的MPO活性显著低于I/R组和VAG组[(13.26±4.17)vs(20.14±3.27),13.26±4.17)vs (20.78±2.56),P均<0.05]。
2.4 各组犬心肌梗死面积检测结果比较 I/R组和VAG组心肌梗死面积和缺血面积无统计学意义(P均>0.05)。CBS组心肌梗死面积和缺血面积显著低于I/R组和VAG组(P均<0.05),见表3。
表3 各组犬心肌梗死面积的检测及比较结果(n=6,±s)

表3 各组犬心肌梗死面积的检测及比较结果(n=6,±s)
注:与I/R组比较,aP<0.05;与CBS组比较,bP<0.05。
I/R组CBS组VAG组32.4±5.1 20.5±3.2a30.2±3.6b25.6±3.2 15.4±3.6a23.4±2.7b
3 讨 论
在本研究中笔者发现,CBS可以明显抑制缺血再灌注后中性粒细胞向缺血组织浸润,抑制全身炎症因子的释放,减轻缺血再灌注引起的组织损伤。但是,当切除双侧颈迷走神经干,CBS不能发挥所有上述的保护心肌的作用。这证实了笔者的推测,即CBS能够减轻犬心肌缺血再灌注损伤,其机制与激活迷走神经的胆碱能抗炎通路有关。
电刺激颈动脉压力感受器可通过颈动脉窦动脉压力感受性反射的传入神经使到达孤束核的神经冲动增多,然后通过延髓内的神经通路,使头端延髓腹外侧区(RVLM)的血管运动神经元抑制,减弱交感神经紧张性活动,增强迷走神经紧张性活动,其效应为心率减慢,心输出量减少,外周阻力降低,动脉血压下降。研究表明,慢性CBS可以明显抑制血管、心脏、肾脏的交感神经活性,同时提高迷走神经活性,从而起到长期降低血压的作用[14]。迷走神经刺激可治疗以过度和失调炎症反应为特征的多种疾病,包括败血症、内毒素血症、脓毒血症、失血性休克、风湿性关节炎、心肌炎等[11]。Katare等[15]和Calvillo等[16]分别证实迷走神经刺激能够减轻心肌I/R损伤,降低心肌梗死面积,且该保护作用不受降低心率的效果的影响。同迷走神经刺激具有保护心肌I/R损伤作用一样,我们的研究发现CBS可以激活迷走神经活性,从而发挥同样的效果。
心肌缺血再灌注后补体活化和活性氧自由基释放等导致炎性细胞向心肌组织浸润,并释放大量促炎因子,如TNF-α、IL-1、IL-6等[17];TNF-α和IL-6等可激活NF-кB,活化的NF-кB可进一步诱导大量促炎细胞因子释放,包括TNF-α、IL-1、IL-6等[18],进而减弱心肌微循环血管的通透性和破坏冠状动脉微循环中的血流储备,加重心肌损伤[19]。研究表明,迷走神经刺激可释放乙酰胆碱特异性结合于组织巨噬细胞表面的含α7亚基的烟碱受体(α-7nACh),抑制炎症炎症反应,即迷走神经-胆碱能抗炎通路[20]。Uemura等[21]发现在兔心肌缺血1 h再管注24 h后,短期的迷走神经刺激可抑制中性粒细胞向心肌组织的浸润,减轻缺血区中性心肌组织中性粒细胞密度,抑制心肌组织炎症因子的表达,如IL-1α、IL-6等。Yoshikawa等[22]证实乙酰胆碱活化α-7nAChR抑制NF-kB从细胞质转向细胞核,从而减少IL-6和TNF-α等炎症因子的表达。Wang等[23]发现迷走神经电刺激可以降低缺血再灌注心肌缺血区和非缺血区炎症因子的释放,包括NF-кB、IL-1、IL-6、HMCB-1和ICAM-1等,改善全身炎症反应,减轻心肌心肌I/R损伤。本研究发现CBS能够抑制心肌组织中性粒细胞的侵润,在全身水平上减少促炎因子(TNF-α、IL-1β、IL-6)的浓度,表明CBS同迷走神经刺激一样具有明显的抗炎作用。
本研究的不足之处在于我们并没有应用α-7nACh抗体阻断乙酰胆碱与α-7nACh的结合,从而在分子水平上阻断胆碱能抗炎通路。由于缺乏α-7nACh抗体,且传入迷走神经是胆碱能抗炎通路的首站,所以我们选择切段双侧迷走神经干来阻断胆碱能抗炎通路。其次,既往研究证实迷走神经刺激对心肌I/R损伤的保护作用,其机制除了抑制心肌I/R损伤诱导的炎症反应,还与抑制氧自由基的释放[24]、抑制心肌去甲肾上腺素[25]和间质肌红蛋白的释放[26]以及抑制再灌注诱导的线粒体通透性转换孔开放[16]等有关。那么,CBS对心肌I/R损伤的保护作用是否也涉及到这些机制?这有待我们进一步的研究。
综上所述,短期颈动脉压力感受器电刺激可减轻犬心肌缺血再灌注损伤,抑制中心粒细胞向缺血组织浸润以及抑制全身的炎症反应,其机制与短期颈动脉压力感受器电刺激激活迷走神经的胆碱能抗炎通路有关。但要完全明确CBS的保护机制,还需深入研究。
[1]Antman EM,Anbe DT,Armstrong PW,et al.ACC/AHA guidelines for the management of patients with ST-elevation myocardial infarction—executive summaryA report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 1999 Guidelines for the Management of Patients With Acute Myocardial Infarction)[J].Journal of theAmerican College of Cardiology,2004,44(3):671-719.
[2]Yellon DM,Hausenloy DJ.Myocardial reperfusion injury[J].New England Journal of Medicine,2007,357(11):1121-1135.
[3]Steffens S,Montecucco F,Mach F.The inflammatory response as a target to reduce myocardial ischaemia and reperfusion injury[J]. Thromb Haemost,2009,102(2):240-247.
[4]Ottani A,Giuliani D,Galantucci M,et al.Melanocortins counteract inflammatory and apoptotic responses to prolonged myocardial ischemia/reperfusion through a vagus nerve-mediated mechanism[J]. European Journal of Pharmacology,2010,637(1):124-130.
[5]Heusser K,Tank J,Engeli S,et al.Carotid baroreceptor stimulation, sympathetic activity,baroreflex function,and blood pressure in hypertensive patients[J].Hypertension,2010,55(3):619-626.
[6]Scheffers IJ,Kroon AA,Schmidli J,et al.Novel Baroreflex Activation Therapy in Resistant HypertensionResults of a European Multi-Center Feasibility Study[J].Journal of the American College of Cardiology,2010,56(15):1254-1258.
[7]Bisognano JD,Bakris G,Nadim MK,et al.Baroreflex activation therapy lowers blood pressure in patients with resistant hypertensionresults from the double-blind,randomized,placebo-controlled rheos pivotal trial[J].Journal of the American College of Cardiology,2011,58(7):765-773.
[8]Zucker IH,Hackley JF,Cornish KG,et al.Chronic baroreceptor activation enhances survival in dogs with pacing-induced heart failure [J].Hypertension,2007,50(5):904-910.
[9]Sabbah HN,Gupta RC,Imai M,et al.Chronic electrical stimulation of the carotid sinus baroreflex improves left ventricular function and promotes reversal of ventricular remodeling in dogs with advanced heart failure[J].Circulation:Heart Failure,2011,4(1):65-70.
[10]Lohmeier TE,Iliescu R.Chronic Lowering of Blood Pressure by Carotid Baroreflex Activation Mechanisms and Potential for Hypertension Therapy[J].Hypertension,2011,57(5):880-886.
[11]Martelli D,McKinley MJ,McAllen RM.The cholinergic anti-inflammatory pathway:A critical review[J].Autonomic Neuroscience,2013.
[12]阳 康,廖 凯,萨仁高娃,等.短期颈动脉压力感受器电刺激对犬心肌缺血再灌注损伤的影响[J].海南医学,2015,26(2):157-160.
[13]Zucker IH,Hackley JF,Cornish KG,et al.Chronic baroreceptor activation enhances survival in dogs with pacing-induced heart failure [J].Hypertension,2007,50(5):904-910.
[14]Lohmeier TE,Iliescu R.Chronic Lowering of blood pressure by carotid baroreflex activation mechanisms and potential for hypertension therapy[J].Hypertension,2011,57(5):880-886.
[15]Katare RG,Ando M,Kakinuma Y,et al.Vagal nerve stimulation prevents reperfusion injury through inhibition of opening of mitochondrial permeability transition pore independent of the bradycardiac effect[J].The Journal of Thoracic and Cardiovascular Surgery, 2009,137(1):223-231.
[16]Calvillo L,Vanoli E,Andreoli E,et al.Vagal stimulation,through its nicotinic action,limits infarct size and the inflammatory response to myocardial ischemia and reperfusion[J].Journal of Cardiovascular Pharmacology,2011,58(5):500-507.
[17]Frangogiannis NG,Smith CW,Entman ML.The inflammatory response in myocardial infarction[J].Cardiovascular Research,2002, 53(1):31-47.
[18]Kleinbongard P,Schulz R,Heusch G.TNF-αin myocardial ischemia/reperfusion,remodeling and heart failure[J].Heart Failure Reviews,2011,16(1):49-69.
[19]Hansen PR.Inflammatory alterations in the myocardial microcirculation[J].Journal of Molecular and Cellular Cardiology,1998,30 (12):2555-2559.
[20]Martelli D,McKinley MJ,Mc allen RM.The cholinergic anti-inflammatory pathway:a critical review[J].Autonomic Neuroscience,2014,182:65-69.
[21]Uemura K,Zheng C,Li M,et al.Early short-term vagal nerve stimulation attenuates cardiac remodeling after reperfused myocardial infarction[J].Journal of Cardiac Failure,2010,16(8):689-699.
[22]Yoshikawa H,Kurokawa M,Ozaki N,et al.Nicotine inhibits the production of proinflammatory mediators in human monocytes by suppression of I-kappaB phosphorylation and nuclear factor-kappaB transcriptional activity through nicotinic acetylcholine receptoralpha7[J].Clin Exp Immunol,2006,146(1):116-123.
[23]Wang Q,Cheng Y,Xue FS,et al.Postconditioning with vagal stimulation attenuates local and systemic inflammatory responses to myocardial ischemia reperfusion injury in rats[J].Inflammation Research,2012,61(11):1273-1282.
[24]Mioni C,Bazzani C,Giuliani D,et al.Activation of an efferent cholinergic pathway produces strong protection against myocardial ischemia/reperfusion injury in rats[J].Critical Care Medicine, 2005,33(11):2621-2628.
[25]Kawada T,Yamazaki T,Akiyama T,et al.Vagal stimulation suppresses ischemia-induced myocardial interstitial norepinephrine release[J].Life Sciences,2006,78(8):882-887.
[26]Kawada T,Yamazaki T,Akiyama T,et al.Vagal stimulation suppresses ischemia-induced myocardial interstitial myoglobin release [J].Life Sciences,2008,83(13):490-495.
Short-term carotid baroreceptors stimulation attenuates myocardial ischemia reperfusion injury in dogs.
YANG Kang,LIAO Kai,SA Rengaowa,HUANG Bing,CHEN Cai-yun,LU Zhi-bing,HE Wen-bo,WANG Song-yun,JIANG Hong.Department of Cardiology,Renmin Hospitial of Wuhan University,Wuhan 430060,Hubei,CHINA
ObjectiveTo test whether carotid baroreceptors stimulation could reduce acute myocardial ischemia reperfusion injury(IRI)through the cholinergic anti-inflammatory pathway.MethodsThirty-six dogs were randomly allocated into three groups,each with 12 dogs:ischemia reperfusion group(I/R group),carotid baroreceptors stimulation group(CBS group)and vagotomy group(VAG group).Dogs were subjected to 1 h coronary artery occlusion followed by 6 h reperfusion alone(I/R group).Dogs in CBS group were treated with carotid baroreceptors stimulation 2 h before ischemia myocardial(with frequency of 50 Hz,pulse width of 0.5 ms,and intensity adjusted with blood pressure to keep the blood pressure 10%lower than before stimulation).Dogs in VAG group were treated with vagotomy and carotid baroreceptors stimulation.Heart rate(HR),mean arterial pressure(MAP)were recorded before ischemia,15 min,30 min,60 min after ischemia,0.5 h,2 h,6 h after reperfusion.Six dogs were selected in each group and collected for venous blood 6 h after reperfusion.Serum levels of inflammatory cytokines(TNF-α,IL-1β,IL-6)during re-perfusion were assayed,and the neutrophil infiltration(MPO activity)was quantified.The ischemia myocardial and infarct size were detected in the remaining 6 dogs in each group.ResultsCompared with I/R group,infarct size,MPO activity,serum levels of TNF-α,IL1-βand IL-6 in CBS group at 6 h after reperfusion were significantly lower(P<0.05). However,there was no statistically significant difference between VAG group and I/R group.ConclusionCarotid baroreceptors stimulation attenuates myocardial ischemia reperfusion injury.The underlying mechanism may be associated with activating the cholinergic anti-inflammatory pathway.
Carotid baroreceptors stimulation;Myocardial ischemia reperfusion injury;Inflammatory reaction;Cholinergic anti-inflammatory pathway;Vagus nerve
R-332
A
1003—6350(2015)08—1101—05
10.3969/j.issn.1003-6350.2015.08.0395
2014-10-24)
国家自然科学基金(编号:81270339、81170195、81300812);湖北省自然科学基金(编号:2013CFB302);武汉市科技攻关项目(编号:2013060602010271);武汉大学青年教师自主科研项目(编号:2042012121087);武汉大学2012年博士研究生自主科研项目(编号:2012302020206)
江 洪。E-mail:jianghong58@gmail.com