拔牙创使用人羊膜的临床研究*
翟幼文 汪文丰 黄啸林 梁向新 王鑫
牙齿因龋坏或者严重外伤不能保留时往往需将牙拔除,拔牙术是口腔门诊常见手术,牙拔除后拔牙创对应的局部牙槽骨发生改建,牙槽嵴出现吸收,影响后期义齿修复,常规拔牙后需3个月后行牙修复。如何减少拔牙后牙槽嵴的吸收,保存牙槽嵴,促进牙槽骨的愈合,取得理想的后期修复疗效,缩短二期修复治疗时间,已是国内外研究的一个热点。近些年来国内外报道预防牙槽嵴吸收的研究很多[1-5],但目前仍未见牙槽骨拔牙创使用人羊膜的临床研究报道。本研究以需拔除双侧第二前磨牙正畸治疗的患者为研究对象,观察人羊膜对临床拔牙创愈合及牙槽嵴改建的作用。
1 资料与方法
1.1 一般资料 选取来本院行牙正畸治疗的患者,同时需拔除双侧下颌第二前磨牙进行矫治,口内检查所有恒牙均已萌出,并无明显口腔疾患,自愿且签署知情同意书20例,年龄16~21岁,平均18岁,男8例,女12例。研究采用的人羊膜由江西瑞济生物工程技术有限公司生产(注册产品标准号YZB/国0593-2005)。
1.2 试验方法 拔牙前使用生理盐水含漱清洗口腔,碘伏棉签消毒,采用2%利多卡因行下牙槽、舌和颊神经一次阻滞麻醉,注入麻药约2.0~2.5 mL,待同侧半侧下唇及舌麻木即麻醉充分后,先将牙龈分离,再用下颌前磨牙钳将前磨牙拔除,留下大小约4.0 mm×4.5 mm拔牙创。左侧拔牙创不处理作为对照组,3~4 d后同样拔除右侧下颌第二前磨牙,右侧拔牙创内植入大小约4.5 mm×5.0 mm人羊膜作为试验组。然后于术后1、2、3个月拍口腔全景片进行观察。
1.3 术后观察及测量 术后1周检查拔牙创牙龈愈合情况,术后1、2、3个月均拍口腔全景片,将影像数据输入Neusoft PACS/RIS version 3.1系统,观察拔牙创牙槽骨骨量及骨密度等骨愈合情况,并以拔牙创近远中向中点为参照测量牙槽嵴吸收值。
1.4 统计学处理 将测量数据采用SPSS 13.0软件进行统计学分析,计量资料以(±s)表示,采用配对t检验,P<0.01为差异有统计学意义。
2 结果
2.1 一般情况 所有患者术后1周进行复诊,检查拔牙创牙龈愈合情况,试验组与对照组拔牙创均已愈合良好,无明显红肿及渗出,其中左侧对照组2例患者感觉拔牙创有轻度疼痛不适,对应牙龈稍肿胀,右侧试验组无明显不适。拔牙创牙龈愈合余留创面试验组均小于对照组。
2.2 X线摄片分析
2.2.1 术后X线片表现 术后第1、2两个月拔牙创的牙槽骨骨密度试验组比对照组高,第3个月后试验组与对照组骨密度无明显差异。第1个月后试验组:拔牙创见少量片状低密度区,骨质硬化较明显,牙槽嵴毛糙、不光整。对照组:拔牙创见大量片状低密度区,骨质部分硬化,牙槽嵴有中断现象。第2个月后试验组:拔牙创见点状低密度区,骨质硬化明显、均匀,牙槽嵴连续、光整。对照组:拔牙创见少量小片状低密度区,骨质硬化,密度不均匀,牙槽嵴不连续,部分有中断现象。第3个月后试验组:拔牙创骨质硬化明显,密度均匀,牙槽嵴连续、光整。对照组:拔牙创牙槽骨骨质硬化明显,点状低密度区,牙槽嵴连续,不光整、稍毛糙,见图1~3。
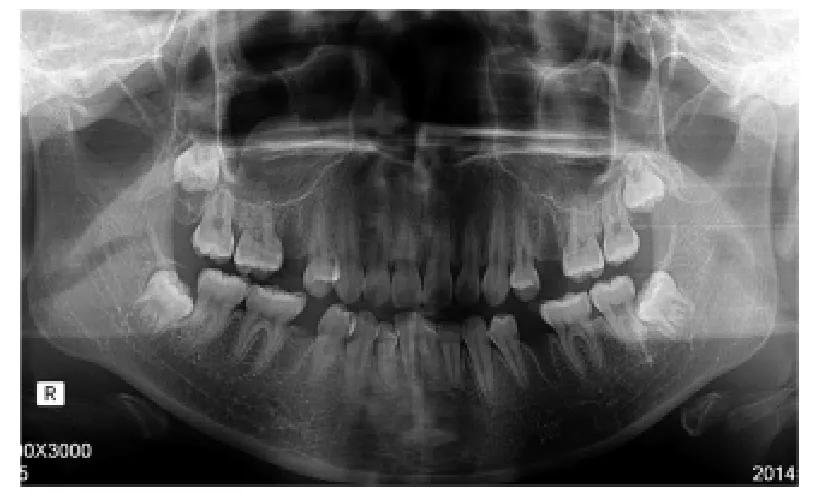
图1 术后1个月曲面断层片
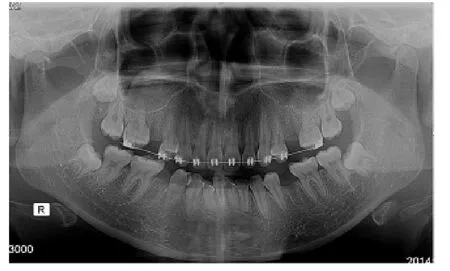
图2 术后2个月曲面断层片
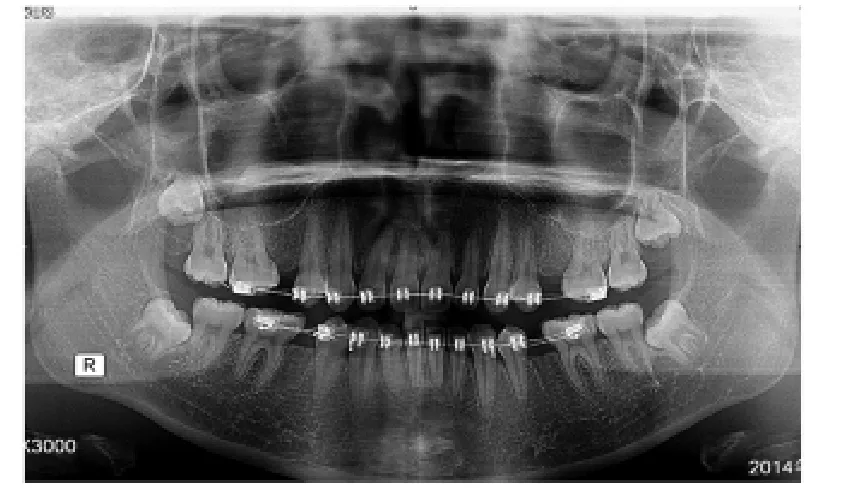
图3 术后3个月曲面断层片
2.2.2 两组牙槽嵴吸收值比较 术后观察1~3个月,测量牙槽嵴吸收情况,发现两组牙槽嵴均发生不同程度的吸收,术后第1个月吸收最快。术后1、2、3个月试验组牙槽嵴吸收高度均低于对照组,差异均有统计学意义(P<0.01),见表1。第1、2两个月每月牙槽嵴吸收量试验组低于对照组,差异有统计学意义(P<0.01),第3个月两组间差异无统计学意义(P>0.05),见表 2。
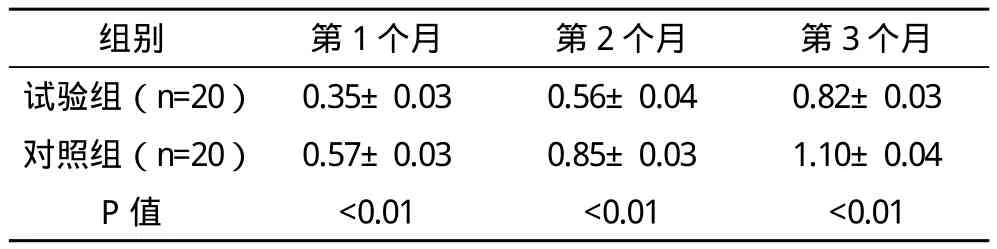
表1 两组牙槽峭吸收高度总量比较(x-±s) mm
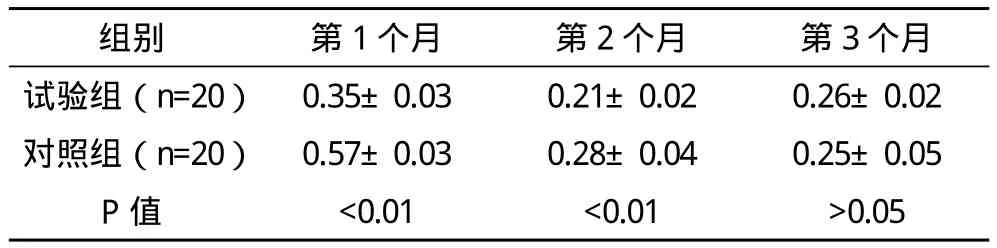
表2 两组牙槽嵴吸收高度比较(x-±s) mm
3 讨论
拔牙创在术后3~6个月牙槽骨出现正常骨结构,骨重建才基本完成。愈合过程牙槽突由于缺乏牙齿咀嚼的功能性刺激,对应部位的牙龈软组织及牙槽骨会不同程度地发生改变[1,6],牙槽突的宽度和高度会明显降低[6-7],牙槽骨的形态和结构发生改变。牙槽骨的进行性吸收和改建主要发生在拔牙后1~3个月,引起骨量不足导致牙槽嵴萎缩。这给临床牙的修复带来麻烦。牙缺失后往往需待拔牙创愈合3个月后再行修复治疗,患者需漫长的等待。因此如何促进牙槽骨的愈合,保存牙槽骨的骨量,减少牙槽嵴的吸收,缩短二期修复时间,一直是口腔医师关注的热点。本研究在临床拔牙创首次植入人羊膜,观察人羊膜对拔牙创的影响。
随着生物医学的发展,近年来临床上对拔牙创牙槽嵴吸收的研究方法有多种。大多采用自体骨、异体骨、异种骨移植及人工骨等各种研究方法。但自体骨移植往往需开辟第二处手术切口,一方面延长了手术时间,另一方面也增加了患者损伤;异体骨、异种骨抗原性强,易引起排斥反应导致拔牙创充填物被排出;人工骨如羟基磷灰石植入拔牙创后不完全吸收[2,4],而磷酸三钙植入引导新骨生成后能逐渐降解吸收,但需加入骨生长因子一同使用。
临床上拔牙创良好的植入材料应不易引起排斥反应,生物相容性好,可吸收,能促进拔牙创的愈合,保存牙槽嵴。来源丰富,易保留,同时操作简便等。人羊膜是人胎膜的内层,不含血管、神经及淋巴管,光滑半透明状,有延展性及韧性。羊膜由胚胎滋养细胞层衍化而来,主要含有人羊膜上皮细胞(hAEC)及人羊膜间充质细胞(hAMC)两种细胞[8-9]。羊膜是一种很好的天然高分子生物材料,具有抗炎、抗菌及抗病毒功能[10],能防止细菌及病毒入侵起到物理屏障作用,并能通过各种途径减轻或阻断炎症反应,具有抑制组织炎性反应的能力,具有促进细胞的迁移和增殖功能[11],促进创面的愈合[12]。羊膜免疫原性低[13-14],羊膜移植不易发生排斥反应,随胎儿的出生排出体外,来源丰富,且无伦理学争议。本研究将羊膜运用于临床牙槽骨拔牙创,术后1周观察对照组2例出现轻度充血肿痛不适炎性症状,植入羊膜拔牙创感觉良好,且拔牙创余留创面均小于对照组。本研究也说明了羊膜具有抑制组织炎性反应的能力,起抗炎作用,促进拔牙创牙龈软组织的愈合。
人羊膜主要含有hAEC及hAMC两种细胞。Pasquinelli等[15]在研究对比hAEC、hAMC和骨髓基质干细胞的超微结构,发现hAEC可能较骨髓基质干细胞具有不同的功能,以及多向分化潜能。Ilancheran等[16]对hAEC采用1,25-二羟胆骨化醇、维生素C和β-甘油磷酸进行骨向分化诱导研究,发现有骨性矿物质沉积。Zhou等[17]研究hAEC在骨形态发生蛋白(BMP)7的作用下,诱导培养hAEC均表达成软骨细胞特异性蛋白:聚集蛋白聚糖、SOX9、癌胚蛋白68及2型胶原等。Mattioli等[18]研究动物骨缺损区植入AEC,发现细胞能广泛地快速成骨分化,且能持续形成新生骨。有研究表明羊膜间充质干细胞有强的可塑性及多向分化的潜能[19-21]。有学者研究在体外骨向诱导hAMC,细胞表达成骨标志物骨钙蛋白和1型胶原等,细胞外的矿化组织持续增加[22-23]。
本临床研究术后查下颌骨口腔全景片,发现第1、2、3个月牙槽骨拔牙创愈合骨质硬化程度,植入人羊膜的拔牙创均高于对照组。表明人羊膜植入的拔牙创新生骨的骨量更多,同时也说明人羊膜对骨愈合的具有成骨及骨引导功能。术后观察测量拔牙创牙槽嵴的吸收情况,将两组进行对比,观察人羊膜对牙槽嵴保存的影响。研究显示各时间段牙槽嵴吸收高度植入人羊膜拔牙创均明显低于对照组,第1、2两个月每月吸收高度试验组低于对照组,而第3个月两组吸收高度统计学差异。临床研究表明人羊膜可以促进拔牙创的骨愈合,保存牙槽嵴减少其吸收,第3个月的牙槽嵴吸收高度两组无明显差别,拔牙创的愈合需3~6个月,说明人羊膜可以促进拔牙创牙槽骨的早期愈合,且不影响其自然愈合。
本研究采用人羊膜是直接植入拔牙创,无需特殊器械,操作较简便,靠拔牙创内血凝块固定在拔牙创内,血凝块大约15 min钟形成将创面封闭。牙龈无需进行缝合,但需向患者交代术后紧咬棉卷30 min,勿吮吸。若拔牙创出血量少,则可以通过搔刮拔牙创促进创面出血,待血液填满拔牙创再植入人羊膜,最后咬紧棉卷。这样才能保证植入人羊膜可靠的固定。
人羊膜来源较为广泛,免疫源性低,随胎儿娩后遗弃,不存在伦理问题。植入拔牙创的人羊膜不影响其自然愈合,能保存牙槽嵴并减少其吸收,促进拔牙创的早期愈合,这样也就能缩短缺牙后二期修复的时间间隔,是一种较为理想的拔牙创植材料。
[1] Schropp L,Wenzel A,Kostopoulos L,et al.Bone healing and soft tissue contour changes following single-tooth extraction: a clinical and radiographic 12 month prospective study[J].Int J.Periodontics Restorative Dent,2003,23(4):313-323.
[2] Pierre Weissa,Pierre Layrolle,Leon Philippe Clergeau,et al.The safety and efficacy of an injectable bone substitute in dental sockets demonstrated in a human clinical trial[J].Biomaterials,2007,28(22):3295-3305.
[3] Irinakis T,Tabesh M.Preserving the socket dimensions with bone grafting in single sites:an esthetic surgical approach when planning delayed implant placement[J].J Oral Implantol,2007,33(3):156-163.
[4]白志伟.羟基磷灰石预防复杂牙拔牙并发症的临床应用[J].中国航天工业医药,2001,3(5):54.
[5]薛洋,胡开进,王新木,等.异种脱细胞真皮基质对拔牙创愈合的作用[J].口腔医学研究,2008,24(2):152-153.
[6] Araújo M G, Lindhe J.Dimensional ridge alterations following tooth extraction. An experimental study in the dog[J]. J Clin Periodontol,2005,32(12): 212-218.
[7] Camargo P M,Lekovic V,Weinlaender M,et al.Influence of bioactive glass on changes in alveolar process dimensions after exodontia[J].Oral Surgery, Oral Medicine, Oral pathology, Oral Radiology and Endodontics,2000,90(12):581-586.
[8]喻皇飞,陈代雄.人羊膜细胞神经生物学性状研究进展[J].重庆医学,2011,40(32):3315-3317.
[9] Kronsteiner B, Wolbank S, Peterbauer A, et al. Human mesenchymal stem cells from adipose tissue and amnion influence T-cells depending on stimulation method and presence of other immune cells[J].Stem Cells Dev,2011,20(12):2115-2126.
[10] Lockington D,Cooney J,Lewis A,et al.Substance Pconcentrateon in human amniotic membrane[J].Arch Ophthalmol,2012,130(4):522-523.
[11] Mostaque A K,Rahman K B.C omparisons of the effects of biological membrane(amnion) and silver sulfadiazine in the management of burn wounds in children[J].J Burn Care Res,2011,32(2):200-209.
[12] Insausti C L, Alcaraz A, Garc í a-Vizca í no E M,et al. Amniotic membrane induces epithelialization in massive posttraumatic wounds[J].Wound Repair Regen,2010,18(4):368-377.
[13] Qureshi K M,Oliver R J,Paget M B,et al.Human amniotic epithelial cells induce localized cell-mediated immune privilege in vitro:Implications for pancreatic islet transplantation[J].Cell Transplant,2011,20(4):523-534.
[14] Yi T,Song S U.immunomodulatory properties of mesenchymal stem cells and their therapeutic applications[J].Arch Pharm Res,2012,35(2):213-221.
[15] Pasquinelli G,Tazzari P,Ricci F,et al.Ultrastructural characteristics of human mesenchymal stromal(stem) cells derived from bone
marrow and term placenta [J]. Ultrastruct Pathol, 2007,31(1):23-31.
[16] Ilancheran S,Michalska A, Peh G,et al.Stem cells derived from human fetal membranes display multilineage differentiation potential[J].Biol Reprod, 2007,77(3):577-588.
[17] Zhou J,Yu G,Cao C,et al.Bone morphogenetic protein-7 promotes chondrogenesis in human amniotic epithelial cells[J].Int Orthop,2011,35(6):941-948.
[18] Mattioli M,Gloria A,Turriani M,et al.Stemness characteristics and osteogenic potential of sheep amniotic epithelial cells[J].Cell Biol Int,2012,36(1):7-19.
[19] Cargnoni A,Ressel L,Rossi D,et al.Conditioned medium from amniotic mesenchymal tissue cells reduces progression of bleomycininduced lung fibrosis[J].Cytotherapy,2012,14(2): 153-161.
[20]冶娟,慕晓玲.人胎盘源性间充质干细胞体外分离培养及多向分化潜能的研究[J].石河子大学学报(自然科学版),2012, 30(3):351-355.
[21] Manuelpillai U, Moodley Y, Borlongan C V, et al. Amniotic membrane and amniotic cells: Potential therapeutic tools to combat tissue inflammation and fibrosis[J].Placenta,2011, 32(Suppl4):S320-S325.
[22] Zhong Z N,Zhu S F,Yuan A D,et al.Potential of placentaderived mesenchymal stem cells as seed cells for bone tissue engineering:preliminary study of osteoblastic differentiation and immunogenicity[J]. Orthopedics,2012,35(9):779-788.
[23] Chen M,Wang X,Ye Z,et al.A modular approach to the engineering of a centimetersized bone tissue construct with human amniotic mesenchymal stem cells-laden microcarriers[J].Biomaterials,2011,32(30):7532-7542.

