黄海中南部头足类的群落结构与生物多样性
吴 强, 王 俊, 李忠义, 戴芳群, 陈瑞盛, 孙 珊, 金显仕
(中国水产科学研究院 黄海水产研究所 农业部海洋渔业资源可持续利用重点开放实验室, 山东省渔业资源与生态环境重点实验室, 山东 青岛 266071)
头足类具有生命周期短、生长迅速、经济价值高等特点, 是海洋渔业资源的重要组成部分。中国近海头足类资源丰富, 是捕捞头足类的主要国家之一。黄海为半封闭海, 位于中国大陆和朝鲜半岛之间,底地形从岸向外倾斜, 在黄海中南部靠近50 m等深线附近存在一由北向南的海槽, 该区域夏季受冷水团控制, 冬季受黄海暖流影响, 是黄海典型生态区[1],具有太平洋褶柔鱼(Todarodes pacificus)等头足类栖息的环境和丰富的饵料基础, 如太平洋磷虾(Euphausia pacifica)[2]。目前国内的头足类群落研究主要限于东海水域, 研究内容包括头足类的种类组成、数量分布[3-4]及资源量[5-6]等。针对南海头足类种类组成及资源密度[7-8]的研究也有报道。对黄海头足类群落的研究则鲜有报道, 已有报道都是以黄海无脊椎动物群落为研究对象, 仅将头足类作为部分内容进行了简要分析[9-11]。为了掌握黄海中南部头足类的资源状况,本研究根据 2010~2011年间春、秋、冬 3季的底拖网调查资料, 对黄海中南部水域头足类的种类组成、数量分布及资源量的季节变化做了研究, 旨在摸清黄海中南部水域头足类的群落结构及数量分布, 了解该水域头足类的资源状况, 以期为头足类资源的管理和开发提供理论依据。
1 材料与方法
1.1 材料来源
数据来自于春季(2010年5月)、秋季(2011年10月)和冬季(2011年 1月)使用“北斗”号科学调查船进行的底拖网调查。调查范围为黄海中南部(32°00′~37°00′N, 121°00′~125°00′ E), 见图1。采样工具为“北斗”号科学调查船专用底拖网, 网口高度为6.1~8.3 m, 网口宽度约25 m, 囊网网目24 mm, 拖速为3.0 kn, 拖网时间为1 h。计划站位共59个, 受天气及海况等影响, 实际拖网站位为春季(48个)、秋季(47个)和冬季(36个)。 调查采样及生物学测定根据《海洋调查规范》[12]进行, 种类鉴定参照董正之[13], 渔获率统一为单位时间生物量(kg/h)或丰度(个/h)。

图1 黄海中南部调查站位Fig.1 Survey stations in central and southern Yellow Sea
1.2 生态优势度
群落物种生态优势度的研究采用Pinkas等[14]相对重要性指数(IRI):

式中,N为某一种类的个体数密度占总个体数的百分率;W为某一种类的生物量占总生物量的百分率;F为某一种类出现的站数占调查总站数的百分率。相对重要性指数(IRI)包含了生物的个体数、生物量和出现频率 3个重要信息, 常被用来研究渔业生物群落各种类的生态优势度。物种IRI值大于1000时定为优势种,IRI值大于等于100且小于1000的种类定义为重要种。
1.3 资源密度
资源密度以拖网扫海面积法来估算, 计算式为:

式中:ρ为资源密度(质量: kg/km2);C为平均每小时拖网渔获量(质量: kg/h);a为网具每小时扫海面积(km2/h), 黄海中南部调查拖网时速为 3 n mile(1n mile=1.852 km), 网口宽度平均为0.0217 km, 因此每网扫海面积为0.12 km2; 为网具捕获率(q=1–E,E为逃逸率), 本文E取值0.5[3,15-16]。
1.4 生物多样性
Margalef丰富度指数[17]:D=(S–1)lnN
Shannon-Wiener多样性指数[18]:

Pielou均匀性指数[19]:J'=H'/lnS
式中:S为种类数;N为生物量或总密度,Pi=ni/N, 为第i种头足类占总生物量或个体数的比例,ni为第i种头足类占的生物量或个体数。
1.5 群落结构相似性
利用Bray-Curtis相似性指数[20]计算黄海中南部各季节头足类类群落结构相似性, 计算公式为:

式中xij,xim分别为第i个种类在j季节和m季节单位时间的资源密度(经过4次方根转换)。当B=100时,表示两个群落完全相同; 当B=0时, 表示两个群落完全不同。
群落结构的差异性利用 ANOSIM (one-way analysis of similarities)程序进行检验分析。
1.6 数据处理
数据处理使用EXCEL2010、SPSS 15和PRIMER 5;图件绘制使用SURFER 8.0和PRIMER 5。
2 结果与分析
2.1 种类组成及优势种
3个季节于黄海中南部水域共捕获头足类13种,隶属于3目6科6属, 其中以秋季捕获种类数最多,为10种, 春季和冬季均捕获8种。表1统计了各季节各种类的生物量百分比(W)、个体数百分比(N)和出现频率(F), 进而计算出相对重要性指数(IRI)。可以看出, 春季优势种为双喙耳乌贼(Sepiola birostrata)和枪乌贼(Loligospp.), 且双喙耳乌贼为绝对优势种;秋季优势种为枪乌贼和针乌贼; 冬季优势种为枪乌贼、双喙耳乌贼和太平洋褶柔鱼(Todarodes acificus),其中以枪乌贼相对重要性指数值最高。
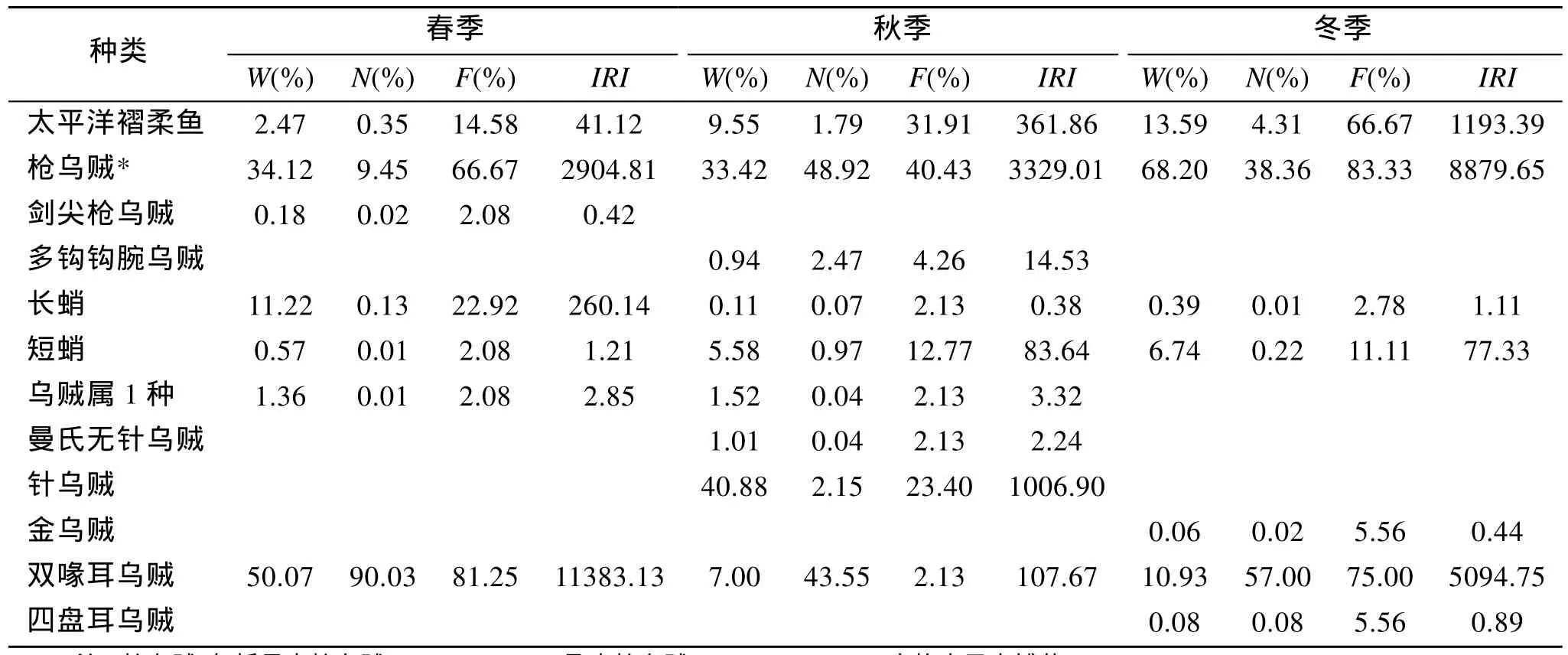
表1 黄海中南部头足类种类组成及优势度特征值Tab.1 The species composition and characteristic index of Cephalopoda in Central and Southern Yellow Sea
2.2 资源密度
根据拖网调查结果, 黄海中南部水域春、秋、冬3个季节头足类平均资源密度为 6.70 kg/km2, 其中,以冬季密度最高, 为 12.72 kg/km2, 其次为春季4.85 kg/km2, 秋季密度最低, 仅为2.52 kg/km2。综合春、秋、冬3个季节, 枪乌贼和双喙耳乌贼在黄海中南部水域资源密度最高(表2)。

表2 黄海中南部头足类资源密度Tab.2 The resources density of Cephalopoda in central and southern Yellow Sea
捕获头足类可分为 3大类, 分别为枪形目(Teuthoidea)(即鱿鱼类, 包括太平洋褶柔鱼、火枪乌贼、日本枪乌贼、剑尖枪乌贼(Loligo edulis)和多钩钩腕乌贼(Abralia ltihamata))、八腕目(Octopoda)(即章鱼类, 包括长蛸(Octopus variabilis)和短蛸(Octopus ocellatus))和乌贼目(Sepioidea)(即乌贼类, 包括乌贼属1种、曼氏无针乌贼(Sepiella maindroni)、针乌贼(Sepia esculenta)、金乌贼(Sepia esculenta)、双喙耳乌贼(Sepiola birostrata)和四盘耳乌贼(Euprymna morsei))。黄海中南部水域头足类生物量组成中, 春季以乌贼目和枪形目为主, 分别占总生物量的51.43%和 36.78%; 秋季以乌贼目和枪形目为主, 分别占 51.35%和 42.95%; 冬季以枪形目占绝对优势,占 81.79%; 综合 3个季节, 枪形目占头足类生物量的66.17%, 八腕目占8.07%, 乌贼目占25.75%(图2)。

图2 黄海中南部头足类生物量组成Fig.2 The biomass composition of Cephalopoda in central and southern Yellow Sea
黄海中南部水域头足类个体数组成中, 春季以乌贼目占绝对优势, 占总个体数的 90.04%; 秋季以枪形目和乌贼目为主, 分别占 50.71%和 45.78%; 冬季以乌贼目和枪形目为主, 分别占 57.01%和 42.67%;综合 3个季节, 枪形目占头足类个体数的 27.66%,八腕目占0.26%, 乌贼目占72.08%(图3)。

图3 黄海中南部头足类个体数组成Fig.3 The individual composition of Cephalopoda in central and southern Yellow Sea
2.3 空间分布
2.3.1 水平分布
由图4可以看出黄海中南部水域不同季节头足类的生物量分布状况。春季, 头足类主要分布在石东渔场与连东渔场交界水域和海州湾渔场东南部, 主要种类为双喙耳乌贼、枪乌贼及长蛸, 其中双喙耳乌贼比例最高, 占总生物量的 50.07%; 秋季, 头足类以连青石渔场西南部及大沙渔场北部密度最高, 主要以针乌贼及枪乌贼为主, 两者分别占头足类总生物量的 40.88%和 33.42%; 冬季, 头足类数量以石岛渔场东南部以及连青石渔场密度最高,主要以枪乌贼为主, 占头足类总生物量的68.20%。综合来看, 黄海中南部头足类生物量分布的季节变化较大。

图4 黄海中南部头足类生物量分布Fig.4 The biomass distribution of Cephalopoda in central and southern Yellow Sea
2.3.2 垂直分布
鉴于头足类不同季节栖息水深的变化, 研究了黄海中南部各季节头足类在各水深的生物量分布,考虑到太平洋褶柔鱼在生物量组成中的优势地位,将其单独列出进行统计分析。由表3可看出: 春季,头足类生物量的 47.0%分布在 60 m 以深水域; 其中,枪形目主要分布在60 m以深水域, 八腕目主要分布在20~40 m水深, 乌贼目主要分布在20~40 m水深。秋季,头足类生物量的 50.4%分布在 40~60 m 水深; 其中,93.1%的太平洋褶柔鱼分布在60 m以深水域, 其他枪形目主要分布在 40~60 m水深, 八腕目主要分布在16~40m水深, 乌贼目主要分布在40~60 m水深。冬季,65.1%的头足类分布在60 m以深; 其中, 太平洋褶柔鱼及其他枪形目绝大多数分布在60 m以深, 八腕目主要分布在15~40 m水深, 乌贼目主要分布在60 m以深。总体来看, 黄海中南部, 冬、春 2季头足类主要分布在60 m以深水域, 秋季头足类主要分布在40~60 m水深。

表3 头足类在不同水深的生物量组成Tab.3 The biomass composition of the Cephalopoda in different depth of water
2.4 生物多样性指数
黄海中南部头足类各季节生物多样性指数及标准差见表4。根据生物量, 黄海中南部头足类丰富度指数、均匀度指数及多样性指数均以冬季最高, 其次是春季, 秋季各项指数最低。根据个体数, 黄海中南部头足类丰富度指数、均匀度指数及多样性指数的季节变化趋势与根据生物量得出的结果一致, 冬季最高, 其次是春季, 秋季各项指数最低。利用One-Way ANOVA 程序中的 Tukey 检验, 分别根据生物量与个体数数据, 统计分析了黄海中南部头足类春、秋、冬季之间的变异程度。根据生物量, 春季与秋季、秋季与冬季的Margalef丰富度指数(D),以及春季与冬季的 Shannon-Wiener多样性指数(H')均呈显著性差异(P<0.05); 春季与秋季、秋季与冬季的Pielou均匀性指数(J')均呈极显著差异(P<0.01)。根据个体数, 春季与冬季的 Margalef丰富度指数呈显著性差异(P<0.05); 秋季与冬季的Pielou均匀性指数、春季与冬季以及秋季和冬季的Shannon-Wiener多样性指数均呈极显著差异(P<0.01)。

表4 黄海中南部头足类生物多样性指数Tab.4 Diversity index of Cephalopoda in central and southern Yellow Sea
2.5 群落结构季节变化
为了便于数据对比, 根据春、秋、冬3个季节共同站位的生物量及个体数资料, 利用 PRIMER软件中的Similarity程序分析了黄海中南部头足类的群落结构相似性, 并利用 ANOSIM程序对各季节进行相似性分析检验, 结果见表6。根据生物量, 以春季和冬季头足类群落结构相似性指数最高(66.77), 其次是春季和秋季(62.73), 秋季和冬季相似性指数最低(55.30); 各季节两两间差异性均显著(P<0.05)。 根据个体数, 同样以春、冬2季黄海中南部头足类的群落结构相似性指数最高(74.87), 其次是春季和秋季(69.83), 秋季和冬季相似性指数最低(65.15); 各季节两两间差异性均显著(P<0.05)。

表5 黄海中南部头足类多样性指数的季节差异显著性Tab.5 The significance level (p) of seasonal variation in diversity index of Cephalopoda in central and southern Yellow Sea

表6 黄海中南部头足类群落结构相似性指数Tab.6 Similarity index of Cephalopoda community between different seasons in central and southern Yellow Sea
3 讨论
3.1 与历史调查结果的比较
金显仕等[16]曾于 1998~2000年采用完全相同的方法对黄海中南部头足类资源进行了调查。表7对比了1998~2000年与2010~2011年春、秋、冬3个季节的调查结果, 与1998~2000年相比, 本次调查采集头足类种类数增加 5种, 资源密度增长了 12%。1998~2000年优势种类为枪乌贼及太平洋褶柔鱼,分别占头足类总生物量的 44.20%和 41.50%,2010~2011年枪乌贼的比重上升至 55.61%, 太平洋褶柔鱼的比重则下降至 10.40%, 耳乌贼的比重大幅上升至19.93%。

表7 2010~2011年与1998~2000年调查结果的对比Tab.7 Comparison of the survey results between 2010-2011 and 1998-2000
对比两次调查头足类生物量的分布状况: 春季,1998年5月以大沙渔场东北部密度较高, 而2010年5月以石东渔场与连东渔场交界水域和海州湾渔场东南部密度较高; 秋季, 2000年10月头足类主要集中在石东渔场、石岛渔场与连青石渔场的交界水域,2011年10月则以吕泗渔场及大沙渔场密度较高; 冬季, 1999年12月以石东渔场密度较高, 2011年1月则以石岛渔场东南部及连青石渔场密度较高。总体来看, 与1998~2000年同期对比, 本次调查黄海中南部春、秋、冬 3个季节头足类生物量的分布状况变化较大。
3.2 与其他海区的比较
本次调查, 2010年春季(5月)于黄海中南部共采集头足类8种, 其中以双喙耳乌贼(50.10%)和枪乌贼(34.02%)占绝大部分比重。吴强等[11]曾于同期(2010年 5月)对渤海和黄海北部水域进行调查, 于渤海、黄海北部捕获头足类均为5种; 其中, 渤海头足类以枪乌贼(47.97%)和短蛸(28.94%)占大部分生物量比重, 黄海北部头足类则以短蛸(73.16%)和枪乌贼(13.42%)占大部分比重。
本次调查于黄海中南部共采集头足类13种, 春季、秋季均以乌贼类比重最高, 冬季则以鱿鱼占绝大部分比重(图2)。宋海棠等[21-22]于1994年6月至1996年 5月曾逐月对东海北部的头足类做了调查研究,共采集头足类33种, 春(5月)、秋(10月)、冬(1月)3个季节均以乌贼类占大部分比重。综合看来, 黄海中南部头足类种类数明显少于东海北部; 黄海中南部以鱿鱼和乌贼类主要捕获对象, 而东海北部则以乌贼类为主要捕获对象。
3.3 国内外头足类群落结构的研究方法比较
相对于国内较普遍的基于拖网调查的头足类群落结构研究[23-25], 国外常采用大型捕食者胃含物分析的方法来研究头足类的种类组成及生物多样性[26-28]。例如: Staudinger[26]等研究了新英格兰近海、中大西洋湾及南大西洋湾顶级捕食者胃含物中的头足类种类组成及多样性, 发现南大西洋湾头足类多样性指数最高, 其次是新英格兰近海, 中大西洋湾最低;González[27]等利用搁浅哺乳动物胃含物中角质喙,确定了西班牙西北近海的头足类隶属9科、12种, 尾数组成中以枪乌贼科(Loliginidae)(56.9%)和章鱼科(Octopodidae)(25.3%)为主, 柔鱼科(Ommastrephinae)(11.9%)和耳乌贼科(Sepiolidae)(2.4%)的比例则较小;Velasco[28]等则通过胃含物分析研究了头足类作为被捕食者对底层鱼类的重要作用。综合对比, 作者认为基于拖网调查的头足类群落结构分析方法更直接,有利于如实地反映自然海域中头足类的群落结构;而胃含物分析法则更有利于认识头足类与大型捕食者摄食关系, 有利于认识头足类在生态系统能量流动中的重要作用。
[1] 苏纪兰, 袁业立.中国近海水文[M].北京: 海洋出版社, 2005: 193-206.
[2] 董正之.黄海太平洋褶柔鱼资源现状与开发[J].海洋科学, 1996, 20(6): 34-38.
[3] 宋海棠, 丁天明, 余匡军, 等.东海北部头足类的种类组成和数量分布[J].浙江海洋学院学报(自然科学版), 1999, 18(2): 99-106.
[4] 覃涛, 俞存根, 陈全震, 等.舟山渔场及邻近海域头足类种类组成和数量分布[J].海洋与湖沼, 2011, 42(1):124-130.
[5] 丁天明, 宋海棠.东海中北部海区头足类资源量的评估[J].水产学报, 2011, 25(3): 215-221.
[6] 凌建忠, 严利平, 李建生.应用资源密度面积法估算东海区头足类资源量[J].海洋渔业, 2008, 30(1): 56-61.
[7] 董正之, 吕荣书, 李永明.南海深海区头足类调查简报[J].海洋科学, 1982, 6(2): 45.
[8] 黄梓荣.南海北部陆架区头足类的种类组成和资源密度分布[J].南方水产, 2008, 4(5): 1-7.
[9] 吴耀泉.莱州湾主要无脊椎动物资源及其群聚多样性特征[J].海洋与湖沼, 1995, 26(6): 606-609.
[10] 程济生.黄海无脊椎动物资源结构及多样性[J].中国水产科学, 2005, 12(1): 68-75.
[11] 吴强, 王俊, 金显仕, 等.中国北部海域主要无脊椎动物群落结构及多样性[J].中国水产科学, 2011, 18(5):1152-1160.
[12] 国家技术监督局.GB/T 12763.2-1991.海洋调查规范—海洋生物调查[S].北京: 中国标准出版社, 1991.
[13] 董正之.中国动物志(软体动物门头足纲)[M].北京:科学出版社, 1988: 81-84.
[14] Pinkas L, Oliphamt M S, Iverson I L K.Food habits of albacore, bluefin tuna, and bonito in California waters [J].Calif Dep Fish Game Fish Bull, 1971, 152: 1-105.
[15] Aglen A, Foyn L, Godos O R, et al.Surveys of the marine fish resources of Peninsular Malaysia, June-July,1980[A].Bergen: Institue of Marine Research, 198l: 9:l-69.
[16] 金显仕, 赵宪勇, 孟田湘, 等.黄渤海生物资源与栖息环境[M].北京, 科学出版社, 2005: 369-379.
[17] Margalef R.Information theory in ecology [J].General System, 1958, 3: 36-71.
[18] Wilhm J L.Use of biomass units in Shannon's formula [J].Ecology, 1968, 49: 153-156.
[19] Pielou E C.Ecological Diversity [M].New York: Wiley,1975: 35-86.
[20] Simpson E H.Measurement of diversity [J].Nature,1949, 163: 688.
[21] 宋海棠, 余匡军.太平洋褶柔鱼在东海的分布和洄游[J].海洋水产科技, 1999, 1: 9-14.
[22] 宋海棠, 丁天明.东海北部头足类的种群组成和数量分布[J].浙江海洋学院学报(自然科学版), 1999,18(2): 99-105.
[23] 李成林, 张艳萍, 赵斌, 等.胶州湾曼氏无针乌贼资源量与季节变化的调查研究[J].渔业科学进展, 2009,30(3): 62-67.
[24] 俞存根, 虞聪达, 宁平, 等.浙江南部外海头足类种类组成和数量分布[J].海洋渔业, 2009, 31(1): 27-33.
[25] 陈强, 王家樵, 张雅芝, 等.福建闽江口及附近海域和厦门海域头足类种类组成的季节变化[J].海洋学报,2012, 34(3): 179-184.
[26] Staudinger M D, Juanes F, Salmon B, et al.The distribution, diversity, and importance of cephalopods in top predator diets from offshore habitats of the Northwest Atlantic Ocean [J].Deep Sea Research Part II:Topical Studies in Oceanography, 2013, 95: 182-192.
[27] González A F, López A, Guerra A, et al.Diets of marine mammals stranded on the northwestern Spanish Atlantic coast with special reference to Cephalopoda[J].Fisheries Research, 1994, 21(1-2): 179-191.
[28] Velasco F, Olaso I, Sánchez F.The role of cephalopods as forage for the demersal fish community in the southern Bay of Biscay[J].Fisheries Research, 2001,52(1-2): 65-77.

