腺苷注射液治疗胸部撞击后肺挫伤的作用机制
吴卫春张丽萍杜峰许坚梁治林伟王胜利
腺苷注射液治疗胸部撞击后肺挫伤的作用机制
吴卫春1张丽萍1杜峰1许坚1梁治1林伟1王胜利2
目的探讨腺苷注射液对撞击所致肺挫伤的治疗作用机制。方法选取30只健康日本大耳兔,随机分为对照组和腺苷注射液治疗组,每组15只。用BIM-Ⅱ型生物撞击机制备兔肺挫伤模型,分别于撞击前10min和撞击后1、3、5、7h采集颈总动脉血,采用硫代巴比妥酸(TBA)比色法检测丙二醛(MDA)浓度,ELASA试剂盒检测白介素-10(IL-10)浓度。于伤后7h取下兔右肺,采用比色法检测肺组织中髓过氧化物酶(MPO)含量,ELISA法检测支气管肺泡灌洗液(BALF)中肿瘤坏死因子α(TNF-α)含量,并测定肺泡表面活性物质水平。解剖并观察兔肺大体和显微病理学改变。结果对照组受伤后不同时间点的血浆MDA浓度、肺组织中MPO含量、BALF中TNF-α浓度和中性粒细胞弹性蛋白酶(NE)活性均较腺苷组显著升高(P<0.05或P<0.01),而腺苷治疗组血浆IL-10浓度和BALF中总磷脂(TPL)含量均较对照组明显升高(P<0.05或P<0.01)。对照组肺组织实变明显,肺泡结构破坏,大量中性粒细胞(PMNs)为主的炎症细胞及红细胞、血小板等聚集,相邻肺泡间质水肿增厚,线粒体肿胀空泡化,微绒毛和板层小体稀少;腺苷组肺泡结构基本正常,可见腺苷治疗组肺组织的病理损害明显较对照组减轻。结论腺苷注射液对肺挫伤有治疗作用,其机制可能与调节肺挫伤早期炎症因子浓度有关。
胸部损伤; 肺; 腺苷注射液
肺挫伤是指由于强大暴力作用于胸壁使胸腔容积缩小,增高的胸内压力压迫肺脏引起肺实质出血、水肿;外力消除后变形的胸廓回弹,在产生胸内负压的瞬间又导致原损伤区附加损伤[1],可发生于交通事故、高处坠落、胸部挤压伤等情况。肺挫伤后常引起低氧血症、肺水肿、肺出血、肺不张等并发症,除伤侧肺损伤外,还可引起对侧肺损害,如不及时有效地处理会发展成急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),直接威胁患者的生命。然而,临床上对肺挫伤的治疗尚缺乏有效的药物。目前,腺苷在心胸外科的应用仍是个热点问题。国内外在腺苷预处理对肺的保护作用方面已有较深入的研究[2],但腺苷后处理对肺的作用及其机制目前尚无研究。因此,本研究拟观察腺苷对肺挫伤的治疗作用,并探讨其可能机制,旨在为临床救治肺挫伤提供方法和实验依据。
材料与方法
一、动物分组及模型建立
健康日本大耳兔30只,雌雄不限,体重2.0~2.5kg,由温州医科大学实验动物中心提供(SYXK2013-0019),按随机数表法分为对照组(单纯撞击组)和腺苷治疗组(撞击加腺苷注射液干预组),每组15只,撞击后立即予等渗盐水经兔耳缘静脉静滴维持循环稳定7h,腺苷组于撞击后30min开始予腺苷针3mg/kg﹒h经耳缘静脉静滴(腺苷注射液由沈阳光大制药提供,准字号H20030320)。参照吴正国等[3]的方法用BIM-Ⅱ型水平式生物撞击机制备兔肺挫伤模型。将兔架直立,撞击兔右侧胸部,撞击点位于兔右侧第3、4肋间与腋中线交界处,设置撞击参数:采用准静态撞击,驱动压力为650kPa,撞击面积为4cm2,胸壁压缩3cm,撞击时相为吸气末。
二、标本采集与测定
分别于撞击前10min和撞击后1、3、5、7h采集兔颈总动脉血,检测丙二醛(malondialdehyde,MDA)和白介素-10(interleukin-10,IL-10)的含量。血清MDA含量测定采用硫代巴比妥酸(thiobarbituric acid,TBA)比色法;血清IL-10浓度采用ELISA试剂盒测定;于伤后7h取下右肺,取其中的0.1g肺组织采用比色法测定肺组织中髓过氧化物酶(myeloperoxidase,MPO)含量;按常规方法收集支气管肺泡灌洗液(brochoalveolar lavage fluid,BALF),ELISA试剂盒测定BALF中的肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)含量;测定肺泡表面活性物质水平,收集BALF,以2层无菌纱布过滤后以1 500r/min离心10min,分离出上清液,分装后置-20℃环境中保存待测定,测定总磷脂(total phospholipids,TPL)和中性粒细胞弹性蛋白酶(neutrophilelastase,NE)活性,所有试剂盒均购自上海西塘生物科技有限公司,具体操作按试剂盒说明进行。取兔右下肺1cm×1cm×1cm大小的组织进行光学显微镜(光镜)检查,根据随机数表法各取两组中8只兔肺进行电子显微镜(电镜)检查,观察肺组织的形态学改变。
三、统计学分析
采用SPSS 12.5软件进行统计学分析,计量数据以x珚±s表示,组内不同时相点两两比较采用单因素方差分析,组间相同时相点比较采用成组设计的两独立样本均数t检验,方差不齐时采用Dunnett’s T3检验,方差齐时采用LSD检验。P<0.05表示差异有统计学意义。
结 果
一、血浆MDA浓度的变化
受伤后对照组动物的血浆MDA浓度明显升高(F=7.95,P<0.01),到受伤后5h达峰值,以后缓慢下降,受伤后7h浓度仍然高于受伤前(F=6.85,P<0.01);腺苷治疗组血浆MDA浓度变化规律类似于对照组,但其浓度明显低于对照组,峰值也显著低于对照组(t=8.87,P<0.01),至伤后7h即降至受伤前水平(表1)。
二、血浆IL-10浓度的变化
对照组血浆IL-10浓度在受伤后逐渐降低,受伤后5h达最低值为(0.058±0.003)pg/ml(F=5.65,P<0.01),此后有所回升,但受伤后7h仍明显低于受伤前水平(F=6.15,P<0.01);腺苷组血浆IL-10浓度变化过程与对照组类似,但降低幅度明显较对照组小,受伤后7h已恢复到受伤前水平(P>0.05)(表2)。
三、肺组织中MPO和BALF中TNF-α、NE活性、TPL水平比较
腺苷治疗组肺组织MPO含量较对照组明显降低(t=3.86,P<0.01);BALF中NE活性和TNF-α浓度均较对照组显著降低(t=5.75,P<0.01;t=3.69,P<0.01),但TPL含量较对照组显著升高(t=6.45,P<0.01)(表3)
四、两组肺组织细胞形态学变化
对照组大体观察可见肺组织实变明显,表面有散在红色斑片,光镜下肺泡结构破坏,部分萎缩,大量中性粒细胞(polymorphonuclear cells,PMNs)为主的炎症细胞及红细胞、血小板等聚集(图1A);电镜下Ⅱ型细胞部分破坏,相邻肺泡间质水肿增厚,线粒体肿胀空泡化,微绒毛和板层小体稀少(图1B)。腺苷治疗组光镜下肺泡结构基本正常,PMNs减少(图2A);电镜下肺泡Ⅱ型细胞形态基本正常,肺泡壁薄,肺泡间隔轻度水肿,线粒体无明显肿胀,微绒毛较多,板层小体丰富(图2B)。
表1 两组兔血浆丙二醛(MDA)浓度的变化(珚±s,nmol/ml)
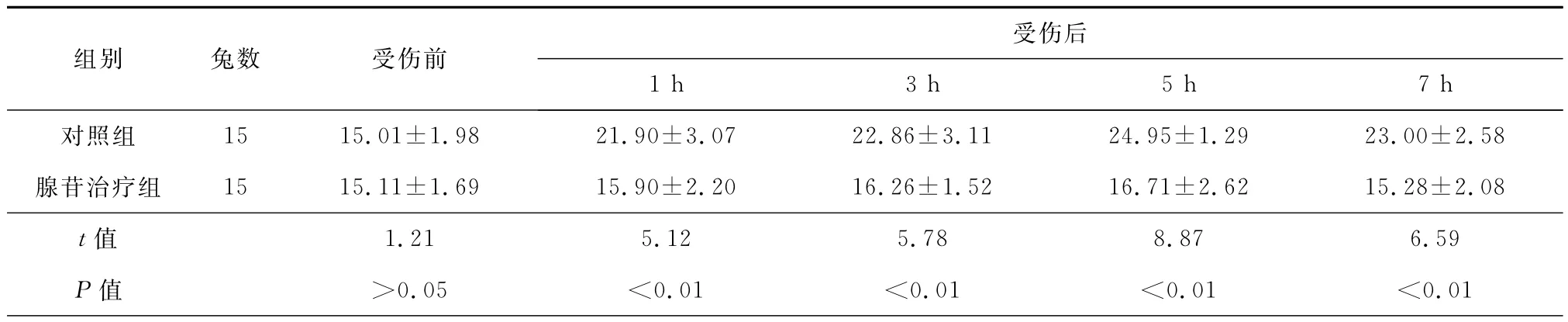
表1 两组兔血浆丙二醛(MDA)浓度的变化(珚±s,nmol/ml)
受伤后组别兔数受伤前.29 23.00±2.58腺苷治疗组15 15.11±1.69 15.90±2.20 16.26±1.52 16.71±2.62 15.28±2.08 t值1h3h5h7h对照组15 15.01±1.98 21.90±3.07 22.86±3.11 24.95±1 1.21 5.12 5.78 8.87 6.59 P值>0.05<0.01<0.01<0.01<0.01
表2 两组兔血浆白介素-10(IL-10)浓度的变化(珚±s,pg/ml)
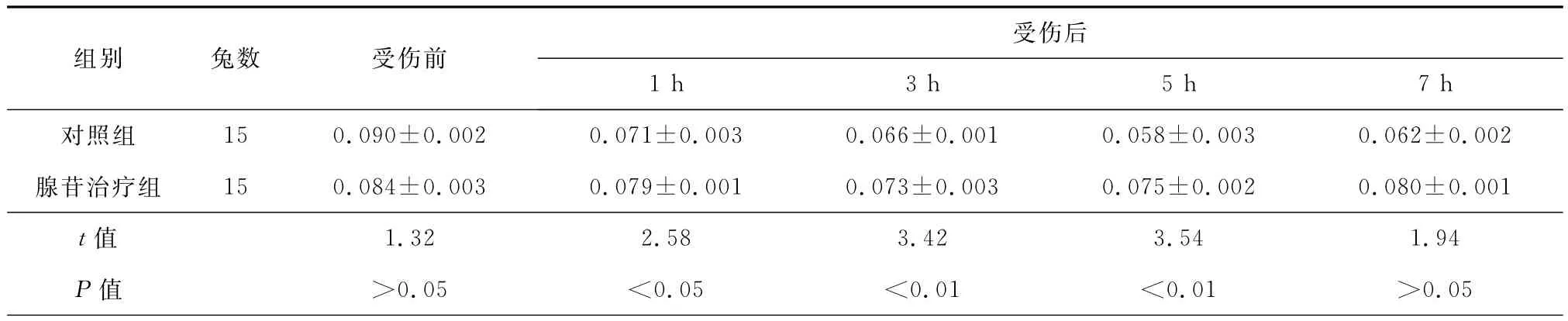
表2 两组兔血浆白介素-10(IL-10)浓度的变化(珚±s,pg/ml)
受伤后组别兔数受伤前8±0.003 0.062±0.002腺苷治疗组15 0.084±0.003 0.079±0.001 0.073±0.003 0.075±0.002 0.080±0.001 t值1h3h5h7h对照组15 0.090±0.002 0.071±0.003 0.066±0.001 0.05 1.32 2.58 3.42 3.54 1.94 P值>0.05<0.05<0.01<0.01>0.05
表3 两组兔肺组织指标比较(珚±s)

表3 两组兔肺组织指标比较(珚±s)
注:MPO表示髓过氧化物酶(myeloperoxidase),BALF表示支气管肺泡灌洗液(bronchalveor lavage fluid);TNF-α表示肿瘤坏死因子α(tumor necrosis factor-α);NE表示弹性蛋白酶(neutrophilelastase),TPL表示总磷脂(total phospholipids)
组别兔数MPO(IU/g)TNF-α(μg/L)NE(IU/ml)TPL(μg/g).71腺苷治疗组15 0.70±0.41 0.58±0.22 7.92±3.55 518.92±66.14 t值对照组15 1.25±0.69 1.12±0.45 15.11±4.37 235.58±43 0.01 3.86 3.69 5.75 6.45 P值<0.01<0.01<0.01<
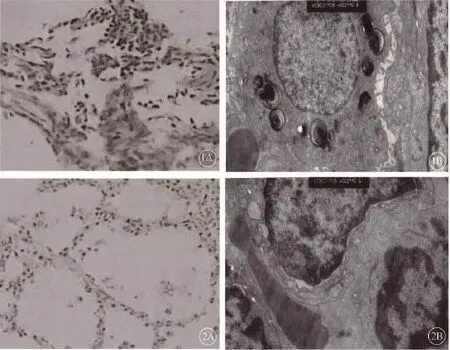
图1 对照组肺组织细胞改变。1A:光镜下观察,HE染色×100;1B:电镜下观察×10 000 图2 腺苷组肺组织细胞改变。2A:光镜下观察,HE染色×100;2B:电镜下观察×10 000
讨 论
目前胸部撞击后肺挫伤的机制尚不完全清楚。血浆MDA为自由基脂质过氧化的醛式产物,是脂质过氧化代谢的主要中间产物,其醛基能与血管内皮、神经元等细胞生物膜磷脂中的氨基组分发生交联聚合反应,使生物膜的结构和功能发生改变,引起膜通透性增加、膜上的Na+-K+-ATP酶失活、线粒体功能障碍等,从而导致细胞内Ca2+超载,并激发自由基链式反应,形成恶性循环。本研究用硫代巴比妥酸比色法测定MDA含量,不仅反映了氧自由基生成与否及其清除情况,还反映出氧自由基造成组织损伤的严重程度。血浆IL-10是一种抗炎症细胞因子,具有很强的抗感染作用,可以抑制某些因子如IFN-γ、IL-1-β、IL-2、TNF-α等的合成及活性,降低它们各自的mRNA水平和黏附分子的表达[4];同时它又对抗炎症物质如IL-1Ra具有正向调节作用,提高它的浓度和活性。MPO是PMNs胞质中的一种特异性酶,肺组织中MPO活性的变化可反映PMNs在肺组织的聚集程度,它标志着PMNs的活化和聚集。“呼吸爆发”是激活的PMNs释放氧自由基的方式,释放的氧自由基引起肺组织脂质过氧化损伤,同时释放弹性蛋白酶、溶酶体酶等损伤和破坏肺组织结构导致肺水肿。TNF-α由单核巨噬细胞、T细胞释放,它是一种具有广泛生物学效应的细胞因子,能参与体内多种疾病的发生和发展。TNF-α可以引起体内一系列的病理反应,如诱导PMNs的“呼吸爆发”;刺激多种细胞因子的生成、释放,参与到肺水肿的形成;表达细胞黏附分子,激活白细胞黏附活性[5]。Rajamani等[6]通过对肺挫伤患者的BALF分析,发现肺挫伤导致肺泡Ⅱ型上皮细胞生成和分泌的表面活性物质减少;同时以TNF-α为主的肺泡内的炎性因子使表面活性物质降解加速。PS的减少和呼吸道内分泌物的阻塞促使肺不张的发生。肺不张一方面影响肺的通气换气功能,另一方面又进一步加重肺部炎症反应,并形成恶性循环,加重肺损伤。
外源性腺苷不是作为能量底物发挥作用,而主要作用于腺苷受体,其可能的机制为:①抑制PMNs、内皮细胞及其相互作用:国外有人发现,腺苷可以抑制内皮细胞凋亡[7],而且腺苷可抑制PMNs的CD11/CD18表达和抑制血小板活化因子[8]。②减轻细胞内钙超载:腺苷激活A1受体,开放ATP敏感性钾通道(ATP-sensitive potassium channel,KATP),通过电压依赖性Ca2+通道,降低Ca2+内流,保护细胞内ATP[9],该作用可被KATP通道阻滞剂所阻断[10]足以证明这一点。③腺苷可以有效恢复高能磷酸储备。④腺苷还可以抑制血小板的聚集,防止血栓的形成:有人通过体外实验证实腺苷能降低ADP诱导的血小板聚集,抑制血栓烷素A2的释放,从而保护内皮细胞的结构和功能,并且通过降低细胞内Ca2+浓度,抑制Ca2+诱发的血小板聚集。⑤腺苷的抗氧化作用:Rupprecht等[11]通过实验发现腺苷对氧自由基有显著的抑制作用,比如,腺苷可通过腺苷A2受体使PMNs产生的超氧阴离子减少。
本研究结果显示,胸部撞击致肺挫伤早期,对照组血浆MDA浓度、肺组织中MPO含量以及BALF中TNF-α浓度、NE活性较腺苷治疗组显著升高,而腺苷治疗组血浆IL-10浓度和BALF中TPL含量较对照组明显高,同时腺苷治疗组肺组织的病理损害明显较对照组减轻。提示胸部撞击后血浆MDA、肺组织中MPO、BALF中TNF-α浓度和NE活性升高,以及血浆IL-10浓度、BALF中TPL含量下降都可能加重肺挫伤,而腺苷可以通过调节它们的浓度变化来减轻胸部撞击后继发的肺损伤。
1 王正国.我国道路交通伤的现状[J],中华创伤杂志,2000,16(4):200-201.
2 刘勇,贺春熙.腺苷预处理对小儿体外循外肺损伤的保护作用[J].医学研究杂志,2012,41(5):77-79.
3 吴正国,梁贵友,李正勋,等.参芪扶正注射液对心肌挫伤后家兔心肌细胞凋亡的影响[J].第三军医大学学报,2007,29(7):588-591.
4 Avdic S,Cao JZ,McSharry BP,et al.Human cytomegalovirus interleukin-10polarizes monocytes toward a deactivated M2c phenotype to repress host immune responses[J].J Virol,2013,87(18):10273-10282.
5 Vinokurov M,Ostrov V,Yurinskaya M,et al.Recombinant human Hsp70protects against lipoteichoic acid-induced inflammation manifestations at the cellular and organismal levels[J].Cell Stress Chaperones,2012,17(1):89-101.
6 El-Awady MS,Rajamani U,Teng B,et al.Evidence for the involvement of NADPH oxidase in adenosine receptors-mediated control of coronary flow using A1and A3knockout mice.[J].Physiol Rep,2013,1(3):163-170.
7 Zhao ZQ,Nakamura M,Wang NP,et al.Administration of adenosine during reperfusionreduces injury of vascular endothelium and death of myocytes[J].Coron Artery Dis,1999,10(8):617-628.
8 Kaji W,Tanaka S,Tsukimoto M,et al.Adenosine A(2B)receptor antagonist PSB603suppresses tumor growth and metastasis by inhibiting induction of regulatory T cells[J].J Toxicol Sci,2014,39(2):191-8.
9 Lochner A,Marais E,Huisamen B,et al.Protection of the ischaemic heart:investigations into the phenomenon of ischaemic preconditioning[J].Cardiovasc J Afr,2009,20(1):43-51.
10 G Kounis N,Soufras GD,Tsigkas G,et al.Adverse cardiac events to monoclonal antibodies used for cancer therapy:The risk of Kounis syndrome[J].Oncoimmunology,2014,14(3):e27987.
11 Rupprecht H,Ghidau M.Penetrating nail-gun injury of the heart managed by adenosine-induced asystole in the absence of a heart-lung machine.[J].Tex Heart Inst J,2014,41(4):429-432.
Mechanism of adenosine injection in treatment of lung contusion following chest impact
Wu Weichun1,Zhang Liping1,Du Feng1,Xu Jian1,Liang Zhi1,Lin Wei1,Wang Shengli2.
1Department of Cardiothoracic Surgery,Yuhang Hospital,Hangzhou Normal University College of Medicine,Hangzhou 311100,China;2Department of Cardiothoracic Surgery,the Second Affiliated Hospital of Wenzhou Medical University,Wenzhou 325035,China
Wu Weichun,Email:zjwuweichun@163.com
ObjectiveTo investigate the mechanism of adenosine injection in treatment of lung contusion following chest impact.MethodsThirty healthy Japanese big-ear rabbits were randomly assigned to control groupand adenosine injection treatment group,with 15rabbits in each group.The lung contusion model was prepared by BIM-Ⅱbioimpact machine.Blood samples were taken from common carotid artery 10min before impact and 1h,3h,5hand 7hafter impact,the plasma concentrations of malondialdehyde(MDA)were measured by thiobarbituric acid(TBA)method,and the levels of interleukin-10(IL-10)were determined by ELISA.The right lungs of rabbits were obtained 7h after injury,the contents of myeloperoxidase(MPO)in lung tissues were decected by colorimetric assay,the concentrations of tumor necrosis factorα(TNF-α)in bronchoalveolar lavage fluid(BALF)were examined by ELISA,and levels of alveolus surface active substance were also determined.The gross and microscopic appearance was observed.ResultsThe concentration of plasma MDA,content of MPO in lung tissues,concentrations of TNF-αand activity of neutrophil elastase(NE)in BALF in control group were significantly higher than those in adenosine injection treatment group(P<0.05or P<0.01).However,the plasma concentration of IL-10and content of total phospholipids(TPL)in BALF in adenosine injection treatment group were significantly higher than those in control group(P<0.05or P<0.01).The morphological observation found serious lung consolidation in control group,with damaged alveolar structure and congregation of large amount of inflammatory cells,red blood cells and blood platelets,while revealed almost normal alveolar structure in adenosine injection treatment group,which indicated that the injury in adenosine injection treatment group was less severe than that in control group.ConclusionsAdenosine injection has a therapeutic effect onlung contusion,the mechanism of which may be related to the regulation of inflammatory factors in the early stage of lung contusion.
Thoracic injury;Lung;Adenosine injection
2015-05-12)
(本文编辑:周珠凤)
10.3877/cma.j.issn.2095-8773.2015.03.012
杭州市卫生科技计划资助项目(2012B029)
311100 浙江大学医学院附属第二医院余杭分院,余杭第一人民医院心胸外科1;325035 温州医科大学附属第二医院心胸外科2
吴卫春,Email:zjwuweichun@163.com
吴卫春,张丽萍,杜峰,等.腺苷注射液治疗胸部撞击后肺挫伤的的作用机制[J/CD].中华胸部外科电子杂志,2015,2(3):197-201.

