添食氟化物后家蚕中肠和血液中氟离子的吸收累积规律*
米 智 徐 水 朱 勇
(1.西南大学生物技术学院,重庆 400716;2.山西大同大学生命科学学院,山西 大同 037009)
添食氟化物后家蚕中肠和血液中氟离子的吸收累积规律*
米 智1,2徐 水1朱 勇1
(1.西南大学生物技术学院,重庆 400716;2.山西大同大学生命科学学院,山西 大同 037009)
为了探讨氟离子在家蚕中肠和血液中的吸收累积情况,以家蚕耐氟品种T6和氟化物敏感品种734为研究材料,从5龄起蚕开始分别添食经50、100、200、400mg/kg NaF溶液浸泡后的新鲜桑叶,检测家蚕血液和中肠中氟离子浓度的变化规律。结果表明,不论是敏感品种734还是耐氟品种T6,均表现为随添氟浓度增大氟离子浓度呈增大的趋势,在中肠中,734添氟组氟离子浓度分别是对照组的1.29,1.39,1.63,2.41倍,T6分别为1.30,1.43,1.75,2.41倍;在血液中,734添氟组氟离子浓度分别是对照组的1.17,1.34,1.69,1.97倍,T6分别为1.17,1.21,1.28,1.43倍。推测耐氟品种家蚕T6中肠代谢或排泄氟离子的能力强于敏感品种家蚕734。
家蚕;血液;中肠;氟离子;吸收累积
近年来随着工业的发展,陶瓷、砖瓦、磷肥、炼铝、水泥、玻璃、火力发电等部门排放的废气中含有大量氟化物,给蚕桑生产带来较大的危害。氟化物是一类原生质毒剂,易透过各种组织的细胞壁与原生质结合产生毒性效应[1-2]。研究表明,氟化物随桑叶进入蚕体累积于消化液、肠壁和体壁等处,通过消化管进入血液,在血液和组织中与蛋白质结合,抑制生长发育,出现氟中毒症状[3]。
氟离子测定方法常用的有氟离子选择电极法、高温灰化—碱融法、湿灰化—气体吸收法等[4-5]。其中氟离子电极法,具有简便、快捷、准确等优点,完全可以应用于多样品实验中的氟离子含量测定。其余方法程序复杂,测定成本高,所需时间长。对于蚕桑业中氟化物污染程度的鉴定,要求快速、便捷、准确,氟离子选择电极法更为适合。
氟离子选择电极检测方法采用标准曲线法[6-7]:即置电极于一系列的标准液中,测定标准液的电极电位。标准液的范围应包括预计样品溶液的浓度,然后测量样品溶液的电极电位。在对半数坐标纸上绘制标准曲线,标准溶液的浓度对数值(横坐标)与相应的电极电位(纵坐标)。通过标准曲线的方程,求得样品溶液的氟离子浓度。用标准曲线法测定时,测定液的pH值应在5~6左右,因为氟离子选择电极一般以pH在5~6之间测定值较为准确。
本实验在已知家蚕耐氟性的前提下,检测不同组织中氟离子浓度,以期探明氟离子在不同组织中的累积情况。
1 材料与方法
1.1 实验材料
家蚕耐氟品种T6、敏感品种734,由中国农业科学院蚕业研究所提供,西南大学家蚕遗传育种室保存。按照常规方法饲养到5龄起蚕时,将家蚕分区饲养。对照组喂食清水浸泡11min后自然晾干的新鲜桑叶,试验组分别用50、100、200、400mg/kg NaF溶液浸泡11min后自然晾干的桑叶饲养[8],每隔8h添食1次,每天添食3次。试验采用平行设计,每组设3个重复。从5龄起蚕第1~7d每天分别在冰盘上取各组幼虫的组织样品。
1.2 样品处理
①将蚕体体表用蒸馏水清洗干净,并用吸水纸擦干,使蚕体弯曲,用无菌剪刀剪其腹足使血液滴于事先放置在冰上的离心管中,取0.5mL用作测试样品;
②将蚕体置于冰盘上解剖,小心取出中肠,去掉中肠的内容物,用0.9%生理盐水冲洗干净;
③取10头家蚕中肠,加入5mL 0.04M pH7.0的PBS进行匀浆,取1mL作为测试样品。
④将测试样品置于50mL容量瓶中,加10mL盐酸,密闭浸泡提取1h(不时轻轻摇动),应量避免样品粘于瓶壁上。提取后加25mL总离子强度缓冲剂,加水至刻度,混匀,测定。
1.3 试剂和药品
本实验所用水均为超纯水,试剂全部贮于聚乙烯塑料瓶中。氟化钠(NaF)需经95~105℃干燥4h后冷却(至恒重)使用。浓盐酸(HCl),乙酸钠(CH3COONa·3H2O),柠檬酸钠(Na3C6H5O7·2H2O),乙酸(CH3COOH),氢氧化钠(NaOH),高氯酸(HClO4),氯化钠(NaCl)均由科隆化工有限公司。
1.4 仪器与设备
PHS-3C型精密酸度计(成都世纪方舟科技有限公司),PF-1型氟离子选择性电极(上海精密科学仪器有限公司),雷磁232型参比电极(上海雷磁仪器厂),78-1型磁力加热搅拌器(金坛市富华仪器有限公司),纯水仪(德国millipor-DQ3)。
1.5 试剂配制
①1mol/L盐酸:取10mL浓盐酸,超纯水稀释,定容至120mL;
②1mol/L乙酸:准确量取57.23mL冰乙酸,超纯水稀释,定容至1 000mL;
③3mol/L乙酸钠溶液:称取204g乙酸钠(CH3COONa·3H2O)溶于300mL水中,加1mol/L乙酸,调节pH至7.0,超纯水稀释,定容至500mL;
④0.75mol/L柠檬酸钠溶液:称取110g柠檬酸钠(Na3C6H5O7·2H2O)溶于300mL水中,加14mL高氯酸,再加水稀释,定容至500mL;
⑤总离子强度缓冲剂:3mol/L乙酸钠溶液与0.75mol/L柠檬酸钠溶液等量混合,现配现用;
⑥氟标准溶液:准确称取0.22g氟化钠,溶于水,移入100mL容量瓶中,加水至刻度,混匀,置冰箱中保存;
⑦氟标准使用液:吸取10.0mL氟标准溶液置于100mL容量瓶中,加水稀释至刻度。如此反复稀释此溶液至氟离子浓度为1.0μg/mL。
1.6 实验方法
1.6.1 绘制氟离子标准曲线
①接通酸度计电源,预热20min;
②将酸度计按键选择置“mv”位置,此时仪器显示应为0.00;
③取下饱和甘汞电极下端和上端小胶帽,检查电极内液位、晶体气泡及多孔型物质的渗漏情况;
④若都合格,则用蒸馏水清洗电极外部,用滤纸吸干外壁水分,若不合格,则加入饱和的KCl,以满足电极需要;
⑤取出已在10~3mol/L的NaF溶液中浸泡活化2h以上的氟离子电极;
⑥检查电极晶片内侧是否有气泡。若有,应让电极下端晶片朝上,轻击电极杆以赶出气泡;
⑦将饱和甘汞电极和氟离子电极分别置于电极夹上,并接入仪器;
⑧取6个洁净的50mL容量瓶,分别加入10μg/mL氟标准液0.0、0.5、1.0、2.0、3.0、4.0mL,并在各容量瓶中分别加入总离子强度调节缓冲剂25mL和1mol/L盐酸10mL,用蒸馏水稀释至标线后混匀,并依次由1到6编号;
⑨取一洁净的50mL小烧杯,装上40mL蒸馏水并放在电磁搅拌器托座上,插入两电极。开启电磁搅拌器,调节电磁搅拌器转速;
⑩观察仪器上的电位值,若数值接近370mv,说明氟电极已清洗好;如果相差甚远,应重换蒸馏水,再洗直至显示值与370mv电位值相近;
1.6.2 样品测定与分析
实验方法与测定标准曲线相同。试验数据使用Excel软件进行作图,并做标准误差分析。
2 结果与分析
2.1 氟离子浓度标准曲线
根据已知氟离子浓度的检测结果,纵坐标为“MV”的绝对值,横坐标为氟离子浓度对数值,绘制标准曲线。得到回归方程式y=33.53x+238,相关系数R2=0.998。
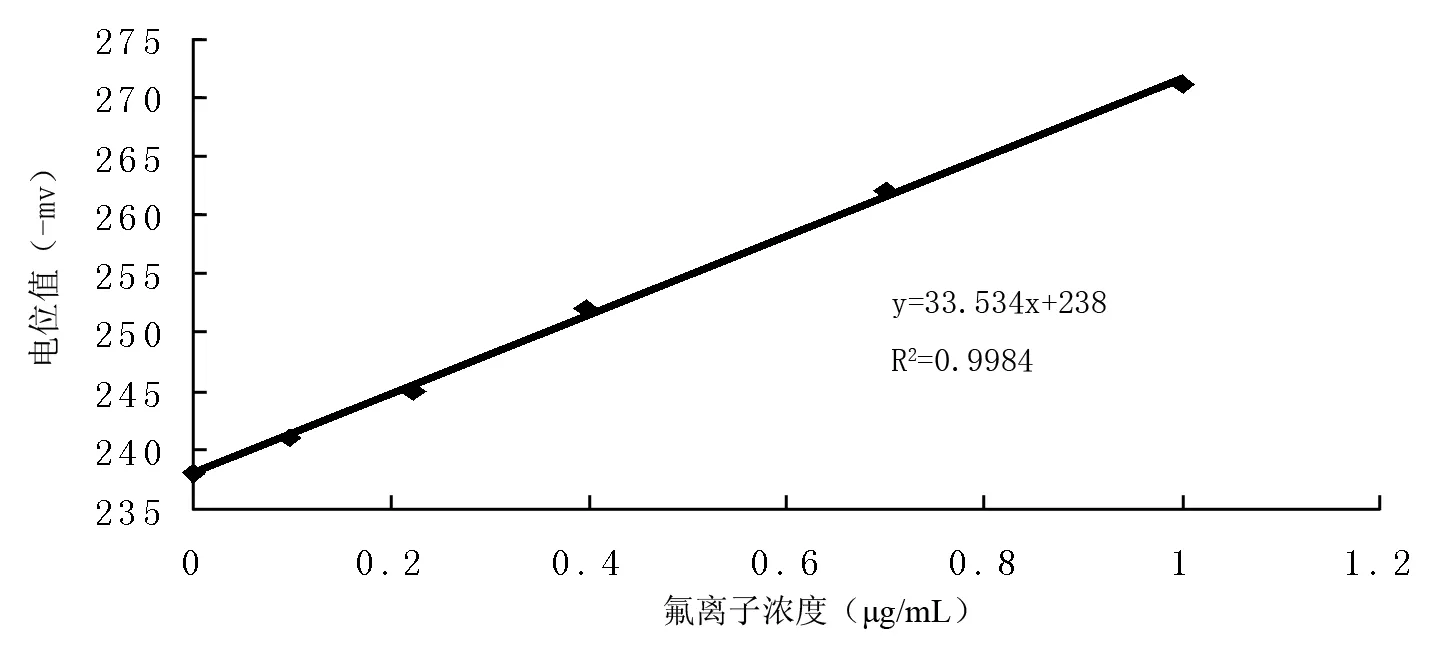
图1 氟离子浓度标准曲线
2.2 不同组织中氟离子浓度变化
2.2.1 中肠中氟离子浓度变化
从图2、图3可以看到:734对照组中肠氟离子浓度在前2d呈上升趋势,之后呈下降。第3d和第4d的氟离子含量基本相同,第5d含量略上升,随后下降,第6d和7d又相当,整个试验期出现2个极大值,即第2d和第5d;50、100、200mg/kg NaF处理组的氟离子浓度变化趋势基本同对照组一致,50mg/kg NaF处理组和100mg/kg NaF处理组在整个试验期氟离子浓度相似,仅在第1d含量略有差异,400mg/kg NaF处理组前3d呈上升趋势,后4d也呈上升趋势,在整个实验期出现2个极小值,即第1d和第4d。从整个图上可以看到,中肠氟离子浓度是随着添氟浓度的增大,呈增大的变化趋势,尤其400mg/kg NaF处理组(第1d除外),氟离子浓度远大于其它各组。
T6对照组中肠氟离子浓度变化较平稳,在0.05~0.09μg/mL之间波动,前2d的浓度略高于其它时间段;50mg/kg NaF处理组的氟离子浓度在第5d有个上升的峰值,其余时间呈平缓的下降趋势;100mg/kg NaF处理组前3d氟离子浓度相同,之后在0.1μg/mL上下波动;200mg/kg NaF处理组的氟离子浓度在前3d呈下降趋势,随后先升后降,第5d含量达最大值;400mg/kg NaF处理组呈波折型变化趋势,整个试验期(除第6d外)氟离子浓度远大于其他处理组。
不论734还是T6,随着添氟浓度的增加,中肠中氟离子浓度随之增大。734添氟组氟离子平均浓度分别约为对照组的1.29,1.39,1.63,2.41倍,T6分别越为1.30,1.43,1.75,2.41倍。
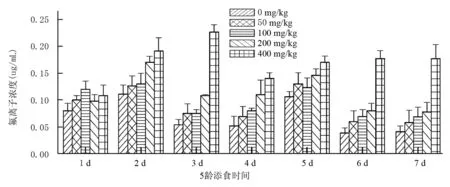
图2 5龄家蚕734幼虫添食NaF后中肠氟离子浓度变化
2.2.2 血液中氟离子浓度变化
从图4、图5可以看到:734各个处理组氟离子浓度变化趋势较一致,前6d呈先降后升的趋势,在第7d又下降。添氟处理第1d氟离子浓度关系为:400mg/kg NaF处理组>100mg/kg NaF处理组>200mg/kg NaF处理组>50mg/kg NaF处理组>0mg/kg NaF处理组,添氟处理第6d氟离子浓度关系为:400mg/kg NaF处理组≈100mg/kg NaF处理组>200mg/kg NaF处理组≈50mg/kg NaF处理组>0mg/kg NaF处理组,其余时间段均随着添氟浓度的增加,血液中的氟离子浓度呈增加的趋势。
T6各处理组(400mg/kg NaF处理组除外)血液氟离子浓度变化趋势同734一致,但比734平缓;400mg/kg NaF处理组的氟离子浓度在前5d在0.35μg/mL上下波动,之后同其余各处理组;添氟处理第1d氟离子浓度关系为:50mg/kg NaF处理组>100mg/kg NaF处理组>200mg/kg NaF处理组≈400mg/kg NaF处理组≈对照组,其余时间段均随着添氟浓度的增加,血液中的氟离子浓度也呈增加趋势。
不论734还是T6,随着添氟浓度的增加,血液中氟离子浓度随之增大。734添氟组氟离子平均浓度分别约为对照组的1.17,1.34,1.69,1.97倍,T6分别越为1.17,1.21,1.28,1.43倍。
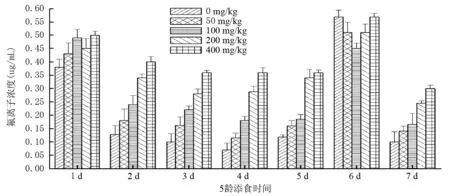
图4 5龄家蚕734幼虫添食NaF后血液氟离子浓度变化
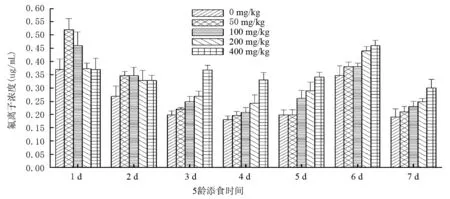
图5 5龄家蚕T6幼虫添食NaF后血液氟离子浓度变化
3 讨论与结论
不同家蚕品种对氟化物的耐受性能不同,给家蚕添食经氟化钠溶液浸泡后的桑叶,氟离子会在家蚕体内不同组织中累积。氟化物是一类原生质毒剂,主要毒理作用属于胃毒,作用对象有消化、呼吸、神经、循环等系统。氟化物随桑叶进入蚕体被消化吸收,通过消化管进入血液,部分从粪便中排出,而大部分累积于肠壁和体壁等处,并以离子形式作用于细胞原生质[3]。故对家蚕而言,消化系统中肠则为氟攻击的首要靶标器官,中肠受到损伤,其钙镁离子,酶活性,糖类,脂肪,以及核酸物质等生物大分子均发生了变化或者造成了不可逆的改变。家蚕体内又是开放性系统,血液在传输物质方面起到了不可代替的作用,氟离子也会对家蚕血淋巴造成巨大的损害。本实验对不同耐氟性家蚕品种添食NaF,检测7d内不同浓度NaF处理后中肠氟离子的平均浓度,随着氟化物浓度的增加,与对照组相比,734添氟组从1.29倍增加到2.42倍,T6从1.30倍增加到2.41倍。在血液中,734的平均浓度由1.17倍增加到1.97倍,而T6从1.18倍增加到1.43倍。
从测定的数据分析,在上述2个不同组织中既表现出了相同点,也具有差异点。相同点是,不管是氟化物敏感品种734还是耐氟品种T6,不管是中肠还是血液,其氟离子浓度均随着添氟浓度的增加呈上升趋势。不同点是:通过上述数据比较可得,添氟处理后734和T6两家蚕品种中肠中氟离子相对累积浓度基本一致;而在血液中,734随着NaF浓度的增大,与对照组相比,添氟组的平均氟离子浓度由1.17倍增加到1.97倍,T6由1.18倍增加到1.43倍。
添氟浓度为50和100mg/kg处理后2品种的氟离子相对累积浓度差异不大,但添氟浓度为200和400mg/kg处理后的氟离子相对累积浓度,734显著大于T6的。由上述数据可推测,在高浓度氟化物处理下,T6代谢或排泄氟离子的能力远强于734,因此734血液中氟离子浓度累积相对较大。
[1] Anuradha C D,Kanno S,Hirano S. Oxidative damage tomitiochondria is a preliminary step to caspase-3 activation influoride-induced apoptosis in HL-60 cells[J]. Free Radic Biol Med,2001,31(3):367-373.
[2] Zhang M,Wang A G,He W H,etal. Effects of fluoride on the expression of NCAM,oxidative stress,and apoptosis in primary cultured hippocampal neurons[J]. Toxicology,2007,236:208-216.
[3] 黄君霆,朱万民,夏建国,等.中国蚕丝大全[M].成都:四川科学技术出版社,1996:462-467.
[4] 屈德明,于淮堂,刘友丽.蚕桑氟污染灾害及其防减灾对策探讨[J].江苏蚕业,1999,3:38-39.
[5] 刘超,吴方正.茶叶中的氟含量及测定方法研究[J].农业环境保护,1998,17(3):132-135.
[6] GB8372-2008,中华人民共和国国家标准(牙膏)[S].北京:国家质检总局和国家标准化委员会,2008.
[7] 刘源,叶平,边建朝.酸解消化扩散法用于牛血清氟标准物总氟的测定[J].地方病通报,2002,17(1):15-16.
[8] 黄玲莉,韦博尤,蒙艺英.氟化钠溶液浸泡时间对桑叶含氟浓度变化的试验[J].广西蚕业,2005,42(004):5-7.
Absorption and Accumulation of Fluoride Ion in the Hemolymph and the Midgut ofBombyxmoriAfter Feeding with Fluoride
MI Zhi1,2*XU Shui1ZHU Yong1
(1.CollegeofBiotechnology,SouthwestUniversity,Chongqing400716,China;2.CollegeofLifeScience,DatongUniversity,Datong,Shanxi037009,China)
In order to understand the absorption and accumulation of fluoride ion in the hemolymph and the midgut of silkworm (Bombyxmori), the fluoride-resistant silkworm variety T6 and the fluoride-sensitive variety 734 were used as study materials, and their larvae were fed with mulberry leaves soaked in 50, 100, 200 or 400 mg/kg NaF solutions from the first day of the fifth instar. Then the fluoride ion concentration in the hemolymph and the midgut were examined. The results showed that the fluoride ion concentration in the hemolymph and the midgut increased with increasing fluoride added in both varieties. In the midgut, the fluoride ion concentration of the NaF-treated group of 734 was 1.29, 1.39, 1.63 and 2.41 times that of the control group, and 1.30, 1.43, 1.75 and 2.41 times that of the control group, respectively. In the hemolymph, the fluoride ion concentration of the NaF-treated group of 734 was 1.17, 1.34, 1.69 and 1.97 times that of the control group, and 1.17, 1.21, 1.28 and 1.43 times that of the control group, respectively. It is speculated that the ability of T6 to metabolize or excrete fluoride in the midgut is stronger than that of 734.
Bombyxmori; hemolymph; midgut; fluoride ion; absorption and accumulation
*资助项目:重庆市“十百千万”优质蚕茧工程公共项目; 山西大同大学博士科研启动项目。
米 智(1985-),男,山西,博士研究生,主要从事家蚕遗传育种研究,E-mail:mizhi775@126.com通讯作者:朱 勇,教授,博士生导师。Tel:023-68251939,E-mail: zhuy@swu.edu.cn

