Cry2Aa 毒素结合十二肽的筛选与鉴定
武爱华, 张 霄, 刘 媛, 赵 扬, 赵岩岩, 张存政, 谢雅晶, 刘贤金
(1.江苏省农业科学院食品质量安全与检测研究所/农业部食品质量安全监控重点开放实验室,江苏 南京210014; 2.南京农业大学植物保护学院,江苏 南京210095)
苏云金芽胞杆菌( Bacillus thuringiensis,Bt) 是一种革兰氏阳性( G+) 细菌,是目前产量最大、使用最广的生物杀虫剂[1]。近年来,随着转Bt 作物在全球大规模商品化种植,使得其存在潜在的生态风险。目标害虫对药物产生耐受性,杀虫基因逃逸污染环境,生物多样性下降以及对非目标生物的间接危害风险和破坏生态平衡等[2-6]。因此建立适当的检测方法对于转基因产品成分快速鉴定与检测,促进转基因产品安全管理、市场监管和风险评估具有重要的研究意义。
近年来,随着基因工程抗体及噬菌体展示技术的兴起,利用噬菌体展示技术筛选并建立针对Bt 毒素免疫检测方法已有很多报道。张霄、王耘等利用人源化噬菌体单链抗体库筛选获得针对Bt 毒蛋白的单链抗体( scFv) ,进而建立免疫学分析方法[7-8],但是噬菌体抗体库抗体多数是Fab 片段或scFv 抗体,对抗体的亲和力有一定的影响。随着噬菌体展示肽库技术的不断改进和完善,其在生命科学的众多领域得到了广泛应用,在免疫分析中的应用主要表现在模拟表位筛选、抗免疫复合体筛选及基于噬菌体展示多肽的特点建立的新免疫分析方法[9]。Renrong Liu 等从七肽库中筛选与OTA( 赭曲霉毒素A) 相竞争的多肽,建立竞争ELISA( Enzyme-linked immunosorbent assay) 方法检测谷物中的OTA,并与传统检测方法相比较,结果显示检出数值差异不显著,且与其类似物之间的交叉反应率低于0.01%,说明肽库筛选特异性好,且亲和性高[10]。在Bt 蛋白方面,已有李利红等从七肽库中筛选与Bt 蛋白结合的多肽,运用于转基因植物中Bt 蛋白的辅助检测[11]。
目前已发现的cry2 类基因有52 个,其编码的蛋白大小约为70 000[12],其中以cry2Aa 的应用和研究较多[13-17]。本研究拟通过噬菌体肽库固相筛选,获得特异性结合Cry2Aa 的十二肽,建立新的检测方法,应用于抗虫转基因植物中Bt 蛋白的检测领域。
1 材料与方法
1.1 材料
Cry2Aa 毒素蛋白标准品,购于上海佑隆生物科技有限公司;噬菌体随机十二肽库( Ph.D.-12 library,库容1.9×109) 、受体菌Escherichia coli ER 2738 以及-96 gⅢ测序引物: 5'-HOCCCTCATAGTTAGCGTAACG-3',购于New England Biolabs;HRP-抗M13 单克隆抗体购于Pharmacia 公司; 牛血清白蛋白( BSA) 、四环素( Tetracycline) 、异丙基-β-D-硫代吡喃半乳糖苷( IPTG) 及Xgal 购于SIGMA 公司; Cry2Aa 多抗( PAb-Cry2Aa) 为免疫新西兰纯种雄性大白兔获得。
1.2 以Cry2Aa 筛选噬菌体十二肽库
1.2.1 固相亲和筛选策略 ①用包被液( pH =8. 6,0. 1 mol/L的NaHCO3) 稀释Cry2Aa 毒素蛋白至浓度100 μg/ml,取1 ml 包被6 孔无菌酶联免疫板,用封口膜封口,4 ℃,20 r/min震荡过夜进行包被; ②次日弃去包被液,加入4 ml 封闭液( 0. 1 mol/L 的NaHCO3,5 mg/ml BSA,0. 02%NaN3) 4 ℃静置2 h; ③弃去封闭液,TBST( pH =7. 5,50 mmol/L Tris-HCl,150 mmol/L NaCl,0. 1% Tween-20) 快速洗涤6 次,取10 μl 原始库溶液( 含4 ×1011噬菌体) 用1 ml TBST 稀释,加入免疫孔中,25 ℃,50 r/min摇动1 h; ④移去肽库溶液,TBST 洗涤免疫孔10 次,加入500 μl Cry2Aa( 100 μg/ml) 竞争洗脱,25 ℃,50 r/min摇动1 h,把洗脱液移至1. 5 ml 离心管内,共进行4轮亲和筛选,竞争洗脱。
第2 ~4 轮的筛选维持原Cry2Aa 的包被浓度,加入负筛选( 包被BSA 100 μg/ml,封闭5 mg/ml BSA,先将肽库加入到此孔中,25 ℃,50 r/min 摇动1 h) ,之后将肽库转移至包被有Cry2Aa 的正筛选孔中,增加Tween-20 浓度至0. 5%,第2 ~4 轮洗涤次数逐级递加,分别为10次、20 次和30 次,依然加入500 μl Cry2Aa( 100 μg/ml) 竞争洗脱1 h。
1.2.2 洗脱噬菌体扩增 将洗脱液加入到20 ml 对数前期的E. coli ER 2738 菌液中,37 ℃,250 r/min培养4. 5 h,特异性结合的噬菌体克隆得到扩增,4 ℃12000 r/min离心15 min,将上清液转移到新的离心管中,用1/6 体积的PEG/NaCl( 20% PEG8000,2. 5 mol/L NaCl) 沉 淀 噬 菌 体,4 ℃过夜。次日,12 000 r/min4 ℃离心25 min,弃上清液,用1 ml TBS 重悬沉淀,再用1/6 体积的PEG/NaCl 沉淀噬菌体,4 ℃静置1 h,14 000 r/min离心10 min,弃上清液,沉淀用200 μl TBS重悬,4 ℃14 000 r/min离心1 min,上清液即为扩增后的噬菌体。
1.2. 3 噬菌体滴度测定 以1∶ 100 接种E. coli ER 2738 于LB-Tet 液体培养基中,37 ℃,250 r/min扩增4. 5 h 至对数中期( OD600=0. 5) 。分别加200 μl 对数中期的菌液至10 个EP 管中,将各轮投入和产出的噬菌体用LB 培养液10 倍系列稀释,每个稀释度各取10 μl 分别加入到盛有菌液的EP 中,快速震荡,室温孵育5 min。将感染的菌液与3 ml 45 ℃预温的顶层培养基快速混匀,快速倒入37 ℃预温的LB/IPTG/Xgal/Tet培养板上,适当倾斜培养板将顶层琼脂均匀摊开。冷却5 min 后,将培养板倒置放于37 ℃恒温培养箱避光过夜培养。次日观察培养板,选择蓝斑数少于100 的培养板计数,蓝斑数乘以稀释倍数即为噬菌体滴度( pfu/ml) 。
1.3 噬菌体克隆的鉴定
1.3. 1 单克隆ELISA 4 μg/ml Cry2Aa 包被96 孔板,每孔100 μl,4 ℃过夜包被。弃去包被液,每 孔 加 200 μl 封 闭 液( 0. 1 mol/L 的NaHCO3,5 mg/ml BSA,0. 02% NaN3) ,4 ℃封闭2 h。弃去封闭液,TBST 洗板6 次,每孔加入100 μl 噬 菌 体 悬 液( 含1 × 1012个 噬 菌 体) ,室温结合2 h。弃去一抗,TBST 洗板6 次。每孔加入100 μl 酶标抗-M13 单抗( 1∶ 5 000) ,室温结合1 h。TBST 洗板6 次,每孔加入100 μl ABTS 显色液,室温15 min,测OD450。阴性对照组采用4 μg/ml BSA 包被96 孔板,每孔100 μl,每个克隆重复3 次。
1.3.2 DNA 序列测定 扩增以上阳性噬菌体克隆,用PEG/NaCl 沉淀噬菌体,碘化钠溶解抽提噬菌体单链DNA,琼脂糖电泳鉴定,送Sangon 公司进行测序。
1.3.3 PAb-Cry2Aa 竞争抑制试验 4 μg/ml Cry2Aa包被96 孔板,每孔100 μl,4 ℃过夜包被。次日弃去包被液,每孔加200 μl 封闭液(0.1 mol/L的NaHCO3,5 mg/ml BSA,0.02% NaN3) ,4 ℃封闭2 h。弃去封闭液,TBST 洗板6 次,将培养好的50 μl GT 噬菌体上清液预先与50 μl 不同浓度( 用TBST 配制浓度为2.5 mg/ml的PAb-Cry2Aa,并进行5 倍系列梯度稀释至0.000 16 mg/ml,共设7 个浓度梯度) 的PAb-Cry2Aa充分混合,对照加入培养好的50 μl GT 噬菌体上清液和50 μl TBST 的混合液,每排分别加入100 μl 的上述液体,3 次重复,室温结合2 h,洗板6 次后加入100 μl 酶标抗-M13 单抗(1∶ 5 000) ,室温结合1 h,洗板6 次。每孔加入100 μl ABTS 显色液,室温15 min,测OD450。
1.3.4 利用间接竞争ELISA 建立检测方法 间接竞争ELISA 法:取50 μl GT 噬菌体上清液( 含108个噬菌体) 与14 种不同浓度的Cry2Aa 毒素蛋白( 用NaHCO3缓 冲 液 配 制 成20 μg/ml、10 μg/ml 和4 μg/ml Cry2Aa 毒素,再对4 μg/ml Cry2Aa 毒素进行倍半稀释至0.001 953 μg/ml) 混匀后先于37 ℃孵育过夜。次日将混合液加入包被有Cry2Aa( 4 μg/ml) 的96 孔板中,37 ℃孵育2 h,TBST 洗板,加入二抗( HRP-羊抗M13) 孵育1 h 后,显色,测OD450。以噬菌体上清液( 不含Bt 蛋白) 反应孔为阳性值,其他为反应值,计算抑制率,抑制率( I) =( 阳性值-反应值) /阳性值×100%[18]。
1.3.5 十二肽结合特异性测定 采用间接竞争ELISA 法测定十二肽与Bt 系列毒素蛋白之间的交叉反应率。间接竞争ELISA 法:50 μl 噬菌体上清液分别与不同浓度的Cry1Ac、Cry1B、Cry1C、Cry1F蛋白标准品( 用NaHCO3缓冲液配制成9 种浓度:0.062 5 μg/ml、0.125 0 μg/ml、0.250 0 μg/ml、0.500 0 μg/ml、1.000 0 μg/ml、2.000 0 μg/ml、4.000 0 μg/ml、10.000 0 μg/ml和20.000 0 μg/ml)混匀后先于37 ℃孵育过夜,次日将混合液加入事先包被有Cry2Aa(4 μg/ml) 的96 孔板中,37 ℃孵育2 h 后,用TBST 洗板,加入二抗( HRP-羊抗M13) 孵育1 h 后,显色,测OD450,以噬菌体上清液( 不含Bt 蛋白) 反应孔为阳性值,其他为反应值,计算抑制率,抑制率( I) =( 阳性值-反应值) /阳性值×100%。阻断剂分别为Cry1Ac、Cry1B、Cry1C、Cry1F,计算各抑制物的IC50、交叉反应率( CR) 。CRCry1Ac=IC50Cry1Ac/IC50Cry2Aa×100%[18]。
2 结果
2.1 噬菌体十二肽库的筛选结果
通过4 轮筛选,由产出投入比得知,特异性结合Cry2Aa 的噬菌体得到有效富集( 表1) 。

表1 从噬菌体十二肽库亲和筛选Cry2Aa 结合肽Table 1 Affinity selection of Cry2Aa-binding peptides from Ph. D. -12 library
2.2 单克隆ELISA 鉴定
对第4 轮随机挑取的20 个克隆进行单克隆ELISA鉴定,结果(图1) 显示:20 个克隆均为阳性克隆( 阳性值/阴性值>2.1)。将20 个克隆编号为1 ~20。
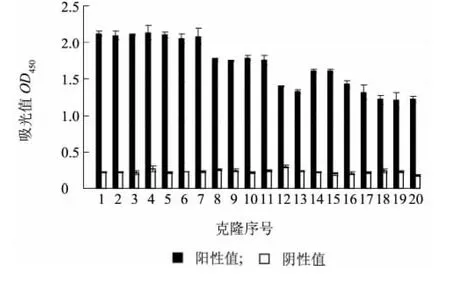
图1 单克隆噬菌体ELISA 鉴定抗Cry2Aa 噬菌体抗体Fig.1 Phage antibodies against Cry2Aa selected by monoclonal phage ELISA
2.3 噬菌体竞争性抑制PAb-Cry2Aa 与Cry2Aa 结合
在与Cry2Aa 多抗( PAb-Cry2Aa) 竞争ELISA 试验中,随着反应体系中PAb-Cry2Aa 浓度的增加,抑制了GT 噬菌体克隆与包被Cry2Aa 毒素蛋白的结合,使其吸光值逐渐降低( 图2) 。说明GT 噬菌体克隆确实是针对Cry2Aa 毒素蛋白某一表位产生的。

图2 GT 噬菌体克隆与PAb-Cry2Aa 竞争结合Cry2AaFig. 2 Competitive binding of phage clone GT and PAb-Cry2Aa to Cry2Aa
2.4 噬菌体克隆展示肽DNA 测序结果
对单克隆ELISA 试验得到的20 个阳性噬菌体克隆进行DNA 测序并推导其相应的氨基酸序列,获得8 条不同序列( 表2) 。

表2 第4 轮阳性噬菌体克隆的外源DNA 序列及相应氨基酸序列分析Table 2 The sequences of DNA and peptides of eluted phage in the fourth round
2.5 基于GT 的间接竞争ELISA 检测方法的建立
由结果( 图3) 得知,随着游离Cry2Aa 浓度的增加,抑制率也增大,抑制率最高达61.35%。游离Cry2Aa 毒素蛋白对GT 的抑制中浓度( IC50) 为1.139 μg/ml,最低检测限IC10为0.021 1 μg/ml,线性检 测 范 围 为0.047 8 ~22.691 0 μg/ml ( y =23.091lgx + 48.692,R2= 0.996 3) 。
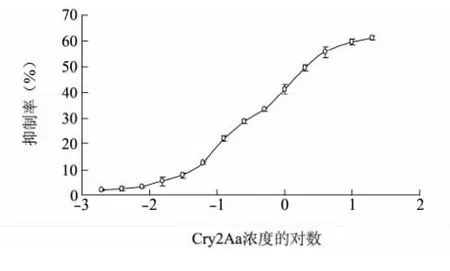
图3 间接竞争ELISA 反应Fig.3 Indirect competitive ELISA
2.6 GT 克隆的结合特异性鉴定
由交叉反应结果( 表3) 显示,GT 特异性识别Cry2Aa; 对Cry1C 的交叉反应率为1.59%; 对Cry1Ac、Cry1B、Cry1F 的交叉反应率均小于0.10%。
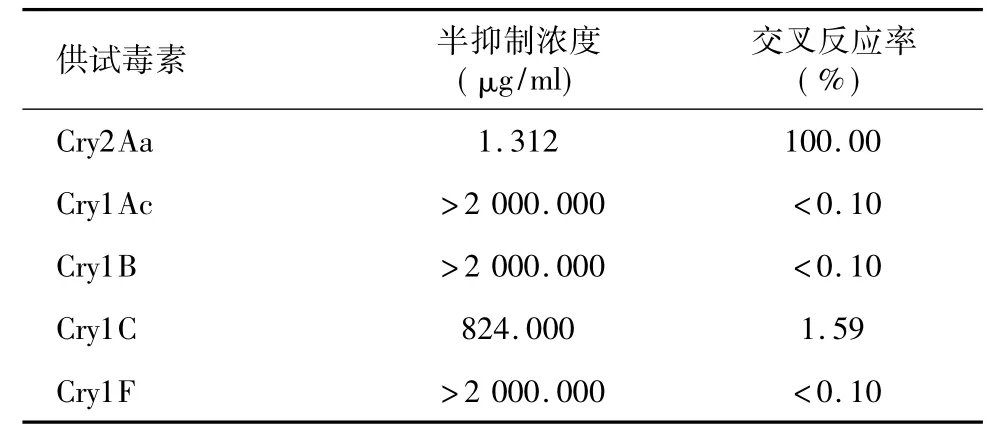
表3 噬菌体GT 对Cry1Ac、Cry1B、Cry1F 的交叉反应率Table 3 The cross-reactivity of phage-GT with Bt toxin
3 讨论
噬菌体展示技术的发展具有很大优越性,它筛选容量大,效率高,亲和选择与生物学扩增能力有效结合,在获得亲和多肽或蛋白的同时也得到了其核酸编码序列。本研究通过对活化的Cry2Aa 毒素采用随机12 肽噬菌体展示文库进行4 轮“吸附-洗脱-扩增”的淘选,成功获得了针对Cry2Aa 毒素特异性和亲和力较高的噬菌体多肽克隆。在噬菌体展示技术中,筛选过程对于整个试验的成败起着至关重要的作用,在本试验的筛选过程中,为提高筛选的效率和最大程度获得高亲和力的噬菌体克隆,我们优化和整合了以下几种方法:①筛选过程中引入负筛选,可以有效减少与封闭蛋白结合噬菌体的克隆[19];②保持4 轮Cry2Aa 的包被浓度不变,并在第2 ~4 轮增加洗脱液中Tween-20 的含量及洗涤次数,此手段可以减少非特异性和亲和力低的克隆[20];③在胰蛋白酶( Trypsin) 洗脱中加入游离的Cry2Aa 毒素进行竞争洗脱,以确保获得高亲和力噬菌体克隆[21]。在单克隆ELISA 试验中,对第4 轮产出的克隆随机挑选了20 个进行鉴定,结果显示,阳性克隆达到了100%( 其中吸光值最高可达2.0 以上) ,说明本试验采用的筛选方法可以十分有效地获得与Cry2Aa毒素特异性结合的高亲和力噬菌体克隆。
Bt 基因在转基因植物中表达水平在不同生长期不同部位差别很大,张青玲等测得Cry2Aa 蛋白表达蛋白量为33.5 ~120.0 ng/ml[22],本试验利用噬菌体多肽建立的Cry2Aa 检测方法,最低检测限(21.1 ng/ml) ,基本能满足Cry2Aa 蛋白检测的要求。但考虑到Bt 蛋白提取存在损失,且本试验结果低于美国EnvironLogix 公司转Bt 基因ELISA 试剂盒的最低检测限(1 ng/ml)[22],分析其原因,可能是单抗与十二肽对Cry2Aa 蛋白的结合存在亲和力的差异以及检测方法设计的差异,本试验采用间接竞争法,而商品化试剂盒采用的是双抗夹心法,即非竞争法。非竞争检测方法无论是在最低检测限还是线性检测范围都比竞争法优越[7-8]。下一步的研究我们将改变检测方法,对已获得的十二肽进行突变,以期产生更高亲和力的多肽噬菌体,并且将单克隆抗体技术、噬菌体展示技术和基因工程技术相结合,制备多功能重组抗体,同时检测多种Bt 毒素,降低检测成本。
本试验中筛选到的Bt 蛋白特异结合的十二肽,也可为研究毒素与受体的相互作用,进一步探索抗性机制提供技术平台[12]。
[1] DE MAAGD R A. Bacillus thuringiensis-Based products for insect pest control[M]. Switzerland: Springer International Publishing,2015: 185-192.
[2] DOMINGO J L,GINÉBORDONABA J. A literature review on the safety assessment of genetically modified plants[J]. Environment International,2011,37(4) : 734-742.
[3] ANDOW D A,ZWAHLEN C. Assessing environmental risks of transgenic plants[J]. Ecology Letters,2006,9(2) : 196-214.
[4] LU B R,XIA H. Environmental biosafety of transgenic plants: research and assessment of transgene escape and its potential ecological impacts[J]. Chinese Bulletin of Life Sciences,2011,23(2) :186-194.
[5] SANVIDO O,ROMEIS J,GATHMANN A,et al. Evaluating environmental risks of genetically modified crops: ecological harm criteria for regulatory decision-making[J]. Environmental Science& Policy,2012,15(1) : 82-91.
[6] HEUBERGER S,CROWDER D W,BRÉVAULT T,et al. Modeling the effects of plant-to-plant gene flow,larval behavior,and refuge size on pest resistance to Bt cotton[J]. Environmental Entomology,2011,40(2) : 484-495.
[7] ZHANG X,LIU Y,ZHANG C,et al. Rapid isolation of singlechain antibodies from a human synthetic phage display library for detection of Bacillus thuringiensis ( Bt) Cry1B toxin[J]. Ecotoxicology and Environmental Safety,2012,81: 84-90.
[8] WANG Y,ZHANG X,ZHANG C,et al. Isolation of single chain variable fragment ( scFv) specific for Cry1C toxin from human single fold scFv libraries[J]. Toxicon,2012,60(7) : 1290-1297.
[9] 华修德,施海燕,王鸣华. 噬菌体展示肽库技术及其在农药残留免疫分析中的研究进展[J]. 食品安全质量检测学报,2014,5(12) :3955-3961
[10] LIU R,YU Z,HE Q H,et al. An immunoassay for ochratoxin A with out the mycotoxin[J]. Food Control,2007,( 18) : 872-877.
[11] 李利红,李常青. 转基因植物中Bt 杀虫蛋白的重组噬菌体辅助检测[J]. 生物化学与生物物理进展,2001,28( 5) : 728-731.
[12] 齐 佳. 利用噬菌体展示技术筛选Cry2Ab 毒素受体结合表位的研究[D]. 北京:中国农业科学院,2011.
[13] LI Y,WANG Y,ROMEIS J,et al. Bt rice expressing Cry2Aa does not cause direct detrimental effects on larvae of Chrysoperla sinica[J]. Ecotoxicology,2013,22(9) : 1413-1421.
[14] WANG L H,DENG L H,LAI F X,et al. Optimization of the Cry2Aa Gene and Development of Insect-resistant and Herbicidetolerant Photoperiod-sensitive Genic Male Sterile Rice[J]. Czech J Genet Plant Breed,2014,50(1) : 19-25.
[15] MORSE R J,YAMAMOTO T,STROUD R M. Structure of Cry2Aa suggests an unexpected receptor binding epitope[J].Structure,2001,9(5) : 409-417.
[16] LENIN K,MARIAM M A,UDAYASURIYAN V. Expression of a cry2Aa gene in an acrystalliferous Bacillus thuringiensis strain and toxicity of Cry2Aa against Helicoverpa armigera[J]. World Journal of Microbiology and Biotechnology,2001,17(3) : 273-278.
[17] ENGLISH L,ROBBINS H L,VON TERSCH M A,et al. Mode of action of CryIIA: a Bacillus thuringiensis delta-endotoxin[J]. Insect Biochemistry and Molecular Biology,1994,24( 10) : 1025-1035.
[18] 徐重新. 人源化抗苏云金芽胞杆菌Bt ( CrylB) 毒素蛋白单链抗体的筛选,表达及生物学活性测定[D]. 南京: 南京师范大学,2013.
[19] ELLINGTON A D,SZOSTAK J W. Selection in vitro of singlestranded DNA molecules that fold into specific ligand-binding structures[J]. Nature,1992,355(6363) : 850-852.
[20] DE BRUIN R,SPELT K,MOL J,et al. Selection of high-affinity phage antibodies from phage display libraries[J]. Nature Biotechnology,1999,17(4) : 397-399.
[21] MOGHADDAM A,LØBERSLI I,GEBHARDT K,et al. Selection and characterisation of recombinant single-chain antibodies to the hapten Aflatoxin-B1 from naive recombinant antibody libraries[J]. Journal of Immunological Methods,2001,254( 1) : 169-181.
[22] 张青玲,李云河,华红霞,等. Bt 水稻田重要非靶标节肢动物暴露于Cry2Aa 蛋白的程度分析[J]. Chinese Journal of Applied Ecology,2013,24(6) : 1647-1651.

