心脑健片紫外分光光度计法的分析方法验证
于 泳 司马哲超
(东南大学成贤学院,江苏南京210088)
0 引言
一般来说,在药品质量管理活动中,为了确保质量控制的分析方法符合检验要求,满足GMP的要求,并能让客户感到满意,凡是涉及分析方法的领域都应对其分析方法进行验证。
1 问题的提出
国际人用药品注册技术国际协调会议(ICH)在其质量指导文件Q2a中将分析方法分为鉴别、定量分析、限度检测与含量分析4种常见类型,每种类型及其典型的验证参数如表1所示。其中,-表示通常不需要验证的参数;+表示通常需要验证的参数;①表示假如已论证重现性,可不需再论证中间精密度;②表示缺乏专属性的分析方法,应由其他分析方法来补充;③表示视具体情况而定。各类验证参数定义如表2所示[1]。
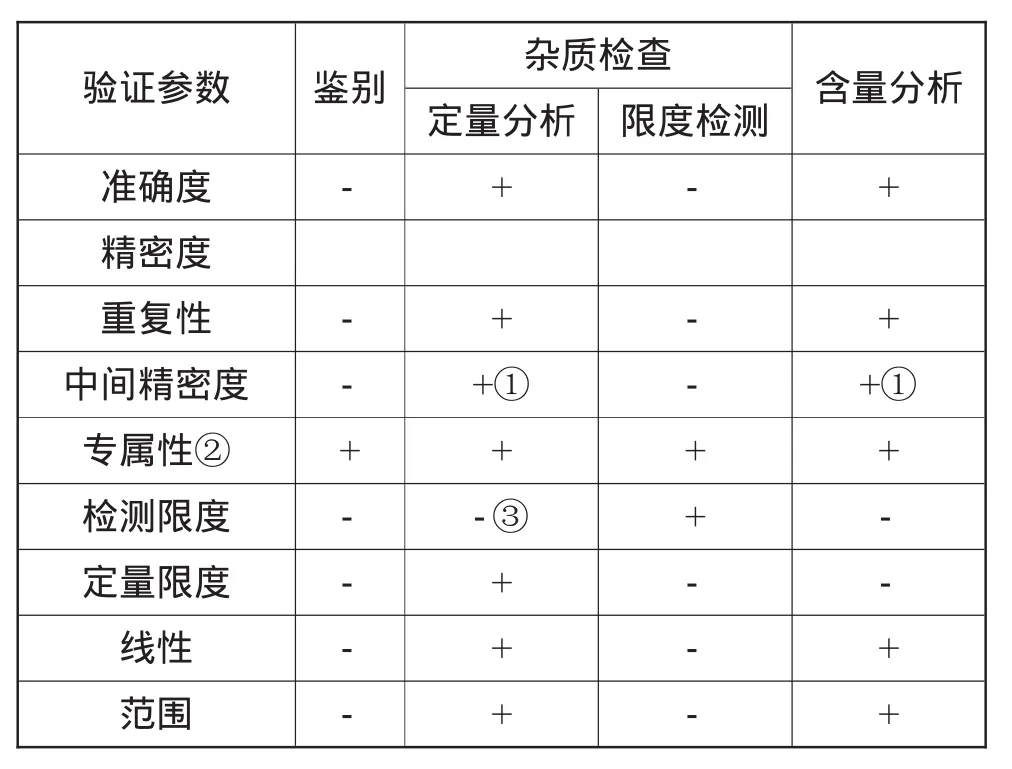
表1 验证类型与相应参数

表2 验证参数与表示方法
某药品生产企业的主要产品为中药心脑健片,其主要成分为茶叶提取物,根据2010版中国药典,用紫外—可见分光光度法,在540 nm波长处测定吸光度。从检测情况来看,所生产的片剂主药含量符合标准,根据新版GMP的要求,必须对这个检验方法进行方法学验证。
2 方法学验证的实验内容
心脑健片的成分为茶叶提取物,为显淡黄褐色至棕褐色的片剂。此次试验对“20130301”和“20131001”2件批号的心脑健片样品进行了验证及研究[2]。
2.1 含量测定
实验步骤:取本品20片,研细。精密称取适量(约相当于茶叶提取物0.1 g),置100m L量瓶中,摇匀,滤过,弃去初滤液,精密量取续滤液1m L,置25m L量瓶中,加水4m L、酒石酸铁溶液(去硫酸亚铁1 g,酒石酸钾钠5 g,加水溶解并稀释至1 000m L)5m L,摇匀;再加pH 7.5的磷酸盐缓冲液[甲液:称取磷酸氢二钠(Na2HPO4·12H2O)23.377 g,用水溶解并稀释至1 000m L,摇匀;乙液:称取磷酸二氢钾(KH2PO4)9.078 g,用水溶解并稀释至1 000m L,摇匀。取甲液85m L与乙液15m L,混匀,摇匀,即得]至刻度,摇匀。以水为空白对照,照紫外—可见分光光度法(中国药典2010年版一部附录VA),在540 nm波长处测定吸光度。
计算公式:

本品的含茶叶提取物以茶多酚计,为标示量的90.0%~110%(内控为95%~105%)。取样品重量为0.252 2 g、平均片重为0.273 99 g的心脑健片样品,测出其540 nm处波长和含量如表3所示。
取样品重量为0.270 8 g、平均片重为0.273 99 g的心脑健片样品,其测出540 nm处波长和含量如表4所示。

表3 540 nm处波长和含量(样品重量为0.252 2 g、平均片重为0.273 99 g)

表4 540 nm处波长和含量(样品重量为0.270 8 g、平均片重为0.273 99 g)
实验结论:经过540 nm处波长测定,计算出的样品的茶多酚含量为95.3%、97.4%,既满足国家标准,也满足内控标准,为合格产品。
2.2 专属性
鉴别试验:取本品20片,研细。精密称取适量(约相当于茶叶提取物0.1 g),加水100m L,搅拌,摇匀,滤过,弃去初滤液,精密量取续滤液2m L,滴加三氯化铁1滴,滤液呈蓝黑色。取上述剩余滤液2m L,滴加香草醛试液(临时用配制)1m L,呈樱红色。结论:滴加三氯化铁滤液呈蓝黑色,滴加香草醛试液呈樱红色,主药与辅料、杂质等能明显区分,表明其专属性良好。
2.3 精密度
重复性测定实验步骤:取本品20片,研细。精密称取0.147 5 g,置100m L量瓶中,摇匀,滤过,弃去初滤液,重复精密量取续滤液1m L 3次,分别置于25 m L量瓶中,加水4 m L、酒石酸铁溶液5 m L,摇匀,再加pH7.5的磷酸盐缓冲液至刻度,摇匀,以水为空白对照,照紫外—可见分光光度法(中国药典2010年版一部附录VA),每组在540 nm波长处测定3次,得到其吸光度,计算其含量和RSD(平均片重为0.291 8 g),其计算结果如表5所示。

表5 精密度测定结果(片重为0.291 8 g)
同上述实验步骤,精密称取0.254 3 g样品,配置成上述溶液,于540 nm波长处测定其吸光度。其计算结果如表6所示。
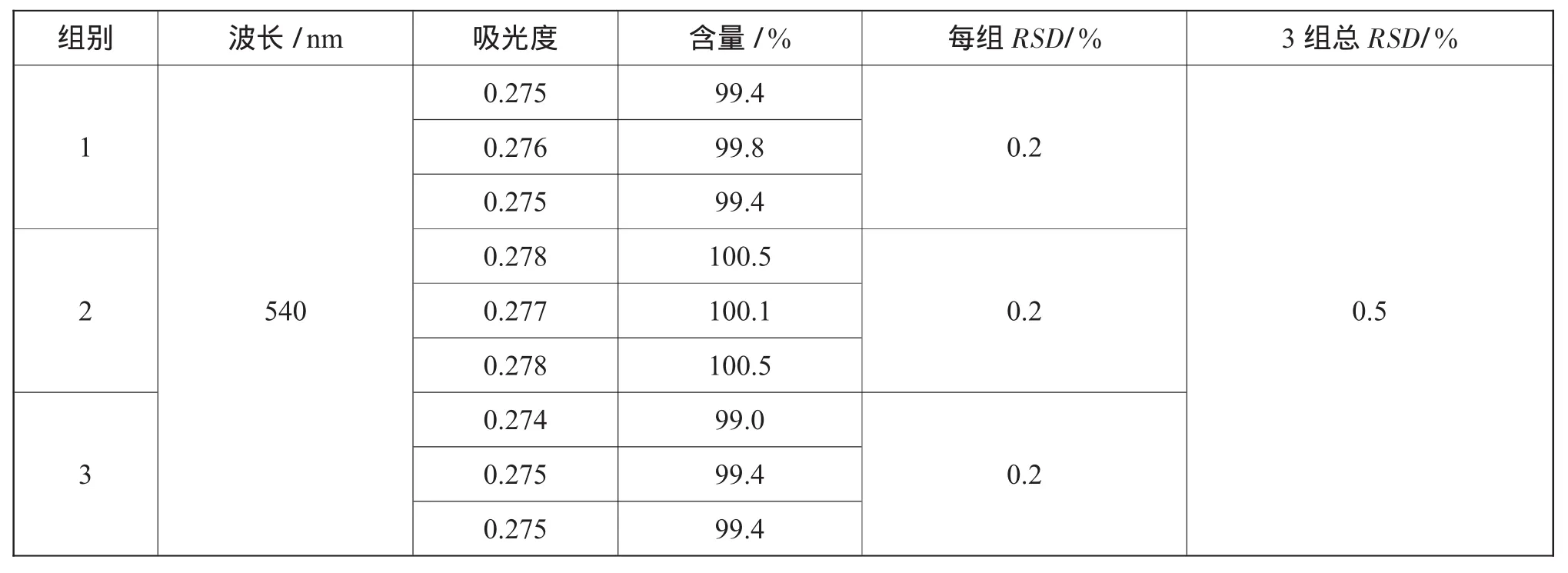
表6 精密度测定结果(0.254 3 g样品)
同上述实验步骤,精密称取1.252 3 g样品,配置成上述溶液,于540 nm波长处测定其吸光度。计算结果如表7所示。
实验结论:经过对不同浓度的心脑健片在较短间隔内的重复性测定,发现其相对标准偏差RSD为1.6%、0.5%、0.1%,RSD≤2%,满足中国药典对于紫外分光光度计的要求,表明其精密度良好。
2.4 线性
实验步骤:取本品20片,研细。精密称取0.2595g,置100m L量瓶中,摇匀,滤过,弃去初滤液,精密量取续滤液,配置浓度为0.025mg/m L、0.05 mg/m L、0.2 mg/m L、0.25 mg/m L、0.4 mg/m L的供试品,之后再540 nm处测定其吸光度,构建线性曲线,求出线性方程和R值,如表8所示[3]。
实验结论:浓度与吸光度的线性关系如图1所示,此次线性实验所做的5个浓度均在线性范围内,其相关系数R2值为0.997 1,满足线性关系,线性回归方程为y=3.207 6x-0.019 2,且在含量测定中所

表7 精密度测定结果(1.252 3 g样品)

表8 线性测定结果
做的2个含量值也在线性范围内,具有良好的线性关系[4]。

图1 浓度与吸光度的线性关系
2.5 范围
实验步骤:取本品10片,研细,精密称取10个样品,分别置于100m L容量瓶中,摇匀,滤过,弃去初滤液,精密量取续滤液1m L,分别置于25m L容量瓶中,加水4 m L、酒石酸铁溶液5 m L,摇匀,再加pH7.5的磷酸盐缓冲液至刻度,摇匀,以水为空白对照,照紫外—可见分光光度法(中国药典2010年版一部附录VA),每组在540 nm波长处测定3次,得到其吸光度。
计算其含量均值和标准差S,以及标示量与均值之差的绝对值A(A=|100-X|)。如A+1.80S≤15.0,即供试品的含量均匀度符合规定;若A+S>15.0,则不符合规定;若A+1.80S>15.0,且A+S≤15.0,则应另取20片(个)复试。根据初、复试结果,计算30片(个)的均值X、标准差S和标示量与均值之差的绝对值A,如A+1.45S≤15.0,即供试品的含量均匀度符合规定;若A+1.45S>15.0,则不符合规定。计算结果如表9所示[5]。
实验结论:标准差S为2.089,绝对值A为2.5,A+1.80S≤15.0,供试品的含量均匀度符合药典标准[6]。

表9 范围测定结果
3 深入研究
为探究各个因素对心脑健片的影响,故设计三因素三水平的正交实验对水温、过滤方式及震荡时间进行了测定,因素水平表如表10所示。

表10 因素水平表
实验步骤:精密称取1.248 8 g样品,置于500m L的容量瓶中,加水,摇匀,分别精密量取3次100m L的样品溶液,放入100m L容量瓶中,设水温为A,过滤方式为B,震荡时间为C,在不考虑交互作用的情况下,分别在540 nm处测定A1B1C1、A1B2C2、A1B3C3、A2B1C2、A2B2C3、A2B3C1、A3B1C3、A3B2C1、A3B3C2的波长,测定实验结果如表11所示。L9(34)正交试验结果效应曲线如图2所示。
实验结论:根据表11的极差R值大小,可以看出因子2对试验结果的影响最大,即过滤方式对试验影响最大,而其中又以因子3离心过滤更加突出,之后是因子1水温以37℃为最具影响,最后因子3震荡时间中1 h最具影响。因此,可初步估计最优方案为A2B3C2;再进一步分析,通过表11可以看出,3个因素一个都没有超过F临界值,即它们都不是显著性因素,但是相对来说因子2的F值要大于因子1和因子3。所以,可以认为三者中最具显著性的便是因素2过滤方式,根据图2效应曲线图,很明显因素1水温到了一个点之后效应便开始下降,因素3时间也是,只有因素2仍在缓慢上升,因此因素2过滤方式仍可继续研究,提升工艺。通过分析,确定在此次的正交试验中A2B3C2是最优方案[7]。
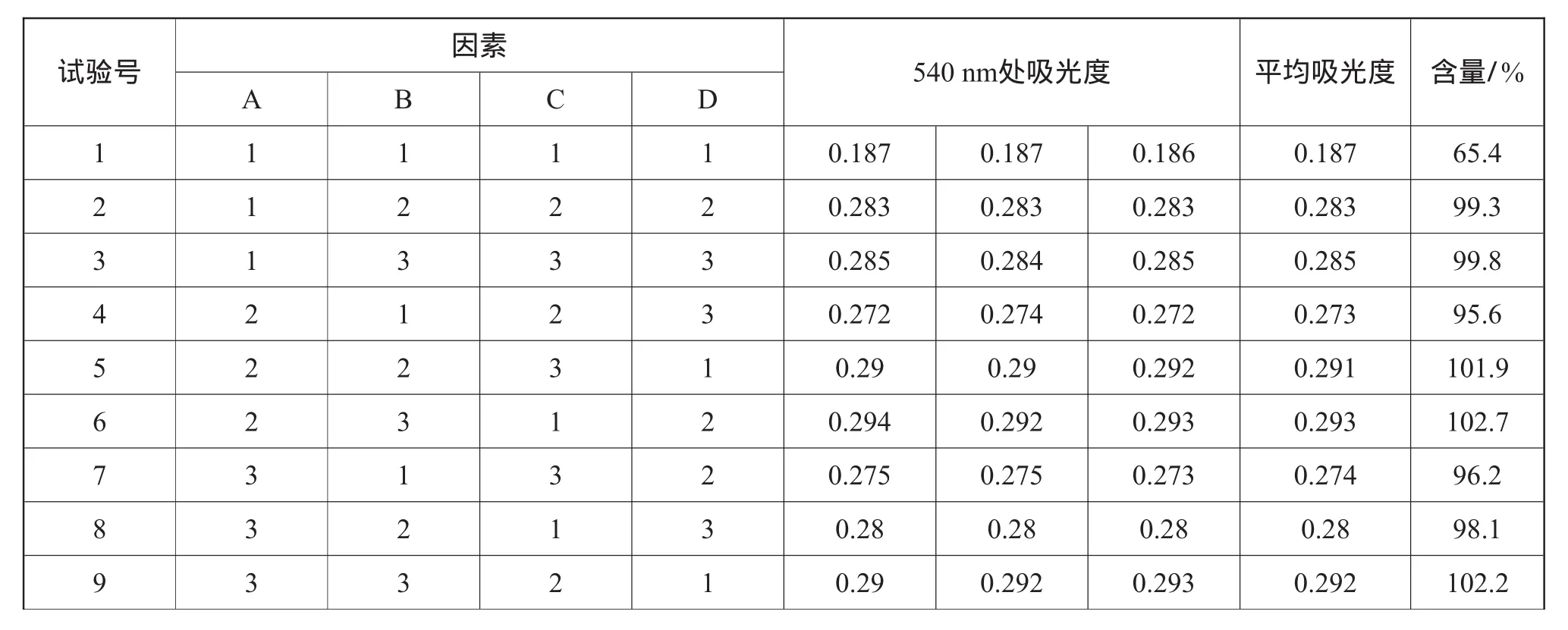
表11 正交实验测定结果

续表

图2 L9(34)正交试验结果效应曲线图
4 结语
上述方法表明,确认应用此分析方法分析心脑健片含量、专属性、精密度、线性、范围指标都符合紫外-分光光度法的常规要求和药典要求,因此该方法可以满足心脑健片日常含量的测定要求。
[1]霍秀敏.化学药物分析方法验证的内容和评价[J].中国新药杂志,2009(10)
[2]成海平.指导原则解读系列专题(七)化学药物质量控制分析方法验证的原则和要求[J].中国新药杂志,2009(8)
[3]覃淑芬.质量标准分析方法验证方案——以单硝酸异山梨酯注射液为例[J].企业科技与发展(上半月),2013(6)
[4]柴逸峰,纪松岗,张国庆,等.2000年版中国药典附录XⅨA“药品质量标准分析方法验证”的探讨[J].中国药品标准,2002(2)
[5]梁毅.欧美药物进口注册文件中的分析方法验证[J].医药工程设计,2007(5)
[6] Taverniers I,De Loose M,Van Bockstaele E.Trends in qual ity in the analytical laboratory.II.Analyt ical method val idation and qual ity assurance[J].TrAC Trends in Analytical Chemist ry,2004(8)
[7]陈斌.醋酸奥曲肽微球工艺优化及其验证[D]:[硕士学位论文].吉林大学,2013

