云芝菌液体发酵培养基的筛选
曾化伟,郑惠华*,梁 伟,陈 惠
(1 江苏安惠生物科技有限公司,江苏 南通,226009;2 中国科学院微生物研究所与江苏安惠生物科技有限公司药用菌联合实验室;3 江苏省南通市药用菌研究重点实验室)
云芝菌液体发酵培养基的筛选
曾化伟1,2,3,郑惠华1,2,3*,梁 伟1,2,3,陈 惠1,2,3
(1 江苏安惠生物科技有限公司,江苏 南通,226009;2 中国科学院微生物研究所与江苏安惠生物科技有限公司药用菌联合实验室;3 江苏省南通市药用菌研究重点实验室)
利用29个培养基配方,进行了云芝菌液体摇瓶发酵试验,考察了发酵菌粉的多糖质量分数和菌粉干质量。结果表明:以菌粉多糖质量分数不低于0.04,菌粉干质量不低于20 g/L为标准,最优培养基配方为黄豆饼粉20 g/L,葡萄糖30 g/L,玉米粉10 g/L,酵母膏5 g/L,CaCO31.5 g/L,KH2PO41.0 g/L,MgSO41.5 g/L,pH自然,多糖质量分数为0.049 4;菌体干质量为21.00 g/L。
云芝;液体发酵;培养基
云芝(Coriolusversicolor),学名采绒革盖菌,别名杂色云芝、多色云芝、彩纹云芝等,隶属担子菌亚门、层菌纲、非褶菌目、多孔菌科、革盖菌属[1]。云芝的主要功效成分为多糖,它是人类健康的保护者,具有良好的抗糖尿病[2]、调节免疫力[3]、提高抗氧化能力[4]、抗肿瘤[5,6]等功效。
云芝目前主要采用人工栽培的子实体加工成各种药物和保健食品,然而人工栽培存在生长周期长、产量低、品质不稳定等缺点。液体发酵技术是在抗生素工业发展起来后才运用到药用真菌发酵中的。其优点是可以进行工业化连续生产、规模大、产量高、发酵周期短、生产效益高[7],更突出的在于药用真菌在液体发酵过程中,由于培养基和培养条件的可控制性,能够使真菌基因的表达向特定需要的物质方面积累性表达,往往能较野生和人工栽培的真菌有效活性成分高几倍。近几年来,国内外已开展了云芝液体发酵生产多糖的研究,如以矿物质、通气量、溶氧等工艺优化手段提高云芝多糖的产量[8~12]。然而作者通过文献检索发现,以往云芝多糖的研究主要集中在提高胞外多糖,对提高胞内多糖的研究相对较少。近年来,试验已证明通过改变培养基配方来提高药用菌胞内多糖质量分数是一种非常有效的手段[13~16]。为此,本研究在参考已报道的云芝胞内多糖发酵培养基的基础上,再根据本实验室的研究基础,选择29个培养基系统地考察其对胞内多糖质量分数和菌粉干质量的影响,以期为生产提供依据。
1 材料与方法
1.1 材料
1.1.1 菌种 云芝菌种来自于江苏安惠生物科技有限公司菌种库,编号为Y-02。
1.1.2 培养基
斜面培养基的制作:将马铃薯洗净,去皮挖眼,切成2 cm2的小块,将200 g的小块马铃薯加入装有适量水的烧杯中,将烧杯放入电炉中煮沸30 min,用纱布过滤,滤液中加入20 g葡萄糖和20 g琼脂粉,在滤液加水至1 000 mL后,温度降至大约50 ℃时倒入适量体积滤液于试管中,将试管高温灭菌后制备成为斜面。
种子培养基:葡萄糖20 g/L,酵母膏5 g/L,麦麸20 g/L,玉米粉20 g/L,豆饼粉10 g/L,KH2PO41 g/L,MgSO40.5 g/L,pH 5.5。
发酵培养基的编号与培养基条件(在本实验室多糖合成研究基础上选择培养基配方):
(1)葡萄糖10 g/L,玉米粉15 g/L,豆饼粉5 g/L,酵母膏5 g/L,CaCO30.5 g/L,KH2PO41 g/L,pH 6.0。
(2)葡萄糖30 g/L,玉米粉15 g/L,蛋白胨4 g/L,黄豆饼粉10 g/L,KH2PO41.5 g/L,MgSO40.75 g/L,pH 6.0 。
(3)葡萄糖30 g/L,玉米粉10 g/L,蛋白胨4 g/L,黄豆饼粉5 g/L,麸皮5 g/L,KH2PO41.5 g/L,MgSO40.75 g/L,pH 6.0(参考文献[17]略作改动)。
(4)葡萄糖20 g/L,玉米粉10 g/L,酵母膏5 g/L,黄豆饼粉10 g/L,麸皮5 g/L,KH2PO41 g/L,MgSO40.5 g/L,pH 6.0 。
(5)葡萄糖40 g/L,玉米粉10 g/L,酵母膏5 g/L,黄豆饼粉10 g/L,麸皮10 g/L,KH2PO41 g/L,MgSO40.5 g/L,pH 6.0 。
(6)葡萄糖40 g/L,玉米粉10 g/L,玉米浆粉5 g/L,黄豆饼粉10 g/L,麸皮10 g/L,KH2PO41 g/L,MgSO40.5 g/L,pH 6.0。
(7)葡萄糖20 g/L,酵母膏2 g/L, 玉米淀粉2 g/L,麸皮1 g/L,蛋白胨2 g/L,KH2PO41 g/L,MgSO40.5 g/L,pH自然 。
(8)葡萄糖30 g/L,黄豆饼粉12 g/L,K2HPO45 g/L,KH2PO45 g/L,MgSO45 g/L,pH 6.0。
(9)葡萄糖20 g/L,蛋白胨4 g/L,黄豆饼粉10 g/L,(NH4)2SO41.5 g/L,MgSO45 g/L,KH2PO41 g/L,乙醇15 mL/L,VB110 mg/L,pH自然(参考文献[1]略作改动)。
(10)黄豆饼粉10 g/L,葡萄糖25 g/L,KH2PO41.5 g/L,MgSO40.5 g/L,pH 6.0。
(11)葡萄糖30 g/L,玉米粉10 g/L,黄豆饼粉10 g/L,麸皮 5 g/L,MgSO45 g/L,KH2PO41 g/L,pH自然。
(12)黄豆饼粉10 g/L,麦麸5 g/L,玉米粉10 g/L,葡萄糖20 g/L,玉米浆粉5 g/L,MgSO42 g/L,KH2PO41 g/L,VB110mg/L,pH自然。
(13)黄豆饼粉20 g/L,蔗糖40 g/L,玉米粉10 g/L,葡萄糖20 g/L,玉米浆粉5 g/L,MgSO40.75 g/L,KH2PO41.5 g/L,CaCO31 g/L,pH 6.5。
(14)黄豆饼粉20 g/L,葡萄糖30 g/L,玉米粉10 g/L,酵母膏5 g/L,CaCO31.5 g/L,KH2PO41 g/L,MgSO41.5 g/L,pH自然。
(15)黄豆饼粉10 g/L,葡萄糖25 g/L,(NH4)2SO42 g/L,NaCl 2.5 g/L,KH2PO40.5 g/L,pH自然。
(16)黄豆饼粉10 g/L,葡萄糖30 g/L,玉米粉10 g/L,KH2PO41 g/L,MgSO40.5 g/L,VB110mg/L,玉米浆粉10 g/L,pH 6.0。
(17)黄豆饼粉10 g/L,葡萄糖30 g/L,酵母膏2 g/L,(NH4)2SO42 g/L,MgSO45 g/L,KH2PO41 g/L,pH 6.0。
(18)黄豆饼粉10 g/L,葡萄糖30 g/L,蛋白胨10 g/L,(NH4)2SO42 g/L,MgSO45 g/L,KH2PO41 g/L,pH 6.0。
(19)黄豆饼粉10 g/L,葡萄糖30 g/L,玉米浆粉10 g/L,(NH4)2SO42 g/L,MgSO45 g/L,KH2PO41 g/L,pH 6.0。
(20)葡萄糖30 g/L,黄豆饼粉10 g/L,酵母膏20 g/L,MgSO41 g/L,KH2PO41 g/L,pH 6.0。
(21)葡萄糖40 g/L,蛋白胨3 g/L,KH2PO41.5 g/L,MgSO41.5 g/L,KH2PO41.5 g/L,pH 6.0。
(22)葡萄糖80 g/L,黄豆饼粉20 g/L,(NH4)2SO42 g/L,蛋白胨2 g/L,KH2PO40.5 g/L,pH自然。
(23)葡萄糖20 g/L,蔗糖5 g/L,酵母膏2 g/L,蛋白胨2 g/L,KH2PO42.5 g/L,MgSO41.5 g/L,pH 6.0。
(24)葡萄糖30 g/L,黄豆饼粉10 g/L,蛋白胨2 g/L,KH2PO41 g/L,MgSO40.5 g/L,pH 6.0。
(25)葡萄糖40 g/L,黄豆饼粉15 g/L,酵母粉2 g/L,蛋白胨2 g/L,MgSO40.5 g/L, KH2PO40.5 g/L,VB15 mg/L,pH 5.0。
(26)玉米粉25 g/L,黄豆饼粉10 g/L,MgSO45 g/L,KH2PO41 g/L,pH自然。
(27)葡萄糖40 g/L,玉米粉10 g/L,蛋白胨3 g/L,KH2PO41.5 g/L,MgSO40.5 g/L,pH 6.0。
(28)麦芽糖20 g/L,蛋白胨10 g/L,KH2PO42 g/L,MgSO40.5 g/L,pH 6.0 。
(29)葡萄糖30 g/L,酵母膏2 g/L,黄豆饼粉10 g/L,(NH4)2SO42.5 g/L,KH2PO41 g/L,MgSO40.5 g/L,pH自然。
以上培养基配方中的玉米粉、黄豆饼粉、麸皮、自来水均为工业级,来源于江苏安惠生物科技有限公司的发酵车间。所有培养基均在115 ℃条件下灭菌30 min。
1.2 培养方法
(1)云芝斜面的制备:将1~2 cm2的云芝菌块接入装有固体PDA斜面培养基的试管中,置于28 ℃培养箱中培养5 d,备用。
(2)种子培养:在无菌条件下,将2块1~2 cm2的斜面云芝接入500 mL种子培养基中(装液量200 mL),在转速为150 r/min的控温摇床上28 ℃振荡培养4 d,备用。
(3)发酵培养:4 d菌龄的种子以接种量为10% 接入500 mL发酵培养基中(装液量200 mL),置28 ℃和150 r/min摇床上振荡培养4 d。
1.3 测定方法
1.3.1 菌粉干质量的测定 将200 mL发酵液经过真空过滤后收集菌体,在105 ℃条件下烘干到恒质后,用电子天平称质量。
1.3.2 胞内多糖的提取和质量分数的测定 胞内多糖的提取方法和测定法参考中国药典(2010版)[15]。取云芝粉末约2 g,精密称定,置索氏提取器中,加水90 mL,电加热器加热回流提取至提取液无色,提取液转移至100 mL量瓶中,加水至刻度,摇匀。精密量取10 mL,加入乙醇150 mL,摇匀,4 ℃放置12 h,取出,离心,倾去上清液,沉淀加水溶解,转移至50 mL量瓶中,加水至刻度,摇匀,即得胞内多糖溶液。精密量取供试品溶液2 mL,用蒽酮-硫酸测定并计算出多糖质量分数。
2 结果和分析
不同培养基中菌粉的多糖质量分数差异较大,其中14号培养基中的菌粉多糖质量分数最高(0.049 4)(表1)。如果以多糖质量分数不低于0.04来选择培养基,有14号、16号、23号、28号培养基;不同培养基中菌粉的干质量差异较大,其中5号培养基具有最高的干质量(27.05 g/L)。如果以菌粉干质量不低于20 g/L为标准,可选择3号、4号、5号、6号、13号、14号培养基。
在药用真菌发酵生产菌粉中,菌粉的干质量和生物活性成分是衡量发酵效能的重要指标。如果菌粉干质量过低,可能导致发酵成本较高,菌粉多糖的质量分数过低,菌粉的药用价值不高。综合比较菌粉干质量和多糖的质量分数,筛选出的培养基为14号。已有研究表明,碳源、氮源、碳氮质量比、pH值能显著的影响药用菌的胞内多糖的质量分数和菌粉干质量[12,13,19]。本次研究中的14号培养基展示出较高的胞内多糖的质量分数和菌粉干质量,初步推测可能的原因如下:(1)发酵培养基中添加了CaCO3,CaCO3能调节发酵液的pH值,使多糖的合成和菌丝体形成处于较佳状态;(2)合适的碳、氮源及其比例使上述两指标处于较优水平。
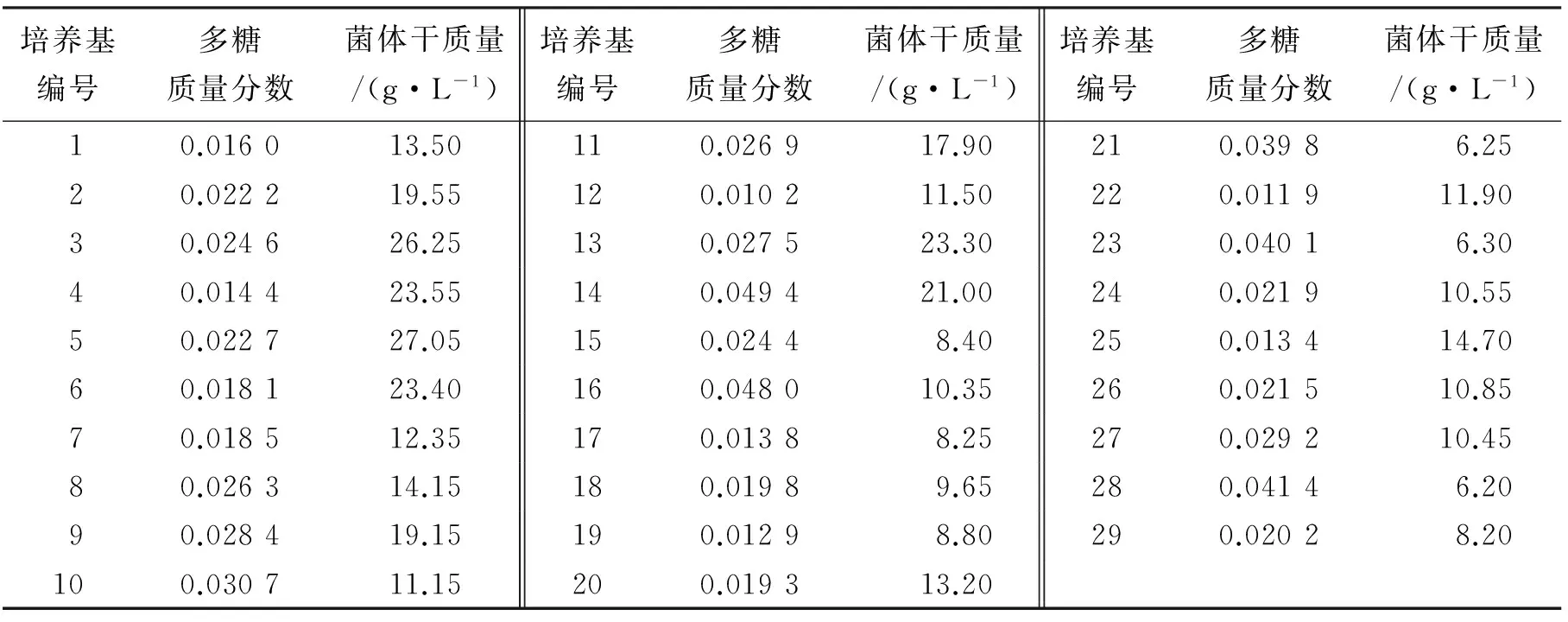
表1 不同培养基对云芝发酵菌粉多糖质量分数和菌体干质量的影响
3 结论与讨论
前期对国内外液体发酵生产云芝多糖的文献调查发现,大量研究集中在以胞外多糖为目标因子[8~12],仅林晓霞[1]、余晓斌[17]的研究是以胞内多糖的质量分数为目标因子。将本试验与上述2篇文献研究中的产量和胞内多糖的质量分数进行了比较发现,本次研究的最优配方(14)的干质量(21.00 g/L)高于文献[1]的干质量(14.40 g/L),略低于文献[17]的干质量(24.40 g/L)。多糖的质量分数由于测定方法和表述方式的不同,无可比性。但本次研究配方(14)的胞内多糖质量分数(0.049 4)与潘继红等[20]用同一测定方法和同一表述方法的最高云芝菌粉多糖质量分数(0.029 1)要高69.76%。本试验的配方为:黄豆饼粉20 g/L,葡萄糖30 g/L,玉米粉10 g/L,酵母膏5 g/L,CaCO31.5 g/L,KH2PO41 g/L,MgSO41.5 g/L,pH自然。文献报道[1]中的培养基配方:葡萄糖20 g/L,玉米淀粉20 g/L,蛋白胨4 g/L,黄豆饼粉10 g/L,(NH4)2SO41.5 g/L,MgSO40.5 g/L,KH2PO41 g/L,乙醇 15 mL/L, VB110 mg/L,高温淀粉酶0.02 mL/L, 豆油2 g/L,pH自然。本次研究中最优配方(14)组成相对文献[1]的配方简单,成本相对低廉。因此,本次研究优选的培养基配方具有较高的干质量、高的多糖含量、较低成本、配制操作简单的优点,具有一定的工业化价值。本次试验与文献[1]、[17]的环境条件进行比较,本次研究温度(28 ℃)与其它研究无差异,溶氧由于表述方式和设备不同无法进行比较。因此,下一步有必要优选最佳溶氧因子入手,获得更优的胞内多糖质量分数和干质量。
[1] 林晓霞.云芝胞内多糖发酵条件优化及特征组分分离鉴定[D].南京:南京工业大学,2006.
[2] Yang J P,Hsu T H,Lin F Y,et al.Potential antidiabetic activity of extracellular polysaccharides in submerged fermentation culture ofCoriolusversicolorLH1[J].Carbohydrate Polymers,2012,90(1):174-180.
[3] 乐毅,陈瑗,周玫.云芝多糖对受O-LDL攻击的小鼠巨噬细胞的保护作用及其免疫调节作用[J].第一军医大学学报,1994,14(1):12-14.
[4] 王菲菲,郝利民,王宗臻,等.云芝总发酵物及其多糖抗氧化活性比较研究[J].食品工业科技,2013,34(13):109-112.
[5] Wang D F,Lou N,Li X D.Effect ofCoriolusversicolorpolysaccharide-Bon the biological characteristics of human esophageal carcinoma cell line Eca109 in vitro[J].Cancer Biology and Medicine,2012,9(3):164-167.
[6] Silva A M,Miranda A,Fernandes E,et al.Endopolysaccharides fromGanodermaresinaceum,Phlebiarufa, andTrametesversicoloraffect differently the proliferation rate of HepG2 Cells[J].Applied Biochemistry and Biotechnology,2013,169(6):1 919-1 926.
[7] 朱戎,陈向东,兰进.药用真菌液体发酵研究进展[J].中药材,2003,26(1):55-57.
[8] Choi M G,Park Y H,Hong E K.Effects of C/N ratio and mineral sources on mycelial growth and polysaccharide production in liquid culture ofCoriolusversicolor[J]. ,2004,14(4):212-216.
[9] Choi M G,Hong E K.Optimization of agitation and aeration on mycelial growth and polysaccharide production in batch cultivation of Coriolus versicolor[J]. , 2004,15(10):385-388.
[10] Tavares A P A,Agapito M S M,Coelho M.A.M,et al.Selection and optimization of culture Medium for exopolysaccharide production by Coriolus (Trametes)Versicolor[J].World Journal of Microbiology and Biotechnology,2005,21(9):1 499-1 507.
[11] Rau U,Kuen Z,Wray V,Nimtz M,et al.Production and structural analysis of the polysaccharide secreted byTrametes(Coriolus)versicolorATCC 200801[J].Applied Microbiology and Biotechnology,2009,81(5):385-388.
[12] Wang F F,Zhang J C,Hao L M,et al.Optimization of submerged culture conditions for mycelial growth and extracellular polysaccharide production byCoriolusversiolor[J].Journal of Bioprocessing and Biotechniques,2012,2(4):1-5.
[13] Xu Q Q,Liu Z H,Sun Y S,et al.Optimization for production of intracellular polysaccharide fromcordycepsophioglossoidesL2 in submerged culture and its antioxidant activities in vitro[J].Chinese Journal of Chemical Engineering,2012,20(2):294-301.
[14] Zhen H W,Duan Y Y,Qian Y Q,et al.Screening ofGanodermastrains with high polysaccharides and ganoderic acid contents and optimization of the fermentation medium by statistical methods[J].Bioprocess and Biosystems Engineering,2014,37(9):1 789-1 797.
[15] 曾化伟, 郑惠华,梁伟,等.猴头菌液体发酵培养基的优选[J].食品与发酵科技,2014,50(181):29 -31.
[16] 曾化伟, 郑惠华,梁伟,等.合成胞内多糖的发酵灵芝菌种及培养基的研究[J].食品与发酵科技,2014,50(182):22-25.
[17] 余晓斌,胡卫珍,濮文林,等.液体发酵法生产云芝胞内糖肽[J].食品与生物技术学报,2006,25(1):65-69.
[18] 中华人民共和国药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2010.
[19] Fang Q H,Zhong J J.Effect of initial pH on production of ganoderic acid and polysaccharide by submerged fermentation ofGanodermalucidum[J].Process Biochemistry,2012,37:769-774.
[20] 潘继红, 王福霞, 杜娟.枸杞子对云芝菌丝体生长和多糖含量的影响[J].中国野生植物资源,2004,23(6):52-53.
(责任编辑:朱宝昌,杨静)
Selection of Fermentation Mediums for ProducingCoriolusversicolor
ZENG Hua-wei1,2,3, ZHENG Hui-hua1,2,3, LIANG Wei1,2,3*, CHEN Hui1,2,3
(1 Jiangsu Alphay Biotechnology Co. Ltd, Nantong Jiangsu,226009; 2 Institute of Microbiology Chinese Academy of Sciences-Jiangsu Alphay Biotechnology Co. Ltd Joint Laboratory of Medicinal Fungi;3 Nantong Key Laboratory of Medicinal Mushrooms;China)
29 mediums were applied to produce mycelium by liquid fermentation ofCoriolusversicolor, and the intracellular polysaccharide contents and dry cell weights of mycelium under different mediums were evaluated respectively. When intracellular polysaccharide mass fraction(more than 0.004 0) and cell dry weight (more than 20 g/L) were achieved, No. 14 was chosen as a suitable medium.
Coriolusversicolor;liquid fermentation;mediums
10.3969/J.ISSN.1672-7983.2015.01.007
曾化伟(1980-),男,博士,工程师。主要研究方向:食药用菌活性成分高效累积的发酵调控。
国家“863”计划项目(项目编号:2012AA02170), 2013年江苏省科技厅企业“博士集聚”计划和江苏省农业科技支撑项目(项目编号:BE2012341)。
2014-09-23; 修改稿收到日期: 2014-10-30
TS201.2
A
1672-7983(2015)01-0034-05
*通讯作者,女,高级工程师。主要研究方向:食药用菌生物技术。E-mail:397781549@qq.com。

