复合益生菌对刺参非特异性免疫和抗病力的影响
憨素连,王福强*,王 晶,刘晨敏
(大连海洋大学动物营养与饲料实验室,辽宁大连116023)
刺参是我国黄渤海海域最有经济价值的水产养殖品种之一。然而,大规模、高密度的刺参人工养殖、药物滥用常常会导致生态破坏、水质恶化、刺参的疾病和死亡大规模暴发等问题。研究表明,在饲料中添加益生菌,除了能增加饲料的适口性和提高养殖动物的增重率外,还可以增强养殖动物的免疫力,降低发病率,是实现生态养殖的重要途径。目前,研究应用的益生菌主要有芽孢杆菌、乳杆菌、双歧杆菌、酵母菌、霉菌、光合细菌、硝化细菌、反硝化细菌等。但是,复合益生菌对水产动物免疫和抗力方面的研究较少。胡毅等[1]用复合益生菌和单一益生菌投喂凡纳滨对虾,结果发现复合组的特定生长率、饲料效率、溶菌酶活力、血清蛋白浓度等均优于单一菌组。笔者对复合益生菌对刺参免疫和抗病力的影响进行了研究,旨在为其在水产养殖中的应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 复合益生菌。试验所用的复合益生菌,由大连阳光白奥科技有限公司生产,由枯草芽孢杆菌(Bacillus subtilis,106CFU/g以上)、乳酸杆菌(Lactobacilli acidophilus,106CFU/g以上)、酵母菌(Saccharomyces,106CFU/g以上)组成。
1.1.2 试验动物。试验所用刺参来自大连水益生海洋生物科技公司的同一批次刺参苗,刺参购回后暂养驯化1周。挑取个体大小均匀的健康刺参随机分为5组,每组3个重复,每个重复30头刺参,试验刺参初始体重为(1.07±0.02)g。
1.1.3 试验地点。养殖试验在大连海洋大学辽宁省水生生物学重点实验室进行。
1.2 方法
1.2.1 试验饲料。试验饲料配方和营养成分见表1~2。分别在基础饲料中添加 0、0.2%、0.4%、0.6% 和 0.8% 的复合益生菌,制成A、B、C、D、E 5种饲料。在低于20℃室内阴干后贮存于-20℃的冰箱中待用。
1.2.2 饲养管理。每天以刺参体重的3%投饵,根据摄食情况适当调整饲喂量,达到饱食投喂。每天17:20投喂1次,次日13:30吸除残饵和粪便,并补充暂存1 d的沙虑海水。饲养期间连续充气,水温控制在(15±3)℃。养殖试验持续8周。
1.2.3 攻毒试验。攻毒试验使用黄海希瓦氏菌(Shewanella smarisflavi),为刺参“化皮病”的致病菌之一,菌液由大连海洋大学病害实验室免费提供。用复合益生菌养殖刺参8周 后,每头刺参腹腔注射0.1 ml 6×108CFU/ml的菌液。

表1 试验饲料组成%

表2 试验饲料的营养水平 %
1.2.4 体腔液的采集。分别在攻毒第6天和第10天采集刺参体腔液。每个水槽中随机抽取刺参,用滤纸吸去体表水分后,用无菌、预冷的手术剪从刺参腹部近口1/3处剪开腹腔,将体腔液接收到预冷的离心管中,于4 000 r/min离心15 min,移出上清,分装到无菌Eppendof离心管中冻存于-20℃冰箱中。每头刺参取0.5~1.0 ml体腔液,将3~4头刺参的体腔液混合于1支离心管以消除个体差异。
1.2.5 免疫指标的测定。体腔液中酸性磷酸酶(ACP)的活性采用磷酸苯二钠法[2]测定。碱性磷酸酶(AKP)的活性采用磷酸苯二钠法测定[2]。超氧化物歧化酶(SOD)活性采用邻苯三酚自氧化法[2]测定。过氧化氢酶(CAT)的活性采用比色法测定[2]。溶菌酶(LSZ)活性的测定参照 Dan等[3]的方法并加以修改:将溶壁微球菌用PBS缓冲液(pH 6.4)溶解,调整浓度使其在570 nm波长下吸光值0.2~0.3。测定组每300μl菌液加入5μl样液,对照组以等体积PBS缓冲液代替样品。混合后在室温(18℃)孵育30 min,然后冰浴1 h,测定波长570 nm处的吸光值。LSZ活性单位定义:在37℃以每毫升刺参体腔液样品每分钟使吸光度降低0.001为一个酶活力单位(U)。
1.2.6 数据处理。数据处理与统计分析用SPSS 17.0统计分析软件进行,通过ANOVA单因子方差分析和Duncan’s多重检验分析平均值、标准差和组间差异显著性。结果均以平均值±标准差表示,P<0.05表示差异显著性。
2 结果与分析
2.1 复合益生菌对刺参免疫酶活性的影响 由表3可知,不同添加量的复合益生菌对刺参的AKP和SOD活性无显著性(P>0.05)影响;与其它试验组和对照组相比,0.6%的复合益生菌显著提高了刺参的ACP活性(P<0.05),0.4%、0.6%和0.8%的复合益生菌显著提高了刺参CAT活性(P<0.05),而0.6%和0.8%的复合益生菌则显著提高了刺参LSZ活性。
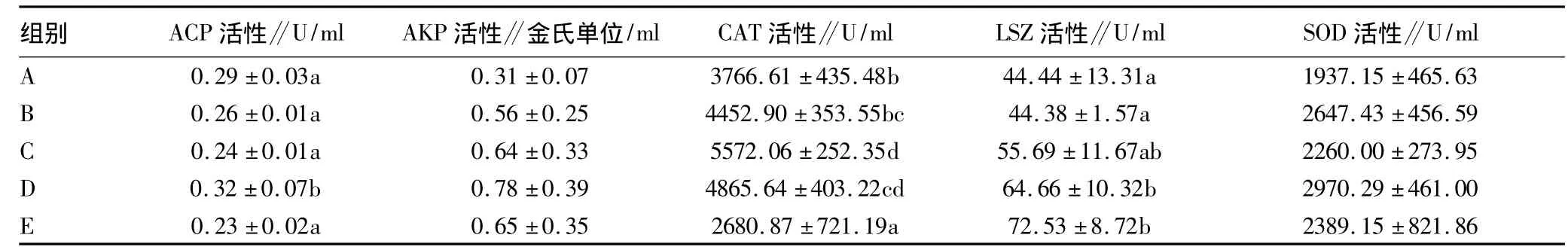
表3 复合益生菌对刺参免疫酶活性的影响
2.2 复合益生菌在感染黄海希瓦氏菌前后对刺参免疫酶活性的影响
2.2.1 对刺参酸性磷酸酶(ACP)活性的影响。从图1可以看出,在攻毒前(0 d),除D组的刺参ACP活性显著高于其他组外,其他组的ACP活性没有显著差异(P>0.05)。攻毒后各组ACP活性均呈现先下降后升高的趋势。攻毒6 d后,E组ACP活性明显比对照组低(P<0.05)。攻毒10 d后,C、D、E组ACP活性均极显著低于对照组(P<0.01)。
2.2.2 对刺参碱性磷酸酶(AKP)活性的影响。从图2可以看出,攻毒后的所有组的AKP活性均呈现增高趋势。在攻毒前、攻毒6 d和攻毒1 0d后,B、C、D、E组AKP活性均有高于对照组,但组间差异不显著(P>0.05)。
2.2.3 对刺参超氧化物歧化酶(SOD)活性的影响。从图3可以看出,在攻毒后各组的SOD活性随时间的延长呈降低的趋势。但在攻毒6 d、10 d后,各试验组的SOD活性的对照组没有显著差异(P>0.05),尽管前者较后者有降低的趋势。
2.2.4 对刺参过氧化氢酶(CAT)活性的影响。从图4可以看出,攻毒后各组刺参的CAT活性有随时间延长而提高的趋势。但攻毒前后,B、C、D组CAT活性比对照组也有增高的趋势,但各组之间没有显著差异(P>0.05)。
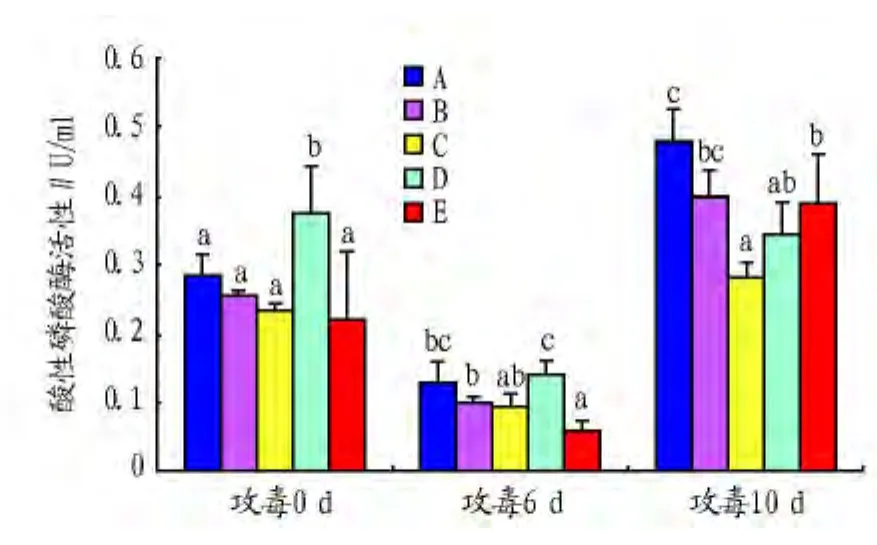
图1 益生菌对刺参酸性磷酸酶(ACP)活性的影响
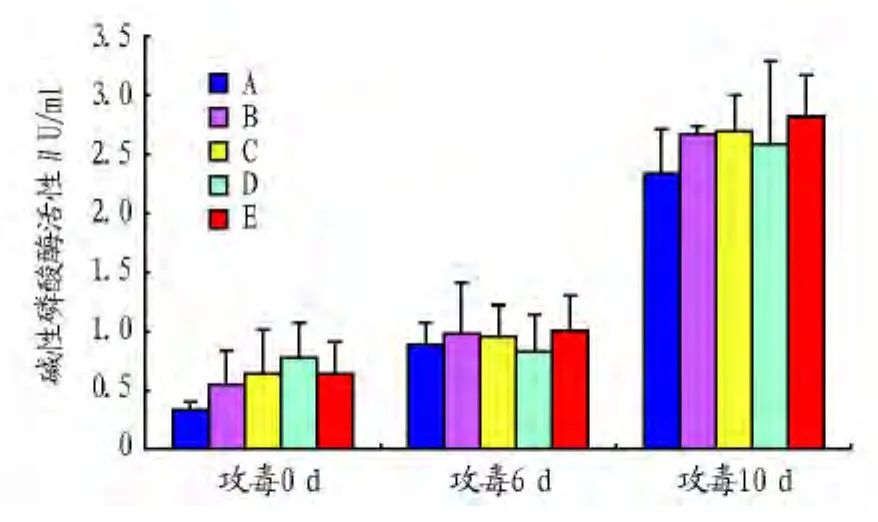
图2 益生菌对刺参碱性磷酸酶(AKP)活性的影响
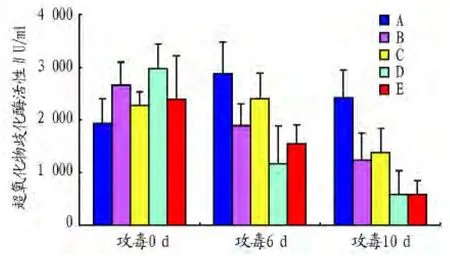
图3 益生菌对刺参超氧化物歧化酶(SOD)活性的影响

图4 益生菌对刺参过氧化氢酶(CAT)活性的影响
2.2.5 对刺参溶菌酶(LSZ)活性的影响。从图5可以看出,攻毒前各组LSZ活性随着益生菌添加量的增加而逐渐升高,其中D、E组LSZ活性显著高于A组(P<0.05)。攻毒6 d后,各试验组的LSZ活性均比对照组增加,但组间差异不显著(P>0.05)。攻毒10 d,各组的LSZ活性无显著差异(P>0.05)。
3 结论与讨论
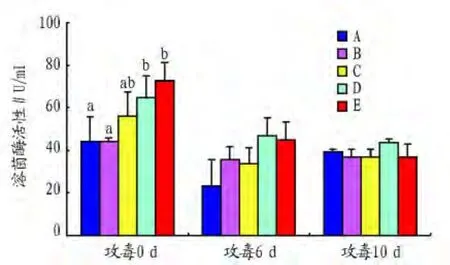
图5 益生菌对刺参溶菌酶(LSZ)活性的影响
该试验结果表明在基础饲料中添加复合益生菌可以提高刺参的非特性免疫能力,添加量以6 g/kg饲料为宜。该研究为这种复合益生菌制剂在水产养殖上的应用开辟了广阔的前景。
3.1 复合益生菌对刺参体腔液中免疫酶活性的影响 无脊椎动物的免疫系统并不健全,主要通过非特异性免疫反应提供抗感染能力[4]。张艳婷[5]发现在刺参饲料中添加灭活植物乳杆菌没有影响刺参的ACP的活性。该试验结果表明在刺参饲料中添加0.6%的复合益生菌显著提高了刺参体腔液的ACP活性,而其他添加量则对ACP活性没有显著影响。这可能与益生菌的种类以及添加量有关。
一些研究表明饲料中添加益生菌对水产动物的AKP活性的影响并不一致。袁丰华[6]研究表明在饲料中添加1010CFU/kg凝结芽孢杆菌或108CFU/kg光合细菌对尖吻鲈血液中的AKP活性没有影响。张艳婷[5]研究表明在饲料中添加高剂量的灭活乳杆菌能够提高刺参AKP的活性。该研究中添加复合益生菌没有显著增强刺参体腔液中AKP的活性。这表明益生菌对刺参等水产动物AKP的影响既与动物的种类有关,也与益生菌的添加量有关。
该试验中在饲料中添加复合益生菌对刺参体腔液中SOD活性没有显著影响。这与袁丰华[6]在尖吻鲈以及张艳婷[5]在刺参上的研究结果类似,而与王国霞等[7]在凡纳滨对虾上的研究结果有所不同。这可能与益生菌的种类和添加量均有关,其具体原因有待进一步研究。
关于益生菌对水产动物过氧化氢酶(CAT)的影响鲜见报道。该试验中投喂复合益生菌组的刺参体腔液中过氧化氢酶活性与对照组没有显著差异。
大量研究表明,益生菌可以提高水生动物的溶菌酶水平[5,8]。该研究中在刺参饲料中添加 0.6%和 0.8% 的复合益生菌可以显著提高刺参体腔液中的LSZ活性,这与上述研究结果基本一致。
3.2 复合益生菌对希瓦氏菌攻毒的刺参体腔液中免疫酶活性的影响 “化皮病”是目前流行最严重的、常导致刺参大量死亡的疾病,而黄海希瓦氏菌是引起大连地区刺参化皮病的重要病原菌[9],这也是该试验中采用希瓦氏菌对刺参攻毒的重要原因。
该试验中攻毒6 d后,各组ACP活性均有所下降,添加0.8%益生菌的处理组ACP活性比对照组低。在攻毒10 d后,ACP活性恢复到攻毒前的水平,但添加高剂量益生菌组的刺参ACP水平也均比对照组显著降低。这表明高剂量益生菌会抑制刺参体腔液中ACP的活性。这与张艳婷[5]的结果并不一致,其原因有待进一步探讨。
该试验中攻毒后刺参体腔液AKP活性也发生变化。攻毒后的所有组的AKP活性均呈现增高趋势。在攻毒前、攻毒6 d和攻毒10 d后,B、C、D、E组AKP活性均有高于对照的组。刘洪展[10]用假交替单胞菌感染仿刺参,在5 d内体腔液AKP活性逐渐降低,此后急剧上升,与该试验攻毒后的酶活性变化趋势相似。
该试验中在攻毒后各组的SOD活性随时间延长而呈降低的趋势。但在攻毒6 d、10 d后,各试验组的SOD活性较对照组没有显著差异,这与张艳婷[5]的结果类似。张艳婷[5]研究表明添加灭活植物乳杆菌对攻毒后的刺参SOD活性无影响。
该试验中人工感染黄海希瓦氏菌后,刺参体腔液CAT活性在第6天与攻毒前没有太大变化,而在第10天整体增强,且益生菌组有高于对照组的趋势。这说明致病菌感染激发了刺参CAT的活性,且益生菌对刺参过氧化氢酶活性有促进作用。
该试验中投喂复合益生菌能显著刺参体腔液中LSZ的活力。攻毒6 d、1 0d后,各试验组LSZ活性没有显著差异,且随着时间延长而呈降低的趋势。李明[11]分别用梅奇酵母和芽孢杆菌投喂刺参,发现在第3、4周试验组的刺参体腔上清液溶菌酶活性显著高于对照组(P<0.05),与该试验结果相似。在感染黄海希瓦氏菌后,溶菌酶活性较攻毒前整体下降。这说明体腔液中溶菌酶的活性比较容易受到致病菌感染的抑制,免疫功能容易遭到破坏。攻毒6 d后,益生菌组的溶菌酶活性仍高于对照组,说明益生菌能够适当减少这种损害,使酶活性在相对较高的水平。刘洪展[10]用假交替单胞菌感染仿刺参后,体腔液溶菌酶的活力在短暂升高后显著降低,与该试验结果相一致。
[1]胡毅,谭北平,麦康森,等.饲料中益生菌对凡纳滨对虾生长、肠道菌群及部分免疫指标的影响[J].中国水产科学,2008,15(2):244 -251.
[2]桂远明.水产动物机能学实验[M].北京:中国农业出版社,2004.
[3]DAN H,HAKAN S,TORGNY R,et al.Insect Immunity:Purification and Properties of Three Inducible Bactericidal Proteinsfrom Hemolymph of Immunized Pupae of Hyalophoracecropia[J].European journal of chemibiology,1980,106:7 -16.
[4]SODERHALL K,CERENIUSL.Role of the prophenoloxidase -activating system in invertebrate immunity[J].Current opinion in immunology,1998,10(1):23-28.
[5]张艳婷.热灭活乳酸杆菌(HKLP)对刺参(Apostichopus japonicus)生长性能、消化酶活性、免疫力以及人工感染灿烂弧菌后免疫反应的影响[D].大连:大连海洋大学,2012.
[6]袁丰华.饲喂益生菌对尖吻鲈生长、消化、免疫及血液生理生化影响的研究[D].湛江:广东海洋大学,2009.
[7]王国霞,黄燕华,周晔,等.乳酸菌对凡纳滨对虾生长性能、消化酶活性和非特异性免疫的影响[J].动物营养学报,2010,22(1):228 -234.
[8]温俊.复合益生菌与酵母培养物对牙鲆(Paralichthy solivaceus)生长、免疫及抗病力的影响[D].青岛:中国海洋大学,2007.
[9]LI H,QIAO G,LI Q,et al.Biological characteristics and pathogenicityofa highly pathogenic Shewanella marisflavi infectedseacucumber(Apostichopus japonicus)[J].JFish Dis,2010,33:865 -877.
[10]刘洪展.养殖仿刺参对环境因子和病原的免疫应答及抗病分子机理[D].青岛:中国海洋大学,2012.
[11]李明.混合益生菌对刺参生长、免疫、消化和肠道菌群的影响[D].大连:大连海洋大学,2014.

