聚乙二醇-金纳米棒介导的近红外光热抑菌作用
冯晓燕 陈莹 刘玉鹏 王春鹏 储富祥
(中国林业科学研究院林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局林产化学工程重点开放性实验室;江苏省生物质能源与材料重点实验室,南京210042)
聚乙二醇-金纳米棒介导的近红外光热抑菌作用
冯晓燕 陈莹*刘玉鹏 王春鹏 储富祥
(中国林业科学研究院林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局林产化学工程重点开放性实验室;江苏省生物质能源与材料重点实验室,南京210042)
种子生长法合成纵向表面等离子体共振吸收峰为785 nm的金纳米棒,并对其表面进行聚乙二醇(PEG)修饰,研究了表面修饰PEG的金纳米棒(polyethylene glycol modified gold nanorods,PEG-GNR)的光热转化效应,并测试了其细胞毒性。以革兰氏阳性菌金黄色葡萄球菌、蜡状芽孢杆菌,革兰氏阴性菌大肠埃希氏菌及铜绿假单胞菌为细菌模型,详细研究了PEG-GNR在808 nm波长近红外激光照射下金纳米棒浓度和照射功率对抑菌效果的影响。结果表明,PEG-GNR对革兰氏阳性菌和革兰氏阴性菌在近红外照射下均有较好的抑菌效果,并且抑菌效果与金纳米棒的浓度和照射功率有着密切的关系;结合荧光显微镜和透射电子显微镜对细菌坏死状况的观察,初步证实细菌对PEG-GNR有效吸收是近红外光热杀菌的关键因素。
金纳米棒;PEG修饰;光热抑菌
细菌的耐药性已成为全球医疗领域中倍受关注的问题,多药耐药性细菌的出现严重威胁着人类的健康[1-2]。人们滥用抗生素导致多药耐药细菌的种类越来越多,现有抗菌药物的疗效越来越小,这是人类公共保健领域面临的最大挑战之一。激光光热疗法是利用外加能量在含有病变的组织中产生一定范围的高温,达到杀死病原体细胞而不伤害正常细胞的目的[3-6],由于没有特异性的靶目标,因而不易产生耐药性。用于光热疗法的激光主要使用可见光激光,但由于该波段激光对组织的穿透有限,因此激光热疗法具有一定的局限性[7]。近年来研究报道,利用光热转换材料,如有机光热染料吲哚菁绿或者贵金属和碳纳米材料,能够选择性地增强病变部位的热损伤从而提高治疗效果[8-11]。众所周知,金纳米棒是一类经典的光热转换材料,具有合适比率的金纳米棒在近红外区域对激光能量有强烈的吸收效应,选择与金纳米棒纵向表面等离子共振(LSPR)波长相匹配的近红外激光作为光源,能够诱导皮下深层组织的金纳米棒颗粒产生热效应,促使细胞致死[11-13]。由于生物组织在近红外区的光吸收很弱,金纳米棒因其独特的近红外光吸收性和光稳定性,能有效地代替光吸收染料在激光热疗中的应用。近年来,金纳米棒在肿瘤治疗光热疗法等方面得到了广泛的关注和研究[14-16],相比之下,金纳米棒在抗菌感染光热疗法的报道却很少见。由于激光光热疗法的抑菌机理与普通小分子抗生素的抑菌机理有着显著的不同,因此研究金纳米棒的近红外光热抑菌对于探索和解决细菌耐药性的问题有着十分重要的意义。鉴于此,本研究通过种子生长法制备获得了纵向等离子体峰为785 nm的金纳米棒,并用mPEG5000-SH对其进行了表面修饰,制备在生理条件下更稳定并有较长的体内循环时间的聚乙二醇修饰的金纳米棒(PEG-GNR),研究了在近红外光照射下PEG修饰的金纳米棒对各种测试菌(包括革兰氏阳性菌金黄色葡萄球菌(Staphylococcus aureus)、蜡状芽孢杆菌(Bacillus cereus)、革兰氏阴性菌大肠埃希氏菌(Escherichia coli)及铜绿假单胞菌(Pseudomonas aeruginosa)的抑菌效果。
1 实验部分
1.1 实验试剂与仪器
实验试剂:氯金酸(HAuCl4)、硼氢化钠(NaBH4)、十六烷基三甲基溴化铵(CTAB)、硝酸银(AgNO3)抗坏血酸、巯基化的聚乙二醇(mPEG5000-SH)为国产分析纯试剂;活死细胞试剂盒(LIVE/DEAD BacLight kit,美国);金黄色葡萄球菌(Staphylococcus aureus,S. aureus,CICC10384)、蜡状芽孢杆菌(Bacillus cereus,B.cereus,CICC10352)、大肠埃希氏菌(Escherichia coli,E.coli,CICC10354)和铜绿假单胞菌(Pseudomonas aeruginosa,P.aeruginosa,CICC10351)购自中国工业微生物菌种保藏管理中心。
仪器:紫外可见分光光度计(UV-1800 SPECTROPHOTOMETER,上海美谱达)、透射电子显微镜(TEM JEOL-1010,日本)、酶标仪(ChroMat4300,美国)、Zeta电位分析仪(Zetasizer nano-ZS,MALVERN,英国)、近红外光激光器(LE-LS-808-3000TFCA,深圳理欧光电公司)、荧光显微镜(Olympus X81,日本)。
1.2 聚乙二醇(PEG)修饰金纳米棒(PEG-GNR)的制备
金纳米棒溶液的制备[17]:6.25 mL二次蒸馏水中分别加入100 μL HAuCl4(0.01 mol·L-1)溶液,1.88 mL CTAB(0.2 mol·L-1)溶液,混合均匀后,再加入0.5 mL NaBH4(0.01 mol·L-1)溶液,加完后剧烈摇晃,得到棕黄色的溶液,即为金纳米棒的种子溶液,将它置于30℃恒温条件下静置2 h,待用。在另一容器中分别加106.9 mL的二次蒸馏水,7.425 mL HAuCl4(0.01 mol·L-1)溶液和106.4 mL CTAB(0.2 mol·L-1)溶液,混合均匀后加入1.35 mL AgNO3(0.01 mol·L-1)和1.35 mL抗坏血酸(0.1 mol·L-1)溶液,该溶液为生长液,待此溶液变为无色后,加入1.8 mL上述金纳米棒的种子溶液,混合均匀,30℃恒温条件下静置过夜,即得金纳米棒溶液(CTAB-GNR)。将所得的金纳米棒溶液置于4℃条件下静置4 h,析出溶液中多余的CTAB分子,然后通过高速离心处理去除溶液中残余的自由CTAB分子,并将溶液浓缩30倍(原子吸收光谱测得金溶液浓度最终为160.5 μg·mL-1),超声分散后与巯基化的聚乙二醇(mPEG5000-SH)溶液混合,mPEG5000-SH的最终浓度为2.0 mg·mL-1,静置,过夜。最终所得的棕红色溶液即为聚乙二醇(PEG)修饰的金纳米棒(PEG-GNR)溶液,备用。
1.3 PEG-GNR的光热转换效应的测定
将制得的PEG-GNR溶液用二次蒸馏水稀释到金浓度分别为2.41、3.21、4.82和9.63 μg·mL-1,各取1 mL溶液,用波长为808 nm的近红外光激光照射上述各个浓度的PEG-GNR溶液22 min,定时记录溶液的温度,绘制近红外光热转换曲线。
1.4 PEG-GNR体外细胞毒性测试
利用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)法测试CTAB-GNR和PEG-GNR的细胞毒性。首先将小鼠胚胎成纤维细胞(NIH/3T3细胞)接种于96孔板,24 h后,把CTAB-GNR和PEGGNR溶液分别按照10,15,20,25和30 μL的体积分别加到各组细胞中,培养24 h后,每孔加入10 μL MTT溶液,4 h后分别向各孔加入150 μL DMSO溶液,最后使用酶标仪在波长570 nm处测定各孔的吸光度,计算细胞存活率。
1.5 PEG-GNR抑菌实验
配置新鲜测试菌(金黄色葡萄球菌、蜡状芽孢杆菌、大肠埃希氏菌及铜绿假单胞菌)溶液,调节细菌密度约为106CFU·mL-1。在96孔板各个测试孔中加入100 μL上述菌液,然后在不同的培养组中分别加入3、4、6、12 μL的PEG-GNR(160.5 μg·mL-1)溶液之后,补充一定体积的培养液使每个培养孔中的液体体积固定为200 μL。设置空白对照组、金纳米棒组和金纳米棒照射组(1 W和2 W),每组3复孔,于恒温37℃培养箱中培养4 h后,用设定的输出功率近红外激光照射,每孔5 min,然后37℃再培养18 h后,用酶标仪测试各孔的600 nm处的吸光值(OD600nm)。
1.6 细菌坏死实验检测
取1 mL新鲜大肠埃希氏菌菌液(106CFU· mL-1),加入50 μL PEG-GNR(160.5 μg·mL-1)溶液,37℃恒温条件下培养2 h,高速离心处理去除培养液后用已消毒处理二次蒸馏水稀释分散至1 mL。取200 μL上述菌液加96孔板中,用808 nm波长的近红外激光(1 W)照射5 min后,利用活死细菌染色试剂盒(LIVE/DEAD BacLight kit)对活死细菌进行染色,室温避光静置15 min后,取10 μL溶液用于荧光显微镜观察。
1.7 细菌表面吸附情况检测
取2mL新鲜大肠埃希氏菌菌液(108CFU·mL-1),高速离心去除上层培养液,用已消毒处理的二次蒸馏水将其稀释分散至1 mL后,加入0.3 mL PEGGNR(160.5 μg·mL-1)溶液,37℃恒温条件下培养2 h。使用透射电子显微镜专用铜网制备样品并在室温条件下晾干,在透射电子显微镜下观察。
2 结果与讨论
2.1 PEG-GNR的制备

图1 (A)CTAB稳定的金纳米棒透射电镜图片;(B)表面修饰PEG的金纳米棒透射电镜图片(C)CTAB稳定的金纳米棒及表面修饰PEG的金纳米棒的紫外吸收光谱图Fig.1(A)TEM image of CTAB-gold nanorods;(B)TEM image of PEG-GNR;(C)UV-Vis spectra of CTAB-GNR and PEG-GNR
本研究采用“晶种生长”(种子生长)的方法,使用高浓度的CTAB(0.2 mol·L-1)为模板剂和稳定剂制备了CTAB分子稳定的金纳米棒。图1A为制备的金纳米棒的透射电子显微镜照片,显示其平均长度约为42 nm,宽约为11 nm,长径比约为3.8∶1;由紫外可见吸收光谱图(图1C)数据可知其横向表面等离子体共振吸收峰(TSPR)为525 nm,纵向表面等离子体共振吸收峰(LSPR)为785 nm,因此已达到了近红外区。由于在金纳米棒的制备过程中,使用了大量的表面活性剂CTAB,自由的CTAB分子对细胞、蛋白质等生物分子具有生物毒性,限制了金纳米棒在医学等领域的广泛应用[18-20]。本研究中为了消除CTAB的毒性影响和增加金纳米棒的生物相容性,采用巯基化的聚乙二醇(mPEG5000-SH)修饰金纳米棒。据文献报道,相对于其他一般功能键,金属-巯基键的键合力较强,生物分子聚乙二醇可以功能化一个脂肪巯基作为连接链,通过Au-S键键合到金纳米棒上,可以使去除CTAB的金纳米棒保持稳定[5,21]。由图1B观察到金纳米棒经过mPEG5000-SH分子修饰后的金纳米棒基本保持原有的形貌,紫外可见吸收光谱数据显示金纳米棒在与mPEG5000-SH键合反应后,其横向和纵向表面等离子体共振吸收峰发生轻微蓝移,这是由于金纳米棒周围的溶液环境发生变化引起折射系数改变[22],但mPEG5000-SH对金纳米棒的修饰后并没有改变金纳米棒特有的光学性质。虽然有文献报道PEG在金纳米棒表面不能完全替代CTAB分子[23],但是本研究中5 000分子量的PEG有一个10 nm的水合长度,这比CTAB的双分子层长[24],聚合物的刷子构像可以在未取代的CTAB外面形成一个交联层,这样就减少了正电的CTAB潜在的非特异性蛋白吸附,不但增强了金纳米棒的生物相容性,还可以在高离子强度的环境中稳定纳米棒[25]。为了进一步证实PEG对金纳米棒的成功修饰,通过测试金纳米棒修饰前后的ζ电位,发现修饰后的金纳米棒的表面电荷由原来的+40.3 mV降低到+19.6 mV,也就是说金纳米棒表面的大部分的带有正电荷的CTAB分子被无电荷PEG取代,屏蔽了一部分正电荷,使得金纳米棒的表面电荷降低。经过PEG修饰的金纳米棒溶液可以保持两周以上的稳定存在,并且其特有的光学性质也保持不变。
2.2 PEG-GNR的光热转换效应
为了进一步证实PEG表面修饰后的金纳米棒具有良好的光热转化性能,我们研究了不同浓度的PEG-GNR溶液的光热转换效应。图2A和B分别为1 mL不同浓度的PEG-GNR溶液(9.63、4.82、3.21、2.41 μg·mL-1)在输出功率为1 W和2 W,照射面积为0.385 cm2,波长为808 nm的近红外激光照射下溶液温度与照射时间的关系曲线。如图2所示,各浓度的PEG-GNR溶液在近红外激光照射下立即产生热效应,表现为溶液温度逐步升高;温度的升高大致可分为3个阶段,首先是快速升高,然后逐渐变缓,最后保持不变。值得注意的是,溶液温度的变化幅度是随着PEG-GNR溶液的浓度和激光照射功率的增大而增大的。当激光器的输出功率为2 W,金纳米棒的浓度高于4.82 μg·mL-1时,溶液照射后的最高温度可达到60℃以上。由此看来,通过改变PEG-GNR溶液的浓度、激光照射功率或者激光照射时间,可以控制金纳米棒的光热转换速度及升温幅度,促使局部过高热,从而达到所需的理想有效的杀菌和抑菌效果。
2.3 PEG-GNR体外细胞毒性
利用MTT法我们评估了PEG-GNR的体外细胞毒性,分别测试了不同体积用量的PEG-GNR和CTAB-GNR溶液对小鼠胚胎成纤维细胞NIH/3T3细胞的相对存活率的影响。由图3可知,在PEG-GNR各体积用量下,细胞的存活率都基本维持在90%以上,即使当用量为30 μL时,NIH/3T3细胞仍然具有很高的细胞存活率。而相对应的未经PEG修饰的CTAB稳定的金纳米棒,它对NIH/3T3细胞具有较高的毒性,细胞存活率很低。这一结论说明,经过PEG对金纳米棒表面的修饰,能够大大改善金纳米棒的细胞毒性,有利于金纳米棒的进一步生物利用。
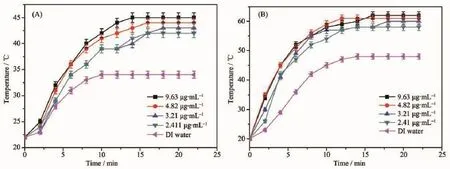
图2 PEG-GNR在近红外激光输出功率为(A)1 W和(B)2 W时的光热转换效应曲线Fig.2Photothermal conversional effect curve of PEG-GNR under the radiation of NIR laser with the output power(A)1 W and(B)2 W
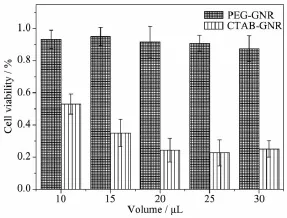
图3 PEG-GNR和CTAB-GNR对细胞的体外细胞毒性Fig.3In vitro cytotoxicity of PEG-GNR and CTAB-GNR against NIH/3T3 cells
2.4 近红外光照对细菌的抑制作用
为了考察PEG-GNR在近红外激光照射后对细菌生长的抑制作用,本研究选取大肠埃希氏菌和铜绿假单胞菌为革兰氏阴性菌测试模型,金黄色葡萄球菌和蜡状芽孢杆菌为革兰氏阳性菌测试模型,详细研究了PEG-GNR溶液对这4种菌的抑菌效果。实验中设置了空白对照组(Control),金纳米棒无激光照射组(PEG-GNR group),激光输出功率为1 W的金纳米棒激光照射组(1 W NIR group)和输出功率为2 W的金纳米棒激光照射组(2 W NIR group)4个实验测试组。考虑到细菌对PEG-GNR的吸附或者胞吞需要一定时间,在激光照射前对细菌和PEGGNR溶液进行了预先共培养2 h,确保细菌细胞对PEG-GNR的有效吸收和吸附。图4是不同测试菌与PEG-GNR溶液(9.63 μg·mL-1)共培养2 h后,激光照射5 min后再培养18 h的菌液OD600nm吸光值对比图。如图4所示,与空白对照组相比,金纳米棒无激光照射组OD600nm吸光值仅仅略微减小,表明PEG修饰的金纳米棒本身在无激光照射的情况下对各类细菌仅有微弱的抑制生长作用,但并未达到完全抑菌的效果。然而另一方面,金纳米棒激光照射组却表现出对所有测试菌株都具有较好的抑制生长效果。图4中,两组激光照射组(1 W和2 W)无论是对革兰氏阴性测试菌还是革兰氏阳性测试菌均表现出极显著的抑菌效果,激光照射后再培养18 h,溶液OD600nm的吸光值仍然几乎为零,也就是说测试菌与金纳米棒共培养后经过1 W(或以上)激光照射后几乎不再生长。根据图4的结果,当PEG-GNR溶液浓度为9.63 μg·mL-1时,输出功率为1 W的激光照射5 min即可达到理想的抑菌效果。
2.5 PEG-GNR溶液浓度对抑菌效果的影响
图5A和B为激光照射输出功率分别为1 W和2 W时,不同浓度的PEG-GNR溶液对各种测试细菌的抑制生长的情况。由图可见,随着浓度的增加PEG-GNR抑菌作用更加明显。表1中总结了2种照射功率下PEG-GNR对测试菌的最低抑制浓度(MIC,μg·mL-1)。结果表明,PEG-GNR溶液浓度和激光照射功率对细菌的抑菌效果都起着决定性的作用。
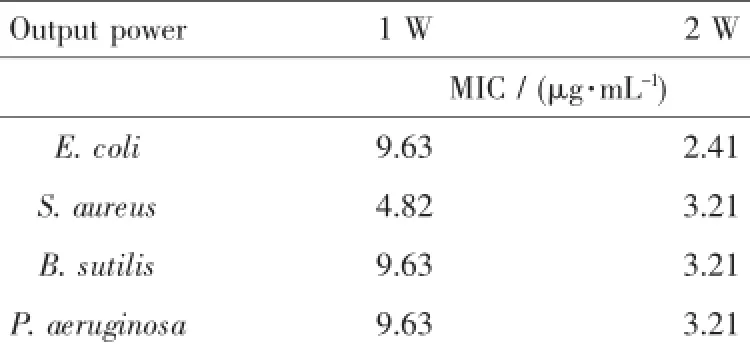
表1 近红外激光照射下PEG-GNR对不同菌的最低抑制浓度(MIC)Table 1Minimum inhabitation concentration(MIC) of the PEG-GNR to the different bacterium under the radiation of NIR laser
2.6 细菌坏死实验检测
我们对PEG-GNR介导的近红外光热杀菌机理进行了简单的初步探索。这里使用了活死细菌染色试剂盒(LIVE/DEAD BacLight kit)对各组细菌样品进行染色处理,经过染色后的死菌和活菌会在荧光显微镜下分别呈现红色及绿色,便于我们观察PEGGNR介导的近红外光热杀菌的情况。图6中,A图是空白对照组,B图是大肠埃希氏菌与PEG-GNR溶液混合后,未经过预培养直接用激光照射(1 W)5 min后得到的细菌样品的荧光显微镜图片,图中呈现的细菌基本都为绿色,没有出现死亡的现象;C图是菌液和PEG-GNR溶液共培养了2 h后但没有使用激光照射的细菌样品的荧光显微镜图片,同样细菌仍然基本呈现绿色,证实了PEG-GNR本身对细菌并没有杀菌作用,这与图4中所呈现的抑菌效果的结果是相符合的;D图菌液和荧光显微镜溶液共培养了2 h后用激光照射(1 W)5 min后的细菌样品的图片,可以观察到所有的细菌都呈现红色死亡状态,利用透射电子显微镜可以观察到细菌与PEG-GNR共培养2 h后,细菌的细胞膜表面几乎完全被PEG-GNR吸附(图7)。因此,我们认为PEGGNR介导的近红外光热杀菌的一个必要条件是细菌对PEG-GNR的有效吸附,只有当细菌吸附或吸收了PEG-GNR后,PEG-GNR通过近红外光的介导在细菌内部产生高能量的热量,才能使细胞致死。
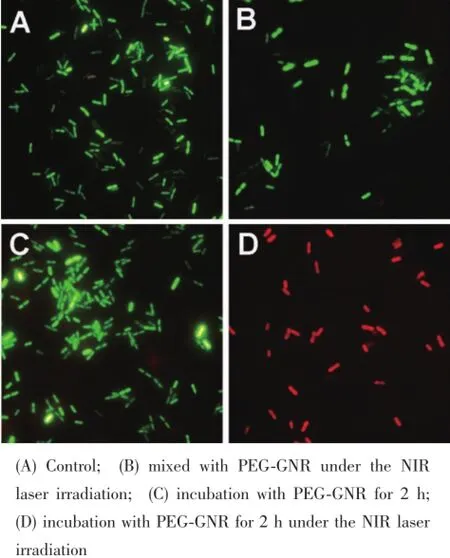
图6 细胞坏死情况荧光显微镜图片Fig.6FM images of the E.coli stained with the LIVE/ DEAD BacLight kit:

图7 细菌与PEG-GNR共培养2 h后细菌的电镜照片Fig.7TEM image of E.coli incubated with PEG-GNR for 2 h
3 结论
采用种子生长法,制备了LSPR为785 nm的金纳米棒,并对其表面进行了PEG修饰。研究表明,表面修饰PEG的金纳米棒对革兰氏阳性菌和革兰氏阴性菌在近红外照射下均有较好的抑菌效果,并且抑菌效果与金纳米棒的浓度和照射功率有着密切的关系;细菌坏死实验证实细菌对PEG-GNR有效吸收是近红外光热杀菌的关键因素。因此,表面修饰聚乙二醇的金纳米棒介导的近红外光热法能够有效的抑制细菌生长。由于抑菌机理与传统的抗生素有着显著的区别,近红外光热抑菌法的进一步研究与发展可能会为细菌耐药性问题提供新的解决思路。
[1]Coenye T,Vandamme P.Environ.Microbiol.,2003,5(9):719-729
[2]Nikoobakht B,El-Sayed M A.Chem.Mater.,2003,15(10): 1957-1962
[3]SONG Wen-Zhi(宋文植),JIANG Ya-Ping(姜雅萍),JI Xiao-Hui(纪小会),et al.Chem.J.Chinese Universities(高等学校化学学报),2012,33(9):1886-1888
[4]Jo W,Freedman K,Yi D K,et al.Biofabrication,2011,3(1): 15002
[5]Niidome T,Akiyama Y,Yamagata M,et al.J.Biomater.Sci., Polym.Ed.,2009,20(9):1203-1215
[6]Letfullin R R,Joenathan C,George T F,et al.Nanomedicine, 2006,1(4):473-480
[7]QU Xiao-Chao(屈晓超),LIANG Jia-Ming(梁佳明),YAO Cui -Ping(姚翠萍),et al.Chin.J.Lasers(中国激光),2008,34 (11):1459-1465
[8]ZHENG Ming-Shan(郑明彬),ZHENG Cui-Fang(郑翠芳), GONG Ping(龚萍),et al.Prog.Biochem.Biophys.,2013,40 (10):971-976
[9]ZHANG Da(张达),ZHOU Fei-Fan(周非凡),XING Da(邢达). Chin.Sci.Bull.(科学通报),2013,58(7):586-592
[10]WU Song(吴松),XIAO Shao-Wen(肖绍文),LU Gui-Hua(卢桂花),et al.Chin.J.New Clin.Med.(中国临床新医学), 2013,6(6):531-534
[11]Kim J W,Shashkov E V,Galanzha E I,et al.Laser.Surg. Med.,2007,39(7):622-634
[12]Cho E C,Au L,Zhang Q,et al.Small,2010,6(4):517-522
[13]Huang W,Tsai P,Chen Y.Nanomedicine,2007,2(6):777-787
[14]Guo R,Zhang L,Qian H,et al.Langmuir,2010,26(8):5428-5434
[15]Cai W,Gao T,Hong H,et al.Nanotechnol.Sci.Appl.,2008, 3(1):17-22
[16]Ferrari M.Nat.Rev.Cancer,2005,5(3):161-171
[17]Nikoobakht B,El-Sayed M A.Chem.Mater.,2003,15(10): 1957-1962
[18]Alkilany A M,Murphy C J.J.Nanopart.Res.,2010,12(7): 2313-2333
[19]Nativo P,Prior I A,Brust M.ACS Nano,2008,2(8):1639-1644
[20]Takahashi H,Niidome Y,Niidome T,et al.Langmuir,2006, 22(1):2-5
[21]Niidome T,Yamagata M,Okamoto Y,et al.J.Controlled Release,2006,114(3):343-347
[22]Cai Z Y,Liu Y J,Lu X M,et al.J.Phys.Chem C,2013, 117(18):9440-9445
[23]Niidome T,Ohga A,Akiyama Y,et al.Bioorg.Med.Chem., 2010,18(12):4453-4458
[24]Dickerson,Erin B,Dreaden,et al.Cancer Lett.,2008,269 (1):57-66
[25]Moghimi S M,Hunter A C.Trends Biotechnol.,2000,18 (10):412-420
Near-IR Photothermal Antibacterial Effects of Polyethylene Glycol(PEG)Modified Gold Nanorods
FENG Xiao-YanCHEN Ying*LIU Yu-PengWANG Chun-PengCHU Fu-Xiang
(Institute of Chemical Industry of Forestry Products,CAF China;Key Laboratory of Biomass Energy and Material, Jiangsu Province China;National Engineering Laboratory for Biomass Chemical Utilization China; Key and Open Laboratory on Forest Chemical Engineering,SFA,Nanjing 210042,China)
Gold nanorods(GNR)with longitudinal surface plasma resonance(LSPR)absorption at 785 nm were synthesized by seed-mediated growth method and their surface was modified with polyethylene glycol(PEG) macromolecular(PEG-GNR).The photothermal conversion effect and cytotoxicity of PEG-GNR were investigated. Different bacteria,including gram-positive bacterium Staphylococcus aureus and Bacillus cereus,gram-negative bacterium Escherichia coli and Pseudomonas aeruginosa were used to analyze the influences of concentration of PEG-GNR and laser output power on the inhibition effects.The results show that the PEG-GNR has good antibacterial properties for both Gram positive and negative bacterium under the radiation of near-IR laser.The concentration of PEG-GNR and laser output power determined antibacterial effects of the PEG-GNR.The preliminary investigation on the antibacterial mechanism was explored by studying of bacteria apoptosis status with fluorescence microscope and transmission electronic microscope,suggesting that the effective absorption of the PEG-GNR by the cells is one of the key factors in the process of photothermal antibiosis.
gold nanorod;PEG modified;photothermal antibacterial effect
TQ131.2
A
1001-4861(2015)02-0215-07
10.11862/CJIC.2015.059
2014-04-21。收修改稿日期:2014-12-02。
中央级公益性科研院所基本科研业务费专项资金(No.CAFINT2010K04),国家自然科学基金(No.31100427)和江苏省自然科学基金(No.BK20131071)资助项目。
*通讯联系人。E-mail:yingchencaf@gmail.com

