聚3,4-乙撑二氧噻吩/金复合电极的制备及其在多巴胺检测中的应用
王保光,邱吟,胡海峰,张雪华,何声太,贺涛
(1.国家纳米科学中心,北京 100190;2.天津工业大学 材料科学与工程学院,天津 300387)
多巴胺(DA)是哺乳动物中枢神经系统中非常重要的信息传递物质,缺乏DA 可导致一些重要疾病,如精神分裂症和帕金森氏症[1],所以对DA 含量的测定在生理功能和临床应用等方面具有重要意义。目前,测定DA 的方法主要有电化学法[2-6]、化学发光法[7]、高效液相色谱法[8-10]、表面等离子体共振法[11-13]、表面增强拉曼法[14-15]以及荧光法[16-17]等。电化学方法具有易于操作、价格低廉、灵敏度高和选择性好等优点,尤其是微型电化学探针能够进行活体在线分析,但易受AA 的干扰。因此,如何在高浓度AA 共存时选择性测定DA 便成为电化学分析研究的重要课题之一[18]。
聚3,4-乙撑二氧噻吩(PEDOT)具有电导率高、在生理环境下能稳定存在、易制备等优点,在电化学传感器领域得到了广泛应用。Vasantha 等[19]以PEDOT 修饰的玻碳电极分析DA,有效避免了AA 影响。金纳米颗粒(Au NPs)具有高导电性、良好的稳定性和生物相容性,对化学反应具有良好的催化性能,在电化学传感器中引入Au NPs,可以有效促进电子传递和反应的可逆性,提高检测分析的灵敏度[20]。Zheng 等[21]采用花状的Au 纳米结构修饰电极,实现了对DA 和AA 的同时检测,DA 和AA 分别在1 ~1.5 ×10-4mol/L 和6 ~50 ×10-5mol/L 具有良好的线性范围,检测限分别为2 ×10-7mol/L 和1×10-5mol/L。
本文在对甲苯磺酸钠水溶液中,采用电化学方法,在氧化铟锡导电玻璃上制备了PEDOT/Au 复合修饰电极,用于DA 的电化学检测。研究了Au NPs沉积量对PEDOT/Au 复合修饰电极对DA 电化学检测的影响,并研究了PEDOT/Au 复合修饰电极在AA 和尿酸(UA)共存下对DA 电化学检测的灵敏性和选择性。
1 实验部分
1.1 材料与仪器
3,4-乙撑二氧噻吩(EDOT,二次减压蒸馏后放入冰箱中备用)、对甲苯磺酸钠、四氯金酸(HAuCl4)、硝酸钾、抗坏血酸(AA)、尿酸(UA)、多巴胺盐酸盐、丙酮、异丙醇、磷酸盐缓冲溶液(PBS)等均为分析纯;ITO 导电玻璃;Milli-Q 超纯水(18.2 MΩ·cm)。
Hitachi S-4800 冷场发射扫描电子显微镜;Tecnai G2 F20 U-TWIN 场发射透射电子显微镜;CS300型电化学工作站(对电极为Pt 片,参比电极为饱和甘汞电极,实验前均将溶液通氮气除氧20 min)。
1.2 PEDOT/Au 复合修饰电极的制备
ITO 导电玻璃依次用洗涤剂、丙酮、异丙醇、二次水和三次水进行超声处理各15 min,然后氮气吹干。电化学恒电位极化(1.0 V)进行聚合,制备PEDOT 修饰电极,EDOT 单体浓度为0.01 mol/L,0.1 mol/L的对甲苯磺酸钠为支持电解质,ITO 导电玻璃为工作电极,聚合时间为50 s。然后将PEDOT电极置于含6 mmol/L HAuCl4和0.1 mol/L KNO3的电解液中,在-0.6 ~1.0 V 电位范围内,采用循环伏安(CV)法沉积Au NPs。扫描速率为50 mV/s,沉积扫描1 圈、3 圈、5 圈和7 圈,所制备的PEDOT/Au 复合修饰电极分别标记为PEDOT/Au-1c,PEDOT/Au-3c,PEDOT/Au-5c 和PEDOT/Au-7c。沉积结束后,依次采用三次水和无水乙醇清洗电极表面,高纯氮气吹干后,保存在干燥箱中备用。
1.3 检测方法
将PEDOT/Au 复合修饰电极置入含有一定浓度DA 的0.1 mol/L 的PBS 溶液(pH=7.2)中,静止30 s,进行CV 或差分脉冲伏安(DPV)测试。DPV测试时参数设置为:扫描范围-0.3 ~0.7 V (vs.SCE),振幅50 mV,脉冲宽50 ms,脉冲周期0.2 s,电位增量4 mV。所有电化学试验中工作电极的几何面积保持一致,且均在室温(25 ℃)下进行。
2 结果与讨论
2.1 PEDOT/Au 复合修饰电极的形貌与结构表征
PEDOT 修饰电极的表面形貌SEM 见图1。

图1 PEDOT(a),PEDOT/Au-1c(b)和PEDOT/Au-5c(c)的扫描电镜图Fig.1 SEM images of PEDOT(a),PEDOT/Au-1c(b)and PEDOT/Au-5c (c)
由图1 可知,PEDOT 呈多孔花瓣状,紧贴ITO表面生长。由图1b 和图1c 可知,PEDOT/Au-1c 和PEDOT/Au-5c 复合修饰电极的Au NPs 依附于PEDOT 的表面沉积,随着沉积量(即扫描圈数)的增加,Au NPs 的分布越来越致密,形成Au NPs 的颗粒团簇(岛状结构)。
图2 为PEDOT/Au-5c 修饰电极的EDS 能谱图。

图2 PEDOT/Au-5c 的EDS 能谱图Fig.2 EDS images of PEDOT/Au-5c
由图2a 可知,Au NPs 均匀分布在PEDOT 表面。图2b 竖线代表Au NPs 的分布情况,线越密越高,代表Au NPs 的含量越高,可看出白色颗粒区域(Au NPs 的颗粒团簇)Au NPs 的含量较高。
图3 为PEDOT/Au-5c 修饰电极的TEM 图。

图3 PEDOT/Au-5c 的透射电镜图Fig.3 TEM images of PEDOT/Au-5c
由图3 可知,Au NPs 的单个颗粒大小约为20 nm。
表1 为根据PEDOT/Au 修饰电极的EDS 能谱得出的Au NPs 的含量。

表1 PEDOT/Au 复合修饰电极中Au NPs 的含量Table 1 Content of Au NPs in different PEDOT/Au composite electrodes
由表1 可知,随着沉积圈数的增加,Au NPs 的含量增加。
2.2 PEDOT/Au复合修饰电极对DA 的电催化响应
图4 为在pH=7.2 的PBS 缓冲溶液中,扫描速率为100 mV/s 时,DA 在不同修饰电极上的CV 谱图。

图4 DA 在ITO、PEDOT 和PEDOT/Au 复合电极上的CV 曲线Fig.4 CV curves of DA on ITO,PEDOT and PEDOT/Au-5c electrodes
由图4 可知,相对于ITO 导电基底,DA 在PEDOT 修饰电极上的氧化还原峰电流明显增强。在PEDOT 电极上进一步沉积Au NPs,制备PEDOT/Au复合修饰电极后,由于Au NPs 对DA 氧化还原反应的催化以及Au NPs 良好的导电性,使DA 的氧化还原峰电流进一步增强。DA 在PEDOT/Au-5c 复合修饰电极上具有最强的电化学响应。但是,当Au NPs CV 沉积扫描圈数由5 圈增加为7 圈(Au 沉积量的增加)时,DA 的氧化还原峰电流开始降低。原因可能为制备PEDOT/Au 复合修饰电极是采用分步沉积法,即先制备PEDOT 电极,然后在PEDOT 电极表面进一步沉积Au NPs,SEM 表征表明,大部分Au NPs 团簇沉积在PEDOT 的表面,这将减少PEDOT 与DA 相互作用的电化学活性位点。当Au NPs沉积量达到一定程度时,覆盖活性位点带来的负面作用将大于其带来的正面促进作用,表现为DA 的氧化还原峰电流不再增加,而且开始降低。
2.3 pH 和扫描速率对DA 检测的影响
图5 为在不同pH 值(pH = 6.35 ~8)的PBS缓冲液中,扫描速率为100 mV/s,DA(0.5 mmol/L)在PEDOT/Au 复合修饰电极上的CV 谱图。

图5 不同pH 值条件下DA 在PEDOT/Au-5c 复合电极上的CV 谱图Fig.5 CV curves of DA on PEDOT/Au-5c composite electrode with different pH value
由图5 可知,DA 的氧化还原峰电位随着缓冲溶液pH 值的增加而逐渐负移,并与PBS 缓冲溶液pH 值的变化呈线性关系(图6),表明质子在DA 的氧化反应过程中起着决定作用,pH 值与氧化峰电位的线性关系为EPO=-0.056pH + 0.613,直线斜率为56.04 mV/pH。说明DA 的氧化中涉及的是2 电子和2 质子(2e-/2H+)的反应,与文献报道一致[22-24]。

图6 DA 的氧化电位与pH 的线性关系图Fig.6 The relationship between the anodic peak potential of DA and the pH value
图7 为不同扫描速率下DA (0.5 mmol/L,pH=7.2 的PBS 缓冲溶液)在PEDOT/Au 复合修饰电极上的CV 曲线。

图7 不同扫描速率下DA 在PEDOT/Au-5c 复合电极上的CV 谱图Fig.7 CV curves of DA on PEDOT/Au-5c composite electrode at different scan rates
由图7 可知,在20 ~500 mV/s 扫描速率范围内(20,50,80,100,120,150,200,300,400,500 mV/s),随着扫描速率的增加,DA 的阳极氧化峰电位逐渐正移,相应的阴极还原峰电位逐渐负移。由图8 可知,DA 在PEDOT/Au 复合修饰电极上的氧化峰电流与扫描速率呈很好的线性关系,线性方程为iPO=2.65×10-4+4.43 ×10-6V,(R2=0.99)。因此,DA 在PEDOT/Au 复合修饰电极上的氧化还原反应主要为表面控制过程[24]。
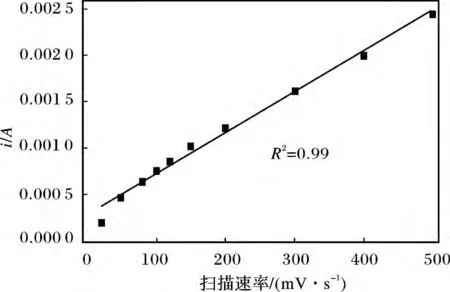
图8 扫描速率与DA 的氧化峰电流密度间的线性关系图Fig.8 The relationship between the scan rate and the anodic peak current of DA
2.4 PEDOT/Au 复合修饰电极选择性检测DA
图9a 为pH 值为7.2 的PBS 缓冲溶液中,不同浓度的DA(1,2,3,5,10,20,50,80,100,150,250,300,500,800,1 000 ×10-6mol/L)在PEDOT/Au 复合修饰电极上的DPV 检测曲线,图9b 为氧化峰电流与DA 浓度间的线性关系曲线,其线性范围为5 ×10-6~1 ×10-4mol/L,相关系数为0.988 1,检出限为1 × 10-8mol/L(S/N =3),灵敏度为1.483 4 ×10-6A/10-6mol/L。因此,DA 在该修饰电极上具有良好的线性范围和较低的检测限。由于DA 在生理条件下的浓度范围为10-8~10-6mol/L,所以该电极可在生理环境下用于DA 的检测。

图9 不同浓度的DA 在PEDOT/Au-5c 复合电极上的DPV图(a),氧化峰电流与其浓度的线性关系图(b)Fig.9 DPV curves of different concentration of DA on PEDOT/Au-5c composite electrode(a),the relationship between the anodic peak current and its concentration(b)
图10 为在pH 值为7.2 的PBS 缓冲溶液中,0.5 mmol/L AA 共存下,不同浓度的DA(2,4,8,20,40,50,80,100,200,400,500,1 000 ×10-6mol/L)在PEDOT/Au 复合修饰电极上的DPV 检测曲线。

图10 AA 和不同浓度的DA 在PEDOT/Au-5c 复合电极上的DPV 曲线(a),DA 的氧化峰电流与其浓度的线性关系图(b)Fig.10 DPV curves of AA and different concentrations of DA on PEDOT/Au-5c composite electrode(a),the relationship between the anodic peak current of DA and its concentration(b)
由图10 可知,AA 的氧化峰电位比DA 的负,两者氧化峰峰位相差约220 mV,可同时检测。随着DA 浓度的增加,DA 的氧化峰电流逐渐增强,峰电流值与DA 的浓度呈线性相关,线性回归方程为ipa(mA)=0.356 +7.856 ×10-4CDA(10-6mol/L),相关系数为0.975 8,表明该修饰电极在AA 共存下对DA 有良好的响应。同时发现,随着DA 浓度的增加,AA 的氧化峰电流发生轻微变化,且呈无规律,但不影响修饰电极对DA 的检测。
图11 为pH 值7.2 的PBS 缓冲溶液中,在0.5 mmol/L AA 和0.1 mmol/L UA 共存下,PEDOT/Au 复合修饰电极对不同浓度DA(20,40,100,200,300,500,1 000 ×10-6mol/L)的DPV 检测曲线。
由图11 可知,UA 的氧化峰位置比DA 的氧化峰位置较正,两者相差约141 mV,UA 对高浓度DA的检测没有影响,可以同时进行检测。

图11 AA、UA 和不同浓度的DA 在PEDOT/Au-5c 复合电极上的DPV 曲线(a),DA 的氧化峰电流与其浓度的线性关系图(b)Fig.11 DPV curves of AA,UA and different concentrations of DA on PEDOT/Au-5c composite electrode(a),the relationship between the anodic peak current of DA and its concentration(b)
3 结论
(1)采用电化学方法将PEDOT 和Au NPs 复合,制备了PEDOT/Au 复合修饰电极,并用于多巴胺的电化学检测。Au NPs 负载在花瓣状的PEDOT上,可改善其导电性,不仅可为DA 的电化学反应提供活性位点,而且还促进了PEDOT 与溶液中DA 间的电子传递。随着沉积Au NPs 圈数的增加,在PEDOT 表面上形成了大小不一(凸凹不平)的Au NPs的岛状结构。在中性pH 值溶液中,PEDOT/Au 复合修饰电极对DA 的检测效果受Au NPs 沉积量的影响较大。
(2)采用DPV 方法对DA 进行电化学检测时,优化后的PEDOT/Au 复合修饰电极对DA 的检测限为1 ×10-8mol/L,可有效排除AA 和UA 的干扰,实现DA、AA 和UA 的同时检测,表现出了较高的选择性和灵敏度,有望制成微电极用于DA 活体的在线分析。
[1] Sun C L,Lee H H,Yang J M,et al.The simultaneous electrochemical detection of ascorbic acid,dopamine,and uric acid using graphene/size-selected Pt nanocomposites[J].Biosens Bioelectron,2011,26(8):3450-3455.
[2] Zhang X,Wang B,Zhang X H,et al.Dopamine detection with multilayer thin film prepared by using polyacrylicacid-coated nano-ceria via layer-by-layer assembly[J].Sensor Actuat B,2012,166/167:695-701.
[3] Xue L,Guo L H,Qiu B,et al.Mechanism for inhibition of Ru(bpy)32 + /DBAE electrochemiluminescence system by dopamine[J].Electrochem Comm,2009,11(8):1579-1582.
[4] Li H,Li C,Yan Z Y,et al.Simultaneous monitoring multiple neurotransmitters and neuromodulators during cerebral ischemia/reperfusion in rats by microdialysis and capillary electrophores[J].J Neurosci Methods,2010,189(2):162-168.
[5] 韩晓霞,高作宁.多巴胺和抗坏血酸在CPB 现场修饰玻糊电极上的电化学及电化学动力学性质[J].分析测试学报,2007,26(5):612-616.
[6] 王保光,张鑫,张雪华,等.多巴胺电化学检测研究进展[J].应用化工,2013,42(12):2267-2270.
[7] 胡玉斐,章竹君.基于植物组织化学发光法测定血液中的游离多巴胺[J].化学学报,2008,66(7):783-787.
[8] Jaquins-Gerstl A,Shu Z,Zhang J,et al.Effect of dexamethasone on gliosis,ischemia,and dopamine extraction during microdialysis sampling in brain tissue[J].Anal Chem,2011,83(20):7662-7667.
[9] 于世林.高效液相色谱方法及其应用[M].北京:化学工业出版社,2005:100-200.
[10]马奎蓉,权迎春,秦元满.手性荧光衍生化反相高效液相色谱法分析多巴胺[J].分析测试学报,2005,24(2):73-75.
[11] Zheng Y,Wang Y,Yang X.Aptamer-based colorimetric biosensing of dopamine using unmodified gold nanoparticles[J].Sens Actuators B Chem,2011,156(1):95-99.
[12]Zhang Y,Li B,Chen X.Simple and sensitive detection of dopamine in the presence of high concentration of ascorbic acid using gold nanoparticles as colorimetric probes[J].Microchim Acta,2010,168(1/2):107-113.
[13]Kong B,Zhu A,Luo Y,et al.Sensitive and selective colorimetric visualization of cerebral dopamine based on double molecular recognition[J].Angew Chem Int Ed,2011,50(8):1837-1840.
[14]Schlücker S.Surface Enhanced Raman Spectroscopy,Analytical,Biophysical and Life Science Applications[M].Weinheim:Wiley-VCH,2011:263-281.
[15]Musumeci A,Gosztola D,Schiller T,et al.SERS of semiconducting nanoparticles(TiO2hybrid composites)[J].J Am Chem Soc,2009,131(17):6040-6041.
[16]Wang H Y,Sun Y,Tang B,et al.Study on fluorescence property of dopamine and determination of dopamine by fluorimetry[J].Talanta,2002,57(5):899-907.
[17]马翠萍.吖啶橙-氧化石墨烯荧光淬灭法测定多巴胺[J].分析测试学报,2011,30(3):340-343.
[18]Wightman R M,May L J,Michael A C.Detection of dopamine dynamics in the brain[J].Anal Chem,1988,60(13):769A-779A.
[19]Vasantha V S,Chen S M.Electrocatalysis and simultaneous detection of dopamine and ascorbic acid using poly(3,4-ethylenedioxy)thiophene film modified electrodes[J].J Electroanal Chem,2006,592(1):77-87.
[20] Welch C W,Compton R G.The use of nanoparticles in electroanalysis:A review[J].Anal Bioanal Chem,2006,384(3):601-619.
[21]Zheng Y J,Huang Z J,Zhao C F.A gold electrode with a flower-like gold nanostructure for simultaneous determination of dopamine and ascorbic acid[J].Microchim Acta,2013,180(7/8):537-544.
[22]Jin G P,Lin X Q,Gong J M.Novel choline and acetylcholine modified glassy carbon electrodes for simultaneous determination of dopamine,serotonin and ascorbic acid[J].J Electroanal Chem,2004,569(1):135-142.
[23]Ke N J,Lu S S,Cheng S H.A strategy for the determination of dopamine at a bare glassy carbon electrode:p-phenylenediamine as a nucleophile[J].Electrochem Commun,2006,8(9):1514-1520.
[24]Kang G,Lin X.RNA modified electrodes for simultaneous determination of dopamine and uric acid in the presence of high amounts of ascorbic acid[J].Electroanalysis,2006,18(24):2458-2466.

