异氟醚对老年大鼠空间学习记忆能力及海马RhoA蛋白表达的影响
张文超 王 庚 胡中华 段开明 欧阳文▲
1.北京积水潭医院麻醉科,北京 100035;2.中南大学湘雅三医院麻醉科,湖南长沙 410083
近年来,许多研究从大脑海马区神经突触形态学的变化来探究神经结构对学习记忆功能的影响。异氟醚对神经轴突与树突结构有很大的可塑性,而这种可塑性的变化可能是学习与记忆能力的细胞基础[1]。Rho 蛋白家族是与受体偶联的小G 蛋白家族,分子量为20~30 kD,属于Ras 超家族成员,在细胞内信号传导中具有重要的功能[2]。 其主要成员RhoA 蛋白调节细胞肌动蛋白骨架的聚合, 对神经纤维延长与塌陷、神经生长方向具有导向作用,通过对肌动蛋白的调控而起调控树突状伪足和树突棘形态的动态变化,影响神经可塑性,而这一现象在学习基本形式的长时程增强(LTP)中有充分的体现[3]。 本研究以老龄SD 大鼠作为研究对象,通过建立吸入麻醉模型,使用动物行为学实验观察异氟醚麻醉后老年大鼠兴奋性、探索性指标以及空间辨别能力的变化,通过免疫组织化学方法观察大鼠海马区RhoA 蛋白的表达变化,为探讨22月龄大鼠短时间异氟醚麻醉后兴奋性、空间辨别能力改变的的机制提供理论依据,从而更好地阐明吸入异氟醚后对认知功能障碍的发病机制。
1 材料与方法
1.1 动物分组
22 月龄老龄SD 大鼠,订购于湖南农业大学动物科技学院实验动物养殖场(生产许可证SCXK 湘2006-0001)体重550~620 g。 饲养条件为(22±1)℃,相对湿度40%~50%,自然昼夜非直接光照。经穿梭箱回避实验筛选出30 只学习记忆能力正常的大鼠, 随机分为对照组C 组(n = 10)、麻醉后24 h Ⅰ组(n = 10)和麻醉后72 h Ⅱ组(n = 10)。
1.2 模型建立
采用Deatex-Ohmeda 气体监测仪监测自制麻醉箱中异氟醚浓度。待麻醉箱内异氟醚浓度调节至3%时将麻醉组大鼠放于麻醉箱内5 min,再将处于诱导状态的老年大鼠,置于自制拱形气管插管台上,采用经口明视气管插管方法,将14G 静脉套管经钢丝引导插入老鼠气管中[4]。PetCO2探头确定气管插管操作成功后,将气管导管与麻醉机相连, 大鼠自主吸入麻醉气体,异氟醚浓度调为2%。 应用鼠尾无创血压检测仪与分析系统(北京中西远大科技有限公司)于麻醉诱导前,麻醉诱导过程中,麻醉维持2 h 与苏醒后分别检测大鼠鼠尾无创收缩压、舒张压、平均动脉压(MAP)、心率(HR)。 麻醉结束后,大鼠在吸入纯氧下自然苏醒。
1.3 行为学实验方法
1.3.1 Y-迷宫实验
根据文献[5],将大鼠放入Y-迷宫箱中适应3~5 min,然后随机开始实验:随机变换电击区和安全区,观察动物学会逃离电击区而进入安全区的反应能力。大鼠进入安全区后,灯光继续维持5 s,以便大鼠确认安全位置。两次测试时间间隔为30 s,每次训练20次,休息5 min,连续测试直到学会为止,若测试次数﹥100 次则不再测试,并以100 为最大计数值。每次测试后,清理Y-迷宫箱,以免动物气味对下次测试结果造成影响[6]。
1.3.2 旷场实验
参照文献[7-8]采用自制旷场实验观察箱100 cm×100 cm×50 cm(长×宽×高),箱底分为25 个方格(20 cm×20 cm),墙壁涂黑。将旷场分析箱从左上开始,按左到右顺序以不同编号为相同的25 个小格,其中7、8、9、12、13、14、17、18 和19 为中央区域, 其余为外周格,13 号为中央格子。 每次实验时捏住大鼠尾巴距根部2/3 处轻放入中央格中,观察大鼠5 min 内活动情况,每次测定结束将动物排泄物清除干净, 每只仅测定1 次。 实验时间结束录像分析结果。 设两位观察者分别观察记录不同指标。 以跨格次数为水平活动得分,直立次数为垂直活动得分,记录中央格停留时间。
1.4 标本制备
行为学测试后,用麻醉致死法对大鼠腹腔注射麻醉药, 在大鼠心脏还在跳动时通过左心耳快速灌注4℃生理盐水100 mL 洗净血液, 然后以4%多聚甲醛200~300 mL 灌注固定。 止血钳剥离大鼠颅骨,取出完整大脑置于4℃4%多聚甲醛中浸泡6 h, 而后移入4℃的30%蔗糖溶液,将大脑冰冻切片(片厚为30 μm),用pH 7.4 的0.01% PBS 切片, 接着进行免疫组织化学染色。
免疫组织化学染色: 切片移入0.1Triton~0.001%H2O2溶液中,在37℃下反应30 min,PBS 缓冲液漂洗后,以3%正常羊血清封闭30 min,然后加兔抗RhoA抗体,4℃温盒内孵育72 h。 漂洗后加入即用型二抗(上海长岛生物技术有限公司),37℃孵育30 min,PBS冲洗,0.05% DAB~0.01% H2O2溶液显色,脱水,封片。应用彩色病理图片分析系统,对所有切片在同一光度下,每张切片随机选取3 个200 倍镜下视野计数阳性细胞,以单个标本为单位,取平均值。
1.5 RhoA 分析
参照大鼠脑图谱,每只大鼠选含背侧海马相应断面,选择其中显色较好且非特异性背景染色控制良好的切片3 张。 在光镜下从每张切片的海马CA3 区有代表性区域分别随机选择3 个高倍视野(10×40 倍),统计各视野RhoA 阳性细胞数。 阳性标准:棕黄色颗粒,特异性分布于胞质与胞核。 染色深度达到足以区分细胞周界的神经元被计数,计算平均值。 同时分别在20 倍与400 倍镜下采集图像, 通过图像分析软件Image-Pro Plus 6.0 对切片免疫组织化学阳性染色细胞进行定量分析。
1.6 统计学方法
采用SPSS 13.0 软件进行统计处理,计量资料以均数±标准差()表示,采用方差分析,组间两两比较采用LSD-t 检验,以P <0.05 为差异有统计学意义。
2 结果
2.1 一般情况
三组22 月龄大鼠体重无统计学意义(P >0.05)。麻醉组老龄SD 大鼠中麻醉前后收缩压、 舒张压、MAP、HR、鼠尾氧饱和度保持在正常范围,PetCO2维持在36~42 mm Hg(1 mm Hg = 0.133 kPa)且波形规则,皮肤颜色红润,未出现血压较大波动及缺氧现象。
2.2 三组大鼠行为学实验结果比较
旷场实验:三组大鼠跨格次数、直立次数、总活动量次数及中央格停留时间比较,差异均无统计学意义(均P>0.05);Y-迷宫实验: Ⅰ组Y-迷宫学习次数明显多于Ⅱ组和C 组(P <0.05),而Ⅱ组与C 组比较差异无统计学意义(P >0.05)。 见表1。
表1 三组大鼠行为学实验结果比较()
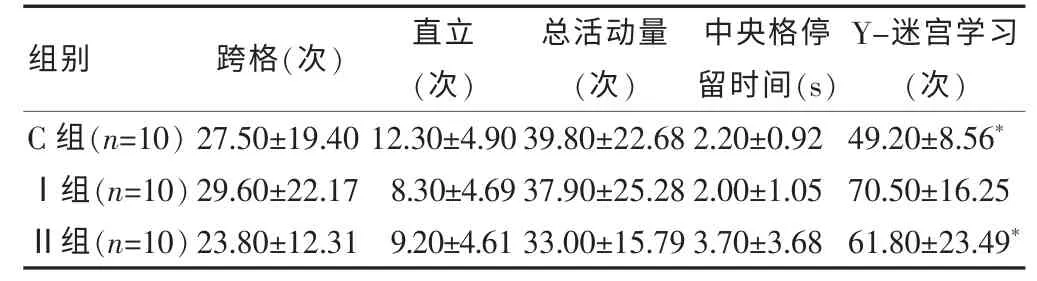
表1 三组大鼠行为学实验结果比较()
注:与Ⅰ组比较,*P <0.05
?
2.3 三组大鼠免疫组织化学反应结果
光镜下免疫组织化学结构显示:大鼠海马组织中可见RhoA 主要分布于椎体细胞层和辐射层,阳性细胞呈棕褐色,染色均匀,排列规则,呈弧形分布。 200倍镜下随机选取3 个视野大鼠海马区RhoA 阳性细胞计数,Ⅰ组RhoA 阳性细胞计数多于Ⅱ组和C 组(P <0.05),Ⅱ组与C 组比较差异无统计学意义(P >0.05),表明在异氟醚吸入麻醉后24 h,大鼠海马区RhoA 表达增加,吸入麻醉后72 h 有所恢复。 见表2。
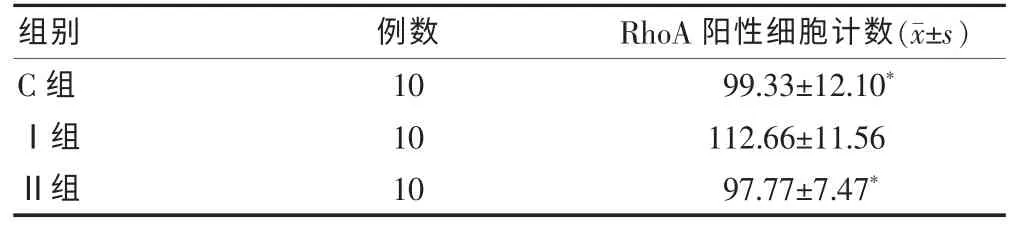
表2 三组大鼠海马CA3 区RhoA 阳性细胞计数比较
3 讨论
术后认知功能障碍(postoperative cognitive dysfunction,POCD)是指麻醉术后老年患者性格改变、学习记忆能力下降等中枢神经系统功能障碍[9-11]。 作为老年患者术后常见并发症给患者术后生活带来严重烦恼,导致患者丧失社会活动、 工作学习以及生活自理能力,因此减少麻醉术后认知障碍发生具有非常重要的意义。调查显示,尽管医疗技术水平有了很大提高,但是对于POCD 发病机制以及预防和治疗方法未得到显著改善。鉴于中枢神经系统和认知相关研究的复杂性,POCD 发生、发展的机制一直没有得到圆满解答。突触是一个神经元的冲动传到另一个神经元或传到另一个细胞间相互接触的结构,是神经元之间在功能上发生联系的部位,也是信息传递的关键部位。 神经轴突与树突结构有很大的可塑性,而这种可塑性的变化可能是学习与记忆能力的细胞学基础[12]。
在动物实验中,主要采用行为学实验研究药物对动物学习记忆能力的影响,人和动物的内部心理过程很难直观观察到,通过客观的动物实验模型来间接推测脑内所发生的过程,从而反映动物认知能力的水平与变化[13]。 目前,国内外多采用建立条件反射方法检测动物的行为能力和高级脑功能。旷场实验是将一定面积划分为不同区域,并以相应的格子对应。 大鼠在新环境中是由紧张、兴奋、探索再到适应的一系列过程, 兴奋性的老鼠在适应的环境中表现为行动活跃,四处走动,留下自身的生物气息,跨格次数的多少反映其兴奋程度。跨格次数的多少与动物的行动量成正比,跨格次数多,活动的距离也相应增加,这些观察指标可以间接地反映动物中枢神经系统的兴奋或抑制状态。 实验中,三组大鼠中央格停留时间、跨格次数、直立次数、总活动量次数差异无统计学意义,表明2%异氟醚麻醉后24、72 h 对大鼠的紧张、兴奋、探索等兴奋性指标没有显著变化,因此可以认为短时间吸入异氟醚对老年大鼠的空间学习能力影响不是由于其中枢兴奋状态的改变而产生的。 Y-迷宫用于检测大鼠的空间辨别能力,老年大鼠在迷宫中对电刺激和光刺激出现被动的逃避反应,经过多次训练后大鼠就能学会并记住迷宫的安全位置,间接地反映出老年大鼠的学习记忆能力[14]。Y-迷宫达到学会标准的次数能够较客观地表现大鼠的学习能力。
多年来,海马一直被认为是参与学习记忆的重要脑区,因海马是大脑边缘系统的重要组成部分,参与外界信息中枢传递的整合,一直是神经科学领域研究的焦点,海马区突触结构与大鼠学习记忆能力密切相关。海马区神经元在学习记忆过程中主要参与学习记忆巩固的早期过程[15-16],而后期的学习记忆过程更多是与其他脑区有关[17]。 本实验结果表明,Ⅰ组大鼠达到学会标准所需的训练次数明显多于对照组(C 组),差异有统计学意义(P <0.05),Ⅱ组与C 组之间差异无统计学意义, 表明2%异氟醚麻醉2 h 后可导致老年大鼠空间学习能力受损,学习能力下降,这种现状在麻醉后第1 天表现最为明显, 而第3 天基本恢复,学习结果体现在海马区神经突触结构的变化基础上,通过免疫组织化学法可以直观观察海马区RhoA 阳性细胞的变化与学习成绩变化趋势相同,因此可以推断异氟醚麻醉后老年大鼠短期内认知能力受损与异氟醚麻醉对海马CA3 区RhoA 表达的影响干扰了突触伪足的形成与塌陷有关。 Kaech 等[18]为观察全麻药物对突触的影响, 使用荧光显微镜实时拍摄技术,观察树突棘的形态变化,结果发现,在培养液中加入异氟醚后,神经细胞树突棘活力下降,说明吸入麻醉药会影响海马区树突棘的动力性和棘突结构的改变。神经轴突与树突应对麻醉刺激有很大的可塑性,而这种形态学的变化可能是学习与记忆能力改变的细胞基础[19-20]。RhoA 通过影响肌球蛋白收缩引起轴突生长锥的回缩及塌陷,RhoA 主要通过Rho 相关激酶信号传导通路调节肌动蛋白微丝骨架的聚集,进而影响细胞的极性和形态,RhoA 可使多个氨基酸位点磷酸化而激活,肌球蛋白磷酸酶结合亚单位是活化Rho 相关激酶的底物,磷酸化失活后,促使肌动蛋白微丝骨架聚合,从而影响细胞收缩[21]。 本实验通过观察老年大鼠海马组织中Rho 蛋白家族RhoA 表达变化,试图从异氟醚对海马组织中神经突触间信号传导分子变化的角度来阐释麻醉后学习空间能力的改变。实验中观察到麻醉后大鼠海马组织中RhoA 表达增高,麻醉后72 h恢复正常水平,说明异氟醚吸入麻醉后,大鼠海马区神经元处于活跃状态。 麻醉24 h 后RhoA 表达增加,说明RhoA 介导的突触塌陷占主要地位,新的神经突触的建立处于抑制状态,麻醉72 h 后表达有所恢复,说明新的突触生长已经恢复到麻醉前水平,而突触的塌陷可能是神经细胞重塑的表现。异氟醚麻醉后老年大鼠短期内认知能力受损,很可能是由于异氟醚麻醉对RhoA 表达的影响干扰了突触伪足的形成与塌陷。神经形态学的变化与神经传导功能具有重要的相关性,异氟醚影响海马区Rho 蛋白家族信号传导分子变化所介导的神经突触形态学改变很可能是学习记忆能力的细胞学基础。
[1] Uematsu N,Ogawa K,Tokinaga Y,et al.Sevoflurane inhibits angiotensin Ⅱ-induced Rho kinase-mediated contraction of vascular smooth muscle from spontaneously hypertensive rat [J]. J Anesth,2011,25(3):398-404.
[2] Moorman JP,Luu D,Wickham J,et al.A balance of signaling by Rho family small GTPases RhoA,Rac1 and Cdc42 coordinates cytoskeletal morphology but not cell survival[J].Oncogene,1999,18(1):47-57.
[3] Stankiewicz TR,Linseman DA.Rho family GTPases:key players in neuronal development,neuronal survival,and neurodegeneration [J]. Front Cell Neurosci,2014,8:314.
[4] 张文超,汪赛赢,欧阳文.吸入麻醉诱导下大鼠气管插管的应用研究[J].现代医药卫生,2010,26(16):2401-2402.
[5] 王跃春.大鼠Y-型迷宫测试法的筛选与优化[J].中国行为医学科学,2005,14(1):56-58.
[6] 夏月峰. 异氟醚对老年大鼠认知功能及海马CA3 区突触界面结构的影响[D].长沙:中南大学,2007.
[7] 耿德勤,王红梅,王志萍,等.老年大鼠麻醉术后认知障碍动物模型的建立及评价[J].实用临床医药杂志,2005,9(1):9-12.
[8] 林晓春,李云鹏,卞艳芳,等.大鼠旷场实验指标检测及参考值的探讨[J].毒理学杂志,2010,24(3):224-225.
[9] Hanning CD. Postoperative cognitive dysfunction [J]. Br J Anaesth,2005,95(1):82-87.
[10] 孙青山.不同麻醉方式对老年患者术后认知功能障碍的影响[J].中国现代医生,2014,52(28):51-53.
[11] 杨蕊,孙建良.全身麻醉药物与术后认知功能障碍的研究进展[J].中国现代医生,2013,51(23):17-19.
[12] Malinow R,Malenka RC. AMPA receptor trafficking and synaptic plasticity[J].Annu Rev Neurosci,2002,25:103-126.
[13] 汪洋.不同运动模型下大鼠海马神经细胞凋亡对学习、记忆的影响[D].上海:华东师范大学,2008.
[14] 曹剑,李鹏,易斌,等.老年和成年大鼠术后认知功能障碍模型的建立与比较[J].重庆医学,2010,39(17):2292-2293.
[15] 李源.异氟烷对老年大鼠海马胆碱乙酰转移酶的影响[D].重庆:第三军医大学,2009.
[16] 谢宸宸,罗勇,高祥,等.电针对局灶脑缺血/再灌注模型大鼠缺血海马区血管再生的影响及其机制[J].中国实验动物学报,2014,22(4):41-46.
[17] Kong F,Xu L,He D,et al.Effects of gestational isoflurane exposure on postnatal memory and learning in rats [J].Eur J Pharmacol,2011,670(1):168-174.
[18] Kaech S,Brinkhaus H,Matus A.Volatile anesthetics block actin-based motility in dendritic spines [J]. Proc Natl Acad Sci U S A,1999,96(18):10433-10437.
[19] O'Donnell C,Nolan MF,van Rossum MC. Dendritic spine dynamics regulate the long-term stability of synaptic plasticity [J]. J Neurosci,2011,31(45):16142-16156.
[20] 王军,杨献光,侯成千,等.Rho 蛋白调控分子机理研究进展[J].河南师范大学学报:自然科学版,2008,36(3):101-104.
[21] Erasso DM,Camporesi EM,Mangar D,et al.Effects of isoflurane or propofol on postnatal hippocampal neurogenesis in young and aged rats [J]. Brain Res,2013,1530:1-12.

