纳秒脉冲电场消融乳腺癌的实验研究
谢贵林 陈璐艳 陈新华 温 浩 陈新梅
1.浙江省绍兴第二医院普外科,浙江绍兴 312000;2.浙江大学第一附属医院普外科,浙江杭州 310000;3.新疆医科大学第一附属医院普外科,新疆乌鲁木齐 830054;4.山东中医药大学药学院,山东济南 250355
乳腺癌成为威胁女性的重大健康问题[1]。 根据我国2014 年肿瘤年报, 乳腺癌发病率和病死率持续增高[2]。MDA-MB-231 可以用于制作研究高侵袭乳癌细胞的细胞模型和动物模型[3]。目前多学科联合治疗是乳腺癌的主要方法[4]。根据目前消融介入技术的发展,微创消融也逐渐进入乳腺癌的综合治疗计划中。脉冲场强可以引起电穿孔[5],电穿孔不仅提高细胞膜对化疗药物的渗透率,增强化疗药物细胞毒性,还能通过降低化疗药物的使用剂量从而减小对正常细胞的毒副作用。而纳秒脉冲是不同于电穿孔技术的最新一代电脉冲消融技术。 纳秒脉冲引起细胞膜的微孔出现,最终形成细胞凋亡[6-7]。避免了严重的炎性反应[8],凋亡最初是在胚胎[9]及免疫系统[10]发育中发现。 而在肿瘤治疗中凋亡产生则意味着肿瘤被消灭而机体未被伤害。Caspase 是凋亡发生的一个重要分子标志[11-13],在本实验中纳秒级脉单独治疗肿瘤,避免了化疗副作用。
纳秒脉冲在美国已经开展皮肤基底细胞癌的临床前期试验,在政府网站上可见其登记号码Clinicaltrials.gov ID:NCT01463709)。 脉冲治疗仪器已经产业化,AngioDynamics 公司已将该治疗仪用于首例早期肝脏肿瘤的治疗中,它可以在诱导肿瘤细胞凋亡的同时抑制新生血管的形成,从而防止肿瘤的复发[14]。 纳秒脉冲的波长要远小于微妙脉冲,是一种非热生物效应及非药物依赖性治疗方法, 具有良好的应用前景。本实验旨在观察nsPEFs 对于乳腺癌细胞的消融效果,对乳腺癌细胞MDA-MB-231 的分子作用机制。
1 材料与方法
1.1 细胞株及抗体
人乳腺癌细胞株MDA-MB-231 由浙江大学医学院附属第一医院多器官联合移植实验室提供,含10%胎牛血清的RPMI-1640 培养基中37℃,5%CO2下培养,取对数生长期的细胞进行实验。
1.2 nsPEFs 治疗
纳秒脉冲发生器由杭州睿笛生物科技有限公司制造NANOABLATION 肿瘤消融仪器。 2.5×106个细胞放置于电极杯中治疗。治疗后的细胞置于培养箱中孵育1 h 后进行相关实验。
1.3 CCK-8 法检测细胞活性
细胞活性由Cell Counting Kit 检测, 用黄色吸光度值反映活细胞数量。
1.4 流式细胞仪检测细胞凋亡变化
采用100 个脉冲、300 ns,0、20、40、60 kV/cm 的不同场强的纳秒脉冲对乳腺癌细胞进行电击, 其中0 kV/cm 为对照组,余为实验组。所有经过电击治疗的细胞孵育1 h 后,收集细胞,通过碘化丙啶(PI)染色法检测细胞凋亡,同时设未作任何处理的空白对照。
1.5 流式细胞仪检测细胞周期
采用100 个脉冲、300 ns,0、20、40、60 kV/cm 的不同场强的纳秒脉冲对乳腺癌细胞进行电击,所有经过电击治疗的细胞孵育1 h 后,收集细胞,通过PI 染色法检测细胞凋亡,并且第一组实验进行细胞周期检测。 本实验电镜标本送往南京军区总医院病理科检测,透射电镜观察细胞形态变化。
1.6 细胞超微结构变化
采用100 个脉冲、300 ns,0、20、40、60 kV/cm 的不同场强的纳秒脉冲对乳腺癌细胞进行电击,所有经过电击治疗的细胞孵育1 h 后,收集细胞,戊二醛固定,送往南京军区总医院病理科通过透射电镜结果观察细胞形态变化。
1.7 JC-1 实验检测线粒膜电位变化
经过电击的细胞制成细胞悬液。 用BD 公司线粒体膜电位检测试剂盒(JC-1)进行检查。 用JC-1 从红色荧光到绿色荧光的转变作为细胞凋亡早期的一个标志。
1.8 动物模型的制作
本实验使用的是C57B16 小鼠乳腺癌荷瘤模型,接种肿瘤细胞后连续测量肿瘤生长及长宽高3 个参数, 并且在第0、1、2 天分别给予300 ns,40 kV/cm,100 个脉冲的电击,然后进行体积的比较。

图1 乳腺癌小鼠模型的制作及其B 超
1.9 统计学方法
采用SPSS 16.0 统计学软件进行数据分析, 计数资料用率表示,组间比较采用χ2检验,以P <0.05 为差异有统计学意义。
2 结果
2.1 采用CCK-8 法检测经nsPEFs 处理后的细胞活性
不同场强(0、20、40、60 kv/cm)的nsPEFs 作用于人乳腺癌细胞MDA-MB-231 后, 细胞分别培养24、48 h 和72 h,然后使用CCK-8 检测细胞活性。结果表明:随着脉冲场强的增加,细胞活性明显降低,且与对照组比较(0 kV/cm),20、40、60 kV/cm 各场强能显著抑制肿瘤细胞的活性(P <0.01),各实验组组间比较,差异有高度统计学意义(P <0.01)(图2),其中40 kV/cm能达到最大抑制率被定为最佳治疗参数, 增高场强到60 kV/cm 后不能再进一步提高抑制率;同一场强作用于细胞后,随着培养时间的增加,细胞活性也明显降低。
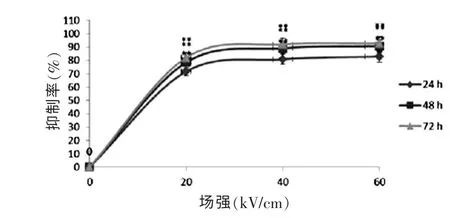
图2 不同场强的纳秒脉冲对乳腺癌细胞的抑制情况
2.2 采用流式细胞检测经nsPEFs 处理后细胞早期凋亡情况
在100 个脉冲,300 ns 条件下,与0 kV/cm 组比较,细胞的早期凋亡率在20 kV/cm 的场强时明显升高(P <0.01),在40 kV/cm 和60 kV/cm 时呈逐渐降低趋势。 相反, 细胞的坏死率随着场强的增加(0、20、40、60 kV/cm),呈持续性升高趋势,且为剂量依赖性(P <0.01)(图3)。 结果表明,伴随着纳秒脉冲电场的强度增加,脉冲诱导的细胞死亡主要表现为从早期凋亡至晚期凋亡或细胞坏死,呈剂量依赖性。
2.3 采用流式细胞检测经nsPEFs 处理后细胞周期的改变
经过纳秒脉冲(300ns,100 个脉冲,0、20、40、60kV/cm)治疗后,M 期的细胞明显减少,由于M 期可以反映细胞增殖的能力, 因此可以说明细胞增殖被明显抑制,但是此结果在各电场强度之间差异不明显,说明不具有剂量依赖性。 见图4。
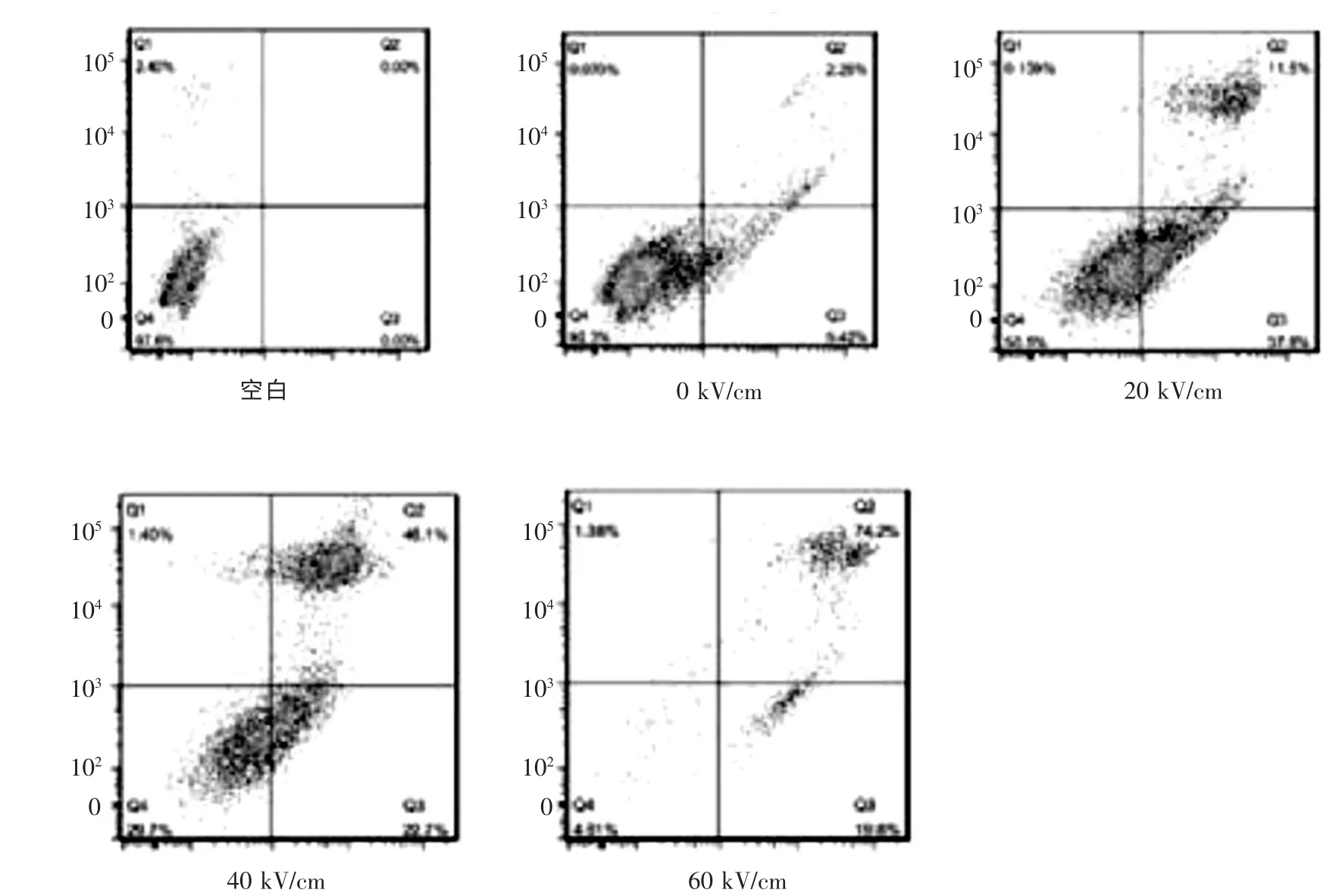
图3 不同强度纳秒脉冲治疗后细胞凋亡情况
2.4 透射电镜(TEM)观察乳腺癌细胞经纳秒脉冲电击后凋亡情况
在对照组中(0 kV/cm),几乎未见到凋亡细胞。随着剂量增高,乳腺癌细胞开始出现早期凋亡;升高到40 kV/cm 时,出现变性改变;而60 kV/cm 则引起细胞坏死。 见图5。
2.5 JC-1 实验结果
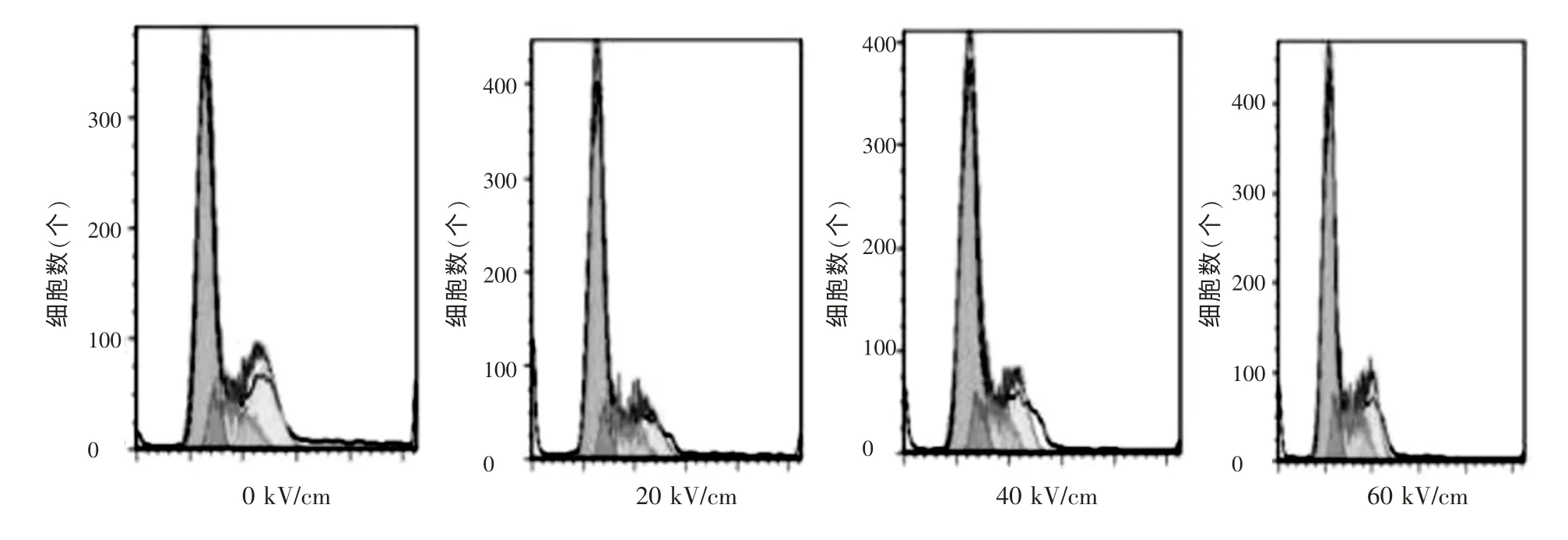
图4 不同场强的纳秒脉冲治疗后细胞周期的改变
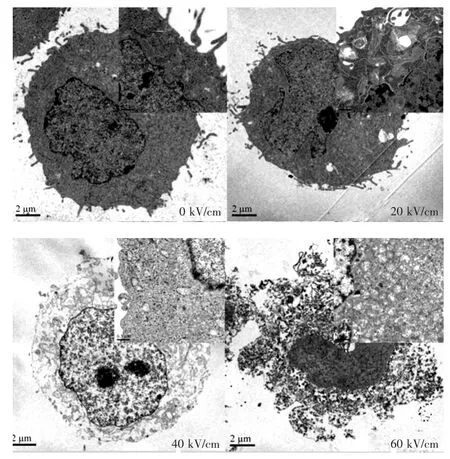
图5 不同场强的纳秒脉冲治疗后细胞形态学的改变
脉冲治疗后,细胞没有迁移,提示JC-1 单体稳定存在。 60 kV/cm 条件下增加脉冲个数,导致JC-1 分布迁移,凋亡细胞增多,脉冲个数由2 个增加至5 个后迁移程度最大。 提示纳秒脉冲增多,能够引起细胞线粒体膜电位下降。 见图6。
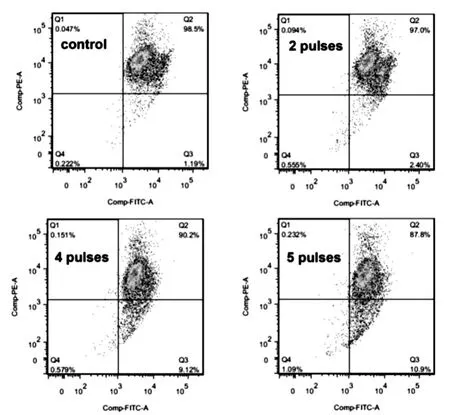
图6 60 kV/cm 纳秒脉冲治疗后细胞线粒体膜电位下降情况
2.6 纳秒脉冲对C57B16 小鼠肿瘤的治疗消融
在C57B16 小鼠实验上,接种人乳腺癌细胞后对照组肿瘤随着时间的增加而明显增大。 经过连续3 d电击治疗后的实验组小鼠肿瘤与对照组比较生长明显减慢,肿瘤未出现再次生长或复发。 见图7~8。
3 讨论
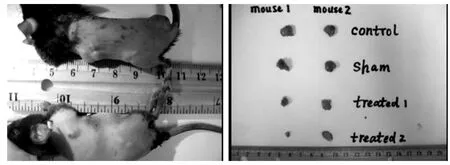
图7 各组肿瘤大小对比情况
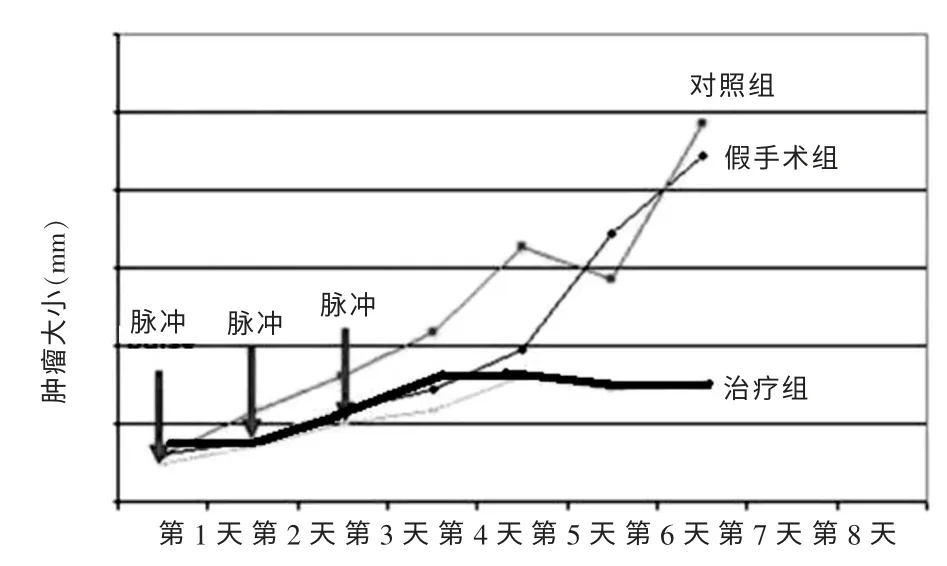
图8 不同时间各组小鼠乳腺肿瘤大小变化情况
乳腺癌在全球范围内仍然是导致女性死亡的重要原因之一[16]。 乳腺癌是一种全身性疾病的理念已被广泛接受,合理的综合治疗是获得乳腺癌长期生存的重要手段。 目前其主要治疗方法有手术、放疗和化疗等。 纳秒脉冲是脉冲电场技术的进一步发展,它将脉宽降到纳秒级以下的同时提高场强 (>10 kV/cm)[17],它不会引起明显的电穿孔现象[18], 但是细胞出现微孔,形成凋亡,与化疗及放疗比较,纳秒脉冲是一可以局部使用且不产热的消融手段。其作用的效果根据脉冲的个数,脉宽以及场强等因素决定。 不同类型的细胞[19-20]以及不同的细胞周期[21]对于纳秒脉冲的敏感性均不相同。
首先选择的参数是100 个脉冲,300 ns 脉宽,场强为0、20、40、60 kV/cm 的4 个实验组, 这个参数设置是根据皮肤黑色素瘤治疗中确认的有效参数,在本次实验中,CCK-8 实验证实了这个皮肤肿瘤治疗参数在乳腺癌中也有效,同时还发现纳秒脉冲在抑制细胞活性,阻断细胞于M 期,减少细胞增长,诱导细胞凋亡上具有显著的效果。 在最高的电场强作用下(60 kV/cm),并没有观察到细胞质膜的破裂和坏死,所以细胞的死亡至少在某一程度上是程序性的[21-22]而且,纳秒脉冲还能有效地重排细胞骨架蛋白[23]以及导致DNA 断裂[24-25]。 本实验对量效关系进行了考察,如果纳秒脉冲应用于临床,40 kV/cm 场强可以作为一个参考的参数。
本实验从体内和体外实验两个层面,从细胞的凋亡及线粒体膜电位改变等方面来观察纳秒脉冲作用于人乳腺癌细胞MDA-MB-231 后的效果。 本实验发现,纳秒脉冲对于人乳腺癌细胞具有较为显著的治疗作用, 但治疗参数的选择是决定消融效果的重要因素,治疗剂量并非越高越好,过强过多的治疗会引起细胞完全坏死, 而在达到一定参数时例如40 kV/cm是对本实验接种的荷瘤小鼠的最佳治疗参数。 本实验的局限是未对细胞核内发生的分子事件进行进一步追踪[26-28]。 尤其是NF-κB 信号通路需要进一步的研究。
本实验从细胞及动物实验等证实了纳秒脉冲可以诱导人乳腺癌细胞MDA-MB-231 的凋亡, 可能是通过激活Caspase 信号通路,是一种有效的治疗乳腺癌的方法。
[1] Gilbert FJ,Tucker L,Gillan MG,et al. The TOMMY trial:a comparison of TOMosynthesis with digital MammographY in the UK NHS Breast Screening Programme-a multicentre retrospective reading study comparing the diagnostic performance of digital breast tomosynthesis and digital mammography with digital mammography alone [J].Health Technol Assess,2015,19(4):1-136.
[2] Santander AM,Lopez-Ocejo O,Casas O,et al. Paracrine interactions between adipocytes and tumor cells recruit and modify macrophages to the mammary tumor microenvironment:the role of obesity and inflammation in breast adipose tissue [J]. Cancers,2015,7(1):143-178.
[3] Shakoor MT,Ayub S,Mohindra R,et al.Unique presentations of invasive lobular breast cancer:a case series [J]. Int J Biomed Sci,2014,10(4):287-293.
[4] Naghibi SA,Shojaizadeh D,Montazeri A,et al.sociocultural factors associated with breast self -examination among Iranian women [J]. Acta Med Iran,2015,53(1):62-68.
[5] Bozza C,Fontanella C,Buoro V,et al. Novel antiangiogenic drugs for the management of breast cancer:new approaches for an old issue? [J]. Expert Rev Clin Pharmacol,2015,19:1-15.
[6] Yesilkanal AE,Rosner MR. Raf Kinase Inhibitory Protein(RKIP) as a metastasis suppressor: regulation of signaling networks in cancer [J]. Crit Rev Oncog,2014,19(6):447-454.
[7] Ren ZG,Chen Xh,Cui GY,et al.Nanosecond pulsed electric field inhibits cancer growth followed by alteration in expressions of NF -κB and Wnt/β -catenin signaling molecules [J]. PLoS One,2013,8(9):e74322.
[8] Chen XH,Juergen F,Kolb R,et al. Apoptosis initiation and angiogenesis inhibition:melanoma targets for nanosecond pulsed electric fields [J]. Pigment Cell & Melanoma Research,2010,23(4):554-563.
[9] Alizadeh Sh,Kaviani S,Soleimani M,et al.Mir-55 inhibition can reduce cell proliferation and induce apoptosis in Jurkat(Acute T cell Leukemia) cell line [J]. Iran J Ped Hematol Oncol,2014,4(4):141-150.
[10] Visnagri A,Kandhare AD,Bodhankar SL. Renoprotective effect of berberine via intonation on apoptosis and mitochondrial-dependent pathway in renal ischemia reperfusion-induced mutilation [J]. Ren Fail,2015,19:1-12.
[11] Cohen M,Pierredon S,Wuillemin C,et al.Acellular fraction of ovarian cancer ascites induce apoptosis by activating JNK and inducing BRCA1,Fas and FasL expression in ovarian cancer cells [J]. Oncoscience,2014,1(4):262-271.
[12] Liu L,You Q,Tu Y,et al.midazolam inhibits the apoptosis of astrocytes induced by oxygen glucose deprivation via targeting JAK2-STAT3 signaling pathway[J].Cell Physiol Biochem,2015,35(1):126-136.
[13] Liu YF,Lu YM,Qu GQ,et al.Ponicidin induces apoptosis via JAK2 and STAT3 signaling pathways in gastric carcinoma [J]. Int J Mol Sci,2015,16(1):1576-1589.
[14] Li Y,He N,Zhai C.Peperotetraphin inhibits the proliferation of human prostate cancer cells via induction of cell cycle arrest and apoptosis [J]. Med Oncol,2015,32(2):468.
[15] Attar-Schneider O,Drucker L,Zismanov V,et al.Targeting eIF4GI translation initiation factor affords an attractive therapeutic strategy in multiple myeloma [J]. Cell Signal,2014,26(9):1878-1887.
[16] Chen XH,Chen Xm,James SR,et al. Histopathological follow-up by tissue micro-array in a survival study after melanoma treated by nanosecond pulsed electric fields(nsPEF) [J]. The Journal of Dermatological Treatments,2011,22(3):153-161.
[17] Richard N,Uwe P,Chen XH,et al. Nanosecond pulsed electric fields cause melanomas to self -destruct [J].Biochemical and Biophysical Research Communications,2006,343(2):351-360.
[18] Chen XH,Stephen JB,Zhen SS,et al. Tumor ablation with nanosecond pulsed electric fields [J]. Hepatobiliary &Pancreatic Diseases International,2012,11(2):122-124.
[19] Chen XH, Zhuang J,Kolb JF,et al. Long term survival of mice with hepatocellular carcinoma after pulse power ablation with nanosecond pulsed electric fields [J].Technology in Cancer Research and Treatment,2012,11(1):83-93.
[20] Chen XH,Karl HS,Zheng SS,et al. Comparative study of long and short pulsed electrical field for treating melanoma in an in vivo mouse model [J]. In Vivo,2011,25(1):23-27.
[21] Ren W,Sain NM,Beebe SJ. Nanosecond pulsed electric fields (nsPEFs) activate intrinsic caspase-dependent and caspase-independent cell death in Jurkat cells[J].Biochem Biophys Res Commun,2012,421(4):808-812.
[22] Ren W,Beebe SJ. An apoptosis targeted stimulus with nanosecond pulsed electric fields(nsPEFs)in E4 squamous cell carcinoma [J]. Apoptosis,2011,16(4):382-393.
[23] Hall EH,Schoenbach KH,Beebe SJ. Nanosecond pulsed electric fields induce apoptosis in p53-wildtype and p53-null HCT116 colon carcinoma cells [J]. Apoptosis,2007,12(9):1721-1731.
[24] Ford WE,Ren W,Blackmore PF,et al.Nanosecond pulsed electric fields stimulate apoptosis without release of proapoptotic factors from mitochondria in B16f10 melanoma[J]. Arch Biochem Biophys,2010,497(1-2):82-89.
[25] Hall EH,Schoenbach KH,Beebe SJ. Nanosecond pulsed electric fields have differential effects on cells in the Sphase [J]. DNA Cell Biol,2007,26(3):160-171.
[26] Jiang Z,Liu JC,Chung PE,et al.Targeting HER2(+)breast cancer:the TBK1/IKKε axis.Oncoscience [J]. 2014,1(2):180-182.
[27] Cicchini M,Chakrabarti R,Kongara S,et al. Autophagy regulatorBECN1suppressesmammarytumorigenesisdriven by WNT1 activation and following parity [J]. Autophagy,2014,10(11):2036-2052.
[28] Lundqvist J,Yde CW,Lykkesfeldt AE. 1α,25-dihydroxyvitamin D3 inhibits cell growth and NFκB signaling in tamoxifen-resistant breast cancer cells[J].Steroids,2014,85:30-35.

