促生菌的分离鉴定及其对柳枝稷种子在盐胁迫下的萌发促进作用
马晓敏,张红娟,顾沐宇,归 静,高 伟,王佺珍
(西北农林科技大学动物科技学院,陕西杨陵712100)
随着工业化的发展和不可再生资源的过度利用,石油能源在不久的将来便会面临枯竭的危险,并且石油燃料的燃烧也带来了大气污染、全球气候变暖等一系列的环境问题,人类即将面临能源危机和大气污染的双重挑战,而能源植物以其资源的丰富性、可再生性、环境友好性和碳零排放等优点必将成为一种重要的替代能源。在各种能源植物中,柳枝稷因其抗逆性强,肥料需求少,生产成本低,适应性广,低灰分,纤维素含量高等优点成为了目前能源植物研究的热点。另外较长时间的研究实践表明,其对我国的各地水文气候有较强的适应性,进一步发展不仅可以保障能源安全,改善生态环境,如在水土流失严重的黄土高原区,种植柳枝稷改良了当地的生境,具有生态效益,因此,近些年我国政府加大了对能源作物的研究开发。
植物的生长受到很多非生物因素的限制,土壤盐渍化是干旱和半干旱地区农作物产量降低的主要原因之一[1]。目前,全球范围超过50%的灌溉土地和20%的可耕作土地受到盐渍化的影响[2],每年世界上由于土壤盐渍化而丧失的可耕作土地高达25~50万hm2,尤其是在一些干旱和半干旱地区[3]。因此提高农作物的耐盐性,培育耐盐作物,开发利用盐碱地成为未来农业发展的一个重要方向,并上升为我国西部农业发展的重大课题[4]。植物根际促生菌(Plant growth promoting rhizobacteria,PGPR)是指定殖于植物根际系统,并能促进植物生长的一类细菌的总称,这些促生菌通过一些机制来促进植物生长并提高植物的抗逆性,例如,分泌嗜铁素和各种激素,溶磷性和固氮性[5]。另外,PGPR可以在分子水平上通过分泌一些酶来调节植物生理,促进植物生长,具有ACC脱氨酶的内生菌是一种重要PGPR[6]。ACC是乙烯的前体,高水平的乙烯会阻碍植物根系的延长和生长,进而影响植物的生长和发育[7]。该酶可以催化乙烯的关键中间前体ACC转化成α-酮丁酸和氨,从而影响植物生长时的乙烯水平,因而利用这类PGPR可能有助于提高植物的耐盐性[8-9]。具有ACC脱氨酶活性的促生菌已经在很多在植物上进行了研究,如小麦、玉米、西红柿、油菜[10-13],可是目前在能源草柳枝稷上还没有报道。本文从柳枝稷根茎中分离PGPR,并评价这些PGPR对柳枝稷种子在盐胁迫下的促生作用,为利用植物促生菌改善和提高盐胁迫条件下柳枝稷的生长,以及促进其在盐渍化地区的可持续生产奠定理论基础。
1 材料和方法
1.1 材料
1.1.1 样品 PGPRs分离于柳枝稷(Panicum virgatumL.)根茎,柳枝稷(品种Blackwell)生长于西北农林科技大学草业科学实验地。实验所用柳枝稷种子来自中国农业大学。
1.1.2 主要试剂和仪器 ACC(A-3903)购自三力试剂公司;用于PCR扩增的全套试剂购自天根生化公司;实验中其他试剂均AR级国产。种子培养箱SPX-100B-Z;超净操作台SW-CJ-1D;电导率仪DDS-307;PCR仪器T100。16SrDNA序列测定由天根生化公司完成。
1.1.3 培养基 PAF培养基(每升):蛋白胨10g,络蛋白水解物10g,MgSO41.5g,K2HPO41.5g,pH 7.2;DF盐培养基(每升):KH2PO44.0g,NaHPO46.0g,MgSO4·7H2O 0.2g,葡萄糖2.0g,葡萄糖酸2.0g,柠檬酸2.0g,(NH4)2SO42.0g,pH 7.1-7.5;加富培养基(DFa):ACC溶于超纯水后抽滤灭菌,加到不含有(NH4)2SO4且预先灭菌的D F盐培养基中,ACC终浓度为3.0mmol· L-1;TSB培养基:胰蛋白胨17g,大豆蛋白胨3g,葡萄糖2.5g,NaCl 5g,H2PO42.5g,pH 7.1~7.5。
1.2 方 法
1.2.1 ACC脱氨酶活性菌株的制备 参照Zhang[14]的方法,取柳枝稷根茎5g,研磨后取滤液1mL于50mL PAF液体培养基中,在28℃下200 r·min-1振荡培养24h。重复转接1次后,吸取1 mL悬浮液至50mL DF培养液中,相同条件下培养24h。然后吸取1mL悬浮液至DFa培养基中,进行ACC脱氨酶活性菌株的筛选。如此转接3次后,用接种环蘸取少量富集培养液,在分离纯化培养基平板上划线分离、28℃培养,待平板上出现单菌落后,挑取单菌落转接至TSB固体分离纯化斜面培养基上,选择连续接种、传代3次,保存在固体TSB培养基上于-20℃保存生长,进行下一步研究。
1.2.2 分离菌株鉴定 分离的菌株进行16SrDNA基因测序。16SrDNA通过菌落PCR获得,引物使用细菌通用引物27f(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492r(5′-TACGGCTACCTTGTTACGACTT-3′)。PCR反应体系(The 70-μL):35 μL of 2x反应混合物[0.1unit Taq聚合酶/μL,0.5 mmol·L-1dNTP,20mmol·L-1Tris-HCl(pH 8.3),100mmol·L-1KCl,3mmol·L-1MgCl2],10μmol·L-1的引物2.8μL,0.56μL 2.5xTaq DNA聚合酶,28.84μL无菌水,2μL菌液。PCR程序为:94℃预变性5min;94℃变性0.5min,54℃退火0.5min,72℃延伸5min,35个循环;72℃延伸。PCR产物用1%的琼脂糖凝胶电泳进行检测。经过纯化的PCR产物送生工生物工程(上海)有限公司进行测序。通过BLAST软件对测定16S rDNA基因序列进行同源性比较,选取相似性较高的序列,并向GenBank提交获得序列号。
1.2.3 ACC脱氨酶和IAA活性测定 ACC脱氨酶活性测定Donna M[15]的方法进行,ACC脱氨酶在利用ACC的时候会产生α-丁酮酸,在540nm下测量处测定光吸收值,并通过标准曲线计算出α-丁酮酸的浓度。IAA活性测定按照sheng[16]的方法进行一些调整来测定,供试菌株先在DF培养液中培养2d,再定量转入添加不同浓度色氨酸(L-Trp)的DF培养液(含0、50、100、200和500μg L-Trp ·mL-1)中继续培养2d,取样测菌液OD600,其余培养液室温下8 000g离心,取500μL上清液,添加2mL Salkowski试剂(含150mL H2SO4、250mL ddH2O和0.5mL 0.5mol/L FeCl3),室温培养20min后,在535nm处测吸光值(OD535)。IAA含量单位为μg·(mL·OD600)-1,IAA标准曲线平行3次。
1.2.4 在盐胁迫条件下促生菌对茄子种子和形态、生理指标的影响 挑选大小一致饱满无病害的柳枝稷种子,用70%乙醇处理1min,用无菌水洗净;再用1%NaCl处理10min,用无菌水洗净,将种子分为4组,处理组3组用前面分离的,Pseudomonas sp.(P)菌,Rhizobiumsp.(R)菌或Pseudomonas sp.+Rhizobiumsp.(P+R)混菌处理1h(用灭菌的0.03mmol·L-1MgSO4重悬浮,OD600=0.5)对照组只用0.03mmol·L-1MgSO4处理相同时间作为对照。在培养皿(直径9cm)中进行不同浓度梯度的NaCl胁迫试验。供试NaCl浓度分别为:0mmol,50mmol,100mmol,150mmol,200mmol,250mmol每1个梯度设3组重复。每个培养皿播种50粒种子,每个处理中一次性加入某一浓度的NaCl溶液8mL,28℃种子培养箱中培养。以后每天称重补水,每天统计发芽数。发芽第14d每个培养皿选取10株幼苗测定根长、芽长(N=3*10)(发芽不足10株的测定所有发芽的根长和芽长)和相对电导率,并计算发芽率,发芽势和发芽指数。

1.3 数据分析
用SPSS 20.0对数据进行方差分析,并用Duncan法进行多重比较,用Excel 2010进行作图。
2 结果与分析
2.1 菌株的分离和筛选
本试验得到两个菌株Rhizobiumsp.(R),Pseudomonas sp.(P)。在GenBank获得注册序列号分别为KM269075和KJ698416。
2.2 菌株的ACC脱氨酶活性和IAA活性
P菌的ACC脱氨酶和IAA活性分别为895± 35nmol(α-丁酮酸/蛋白mg/h),22.5±1.6μg mL-1。R菌没有ACC脱氨酶活性,IAA活性为11.3±0.5μg mL-1。
2.3 不同浓度的NaCl盐胁迫条件下促生菌对柳枝稷种子萌发和幼苗生长的影响
2.3.1 不同浓度的NaCl盐胁迫条件下促生菌对柳枝稷种子发芽率影响 图1显示,随着NaCl盐浓度的升高,各处理组的发芽率都下降。0mmol和50mmol盐浓度处理下,处理组和对照组的发芽率没有显著差异,100mmol NaCl盐胁迫下,接种R菌的发芽率显著高于无菌的发芽率,但与接种P菌和混合菌的处理组没有显著差异。150mmol和250mmol NaCl胁迫下,处理组的发芽率均显著高于对照组的发芽率。200mmol NaCl胁迫下,接种R菌和混合菌的发芽率显著高于无菌的发芽率。
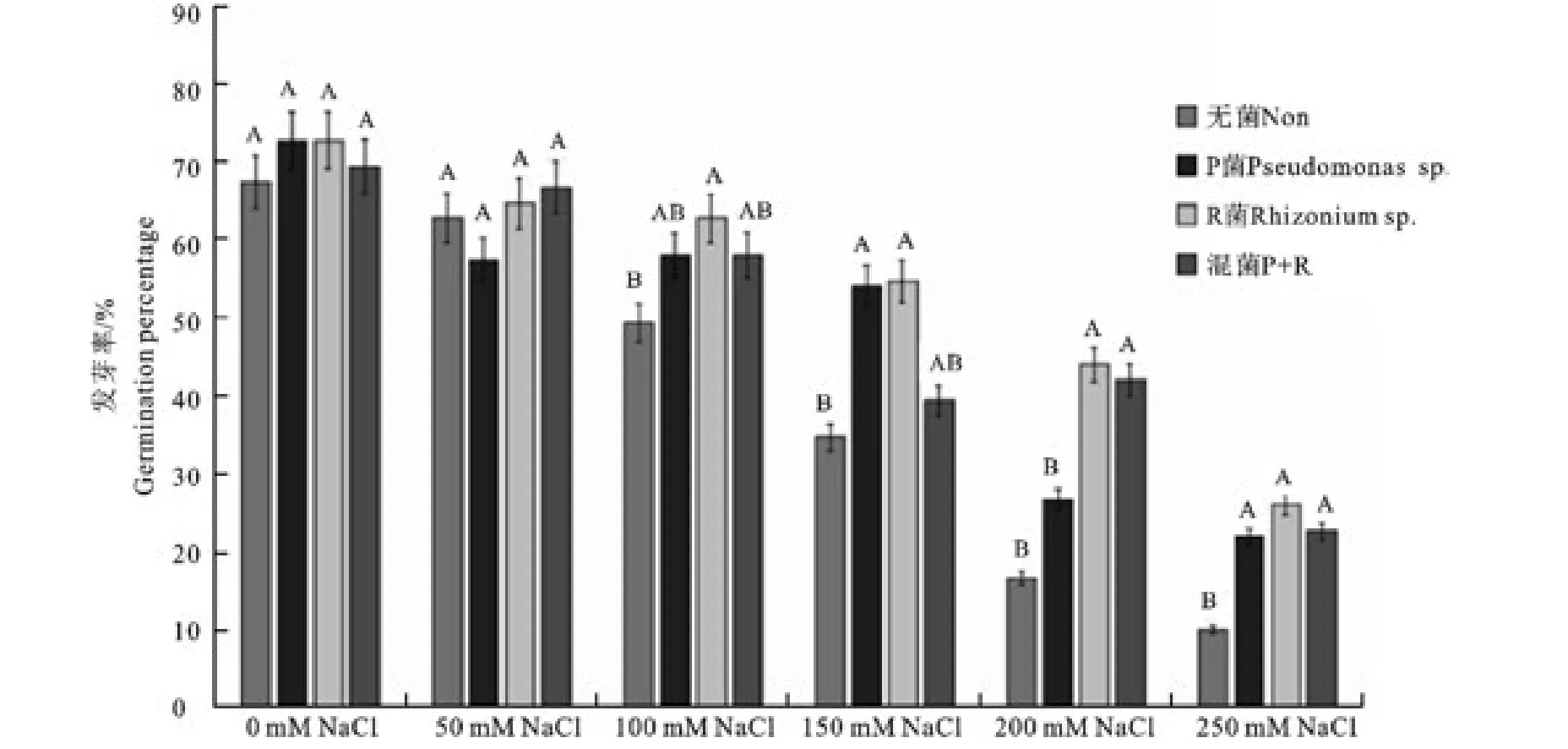
图1 不同浓度NaCl盐胁迫条件下接菌和不接菌对柳枝稷种子发芽率的影响Fig.1 Effect of inoculation on germination rate of switchgrass under NaCl salt stress
2.3.2 不同浓度的NaCl盐胁迫条件下促生菌对柳枝稷种子发芽势的影响 图2显示,随着NaCl浓度的升高,4组处理的发芽势都降低。0~100 mmol NaCl下,处理组和对照组的发芽势没有显著差异,150~250mmol NaCl胁迫下,R和P菌处理组种子发芽势显著高于无菌处理组的发芽势。
2.3.3 不同浓度的NaCl盐胁迫条件下促生菌对柳枝稷种子发芽指数的影响 图3显示,随着NaCl浓度的升高,各组的发芽指数都下降。0~100mmol NaCl胁迫下,各组柳枝稷种子的发芽指数没有显著差异。但是,150~250mmol NaCl胁迫下,接种P菌,R菌和混合菌的发芽指数都要显著高于无菌的发芽指数。
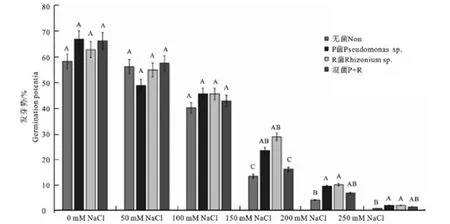
图2 不同浓度NaCl盐胁迫条件下接菌和不接菌对柳枝稷种子发芽势影响Fig.2 Effect of inoculation on tgerminability of switchgrass under NaCl salt stress
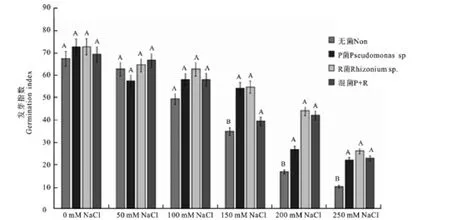
图3 不同浓度NaCl盐胁迫条件下接菌和不接菌对柳枝稷种子发芽指数影响Fig.3 Effect of inoculation on germination index of switchgrass under NaCl salt stress
2.3.4 不同浓度的NaCl盐胁迫条件下促生菌对柳枝稷种子胚根生长的影响 图4显示,各处理组中,50mmol NaCl处理下,胚根长度有升高的趋势。100~250mmol NaCl处理下,随着NaCl浓度的升高,胚根长度下降。0mmol和50mmol,100mmol,250mmol NaCl胁迫下,接种P菌组的胚根长度显著高于不接菌组的。200mmol NaCl胁迫下,所有接菌组的胚根长度显著高于不接菌的。
2.3.5 不同浓度的NaCl盐胁迫条件下促生菌对柳枝稷种子胚芽生长的影响 图5显示,随之NaCl盐浓度的升高,各组的胚芽长度均下降。0mmol NaCl下,混合菌处理组的胚芽长度显著高于无菌和R菌的胚芽长度,50mmol NaCl下,P菌和混菌处理组的胚芽长度显著高于无菌组的,150mmolNaCl下,R菌处理组的胚芽长度显著高于无菌组的,200mmol NaCl下,接菌组的胚芽长度均高于无菌组的,250mmol NaCl下,P菌的胚芽长度显著高于其他组的。
2.3.6 不同浓度的NaCl盐胁迫条件下促生菌对柳枝稷幼苗相对电导率的影响 图6显示,随之NaCl浓度的升高,各组的相对电导率均上升,0mmol和50mmol NaCl胁迫下下,各组的相对电导率没有显著差异,100mmol NaCl胁迫下,无菌组的相对电导率显著高于R菌和混合菌组的,150~250mmol NaCl胁迫下无菌组的相对电导率显著高于其他接菌的相对电导率。

图4 不同浓度NaCl盐胁迫条件下接菌和不接菌对柳枝稷种子胚根的影响Fig.4 Effect of inoculation on radicle of switchgrass under NaCl salt stress

图5 不同浓度NaCl盐胁迫条件下接菌和不接菌对柳枝稷种子胚芽的影响Fig.5 Effect of inoculation on plumule of switchgrass under NaCl salt stress

图6 不同浓度NaCl盐胁迫条件下接菌和不接菌对柳枝稷幼苗相对电导率的影响Fig.6 Effect of inoculation on relative electrical conductivity of switchgrass seedlings under NaCl salt stress
3 讨 论
本研究首次从柳枝稷根茎中分离具有ACC脱氨酶活性的促生菌:P、R,并向GenBank获得注册序列号。菌株P和R能在以ACC为唯一氮源的培养基上生长,且P菌具有较高的ACC脱氨酶活性和IAA活性;R菌虽然没有ACC脱氨酶活性,但是R菌是根瘤菌具有固氮性。P菌和R菌能促进柳枝稷在NaCl盐胁迫的种子萌发,尤其是高浓度盐胁迫下的萌发,提高了种子的发芽率,发芽势和发芽指数,说明P、R菌不但可以在0~250mmol·L-1NaCl下存活,而且可以促进柳枝稷种子的萌发、提高发芽的整齐度和种子活力。另外,接菌处理组幼苗的胚根长和胚芽长显著高于对照组幼苗的胚根和胚芽长,特别是在高浓度NaCl胁迫下。表明促进菌P、R和他们的混合菌可以缓解NaCl盐胁迫,促进柳枝稷幼苗的生长。植株相对电导率(REC)是衡量植株状态的重要生理指标。随之盐浓度的升高,幼苗具有的相对电导率升高,植物受损。同等NaCl盐浓度下特别是高盐浓度下,接菌的幼苗的相对电导率要显著低于无菌幼苗的相对电导率,表明同等盐浓度下,接种促生菌的幼苗受到的胁迫小,促生菌具有缓解和抵消NaCl盐胁迫的作用。
高浓度的NaCl通过离子毒害,水分胁迫和养分不平衡给植物生长发育造成的胁迫[17]。植物在NaCl盐胁迫下会产生大量的乙烯,乙烯是一种植物调节激素,低浓度的乙烯可以促进植物生长,高度浓度的乙烯可以抑制植物的生长[18]。具有ACC脱氨酶的促生菌可以催化乙烯的前体ACC,把ACC转化成α-酮丁酸和氨,从而降低植物在NaCl盐胁迫下的乙烯水平,减少乙烯对植物生长的危害。IAA也是一种植物激素,具有促进细胞生长和分化的作用,另外还能减缓高浓度乙烯对根造成的抑制作用[19-20]。当将促生根际菌定植到种皮或是植物根系时,会合成并分泌IAA(生长素),新合成的IAA将会被植物体吸收形成内源生长素,从而刺激植物细胞的分裂与延长。与此同时,IAA会激发ACC合成酶的活性,将S-腺营酸转化成1-氨基环丙烷1-梭酸。Penrose研究表明,用ACC脱氨酶活性菌处理植物的种子可以降低2~4倍的乙烯含量[21]。产生固氮酶的PGPR可将空气中的二氧化氮固定成为有机氮,被植物和微生物使用促进作物生长。本实验中分离的P菌既具有ACC脱氨酶活性,又具有IAA活性,R菌虽然没有ACC脱氨酶活性但具有固氮酶活性,可以在只含有ACC为唯一氮源的培养基中生长,而且R菌具有IAA活性,因此可以提高柳枝稷种子在NaCl盐胁迫下的抗性。P菌、R菌及其两者的混合菌通过ACC脱氨活性、IAA活性、两者之间的相互作用,促进柳枝稷种子在NaCl盐胁迫下的种子萌发和幼苗生长。
4 结 论
研究结果表明,促生菌P、R、P+R处理的柳枝稷的种子,可以提高种子在NaCl盐胁迫的萌发,促进幼苗的生长,缓解盐胁迫对植物的毒害作用,从而增强植物对盐胁迫的抗性。本研究为提高和扩大柳枝稷在盐渍化土地柳枝稷的建植提供了新的思路和方法。
[1] Munns R.Comparative physiology of salt and water stress[J].Plant Cell and Environment,2002,25(2):239-250.
[2] Hasegawa P M,Bressan R A,Zhu J K,et al.Plant cellular and molecular responses to high salinity[J].Annual Review of Plant Physiology and Plant Molecular Biology,2000,51:463-499.
[3] Peng Y L,Gao Z W,Gao Y,et al.Eco-physiological characteristics of alfalfa seedlings in response to various mixed saltalkaline stresses[J].Journal of Integrative Plant Biology,2008,50(1):29-39.
[4] 毛建华,陆文龙.发展盐土农业促进农业产业结构调整[J].天津农业科学,2000,(03):49-51.
[5] Ryan R P,Germaine K,Franks A,et al.Bacterial endophytes:recent developments and applications[J].FEMS Microbiol Lett,2008,278(1):1-9.
[6] Glick B R,Todorovic B,Czarny J,et al.Promotion of plant growth by bacterial ACC deaminase[J].Critical Reviews in Plant Sciences,2007,26(5-6):227-242.
[7] Czarny J C,Grichko V P,Glick B R.Genetic modulation of ethylene biosynthesis and signaling in plants[J].Biotechnology Advances,2006,24(4):410-419.
[8] Hontzeas N,Hontzeas C E,Glick B R.Reaction mechanisms of the bacterial enzyme 1-aminocyclopropane-1-carboxylate deaminase[J].Biotechnology Advances,2006,24(4):420-426.
[9] Glick B R.Modulation of plant ethylene levels by the bacterial enzyme ACC deaminase[J].Fems Microbiology Letters,2005,251(1):1-7.
[10] Madhaiyan M,Poonguzhali S,Sa T.Metal tolerating methylotrophic bacteria reduces nickel and cadmium toxicity and promotes plant growth of tomato(Lycopersicon esculentum L.)[J].Chemosphere,2007,69(2):220-228.
[11] Zafar-ul-Hye M,Farooq H M,Zahir Z A,et al.Application of ACC-deaminase containing rhizobacteria with fertilizer im-proves maize production under drought and salinity stress[J].International Journal of Agriculture and Biology,2014,16(3):591-596.
[12] Bangash N,Khalid A,Mahmood T,et al.screening rhizobacteria containing ACC-deaminase for growth promotion of wheat under whater stress[J].Pakistan Journal of Botany,2013,45:91-96.
[13] Glick B R,Liu C P,Ghosh S,et al.Early development of canola seedlings in the presence of the plant growth-promoting rhizobacterium Pseudomonas putida GR12-2[J].Soil Biology &Biochemistry,1997,29(8):1 233-1 239.
[14] 张国壮,李海超,孙永林,等.5株产ACC脱氨酶细菌的筛选与鉴定[J].西北农林科技大学学报(自然科学版),2014,(06):189-196.
[15] Penrose D M,Glick B R.Methods for isolating and characterizing ACC deaminase-containing plant growth-promoting rhizobacteria[J].Physiologia Plantarum,2003,118(1):10-15.
[16] Sheng X F,Xia J J,Jiang CY,et al.Characterization of heavy metal-resistant endophytic bacteria from rape(Brassica napus)roots and their potential in promoting the growth and lead accumulation of rape[J].Environmental Pollution,2008,156(3):1 164-1 170.
[17] Kranner I,Seal C E.Salt stress,signalling and redox control in seeds[J].Functional Plant Biology,2013,40(8-9):848-859.
[18] Ma J H,Yao J L,Cohen D,et al.Ethylene inhibitors enhance in vitro root formation from apple shoot cultures[J].Plant Cell Reports,1998,17(3):211-214.
[19] Rahman A,Amakawa T,Goto N,et al.Auxin is a positive regulator for ethylene-mediated response in the growth of arabidopsis roots[J].Plant and Cell Physiology,2001,42(3):301-307.
[20] Le J,Vandenbussche F,Van der Straeten D,et al.In the early response of arabidopsis roots to ethylene,cell elongation is up-and down-regulated and uncoupled from differentiation[J].Plant Physiology,2001,125(2):519-522.
[21] Penrose D M,Moffatt BA,Glick B R.Determination of 1-aminocycopropane-1-carboxylic acid(ACC)to assess the effects of ACC deaminase-containing bacteria on roots of canola seedlings[J].Canadian Journal of Microbiology,2001,47(1):77-80.
——现代牙刷的由来

