光催化降解咖啡因废水
高向阳,邵琳琳
(1.河南有色汇源铝业有限公司,河南平顶山467311;2.中新苏州工业园区环保技术有限公司,江苏苏州210054)
光催化降解咖啡因废水
高向阳1,邵琳琳2
(1.河南有色汇源铝业有限公司,河南平顶山467311;2.中新苏州工业园区环保技术有限公司,江苏苏州210054)
以紫外灯为光源、纳米TiO2为催化剂,探讨了光催化反应降解咖啡因废水的影响因素,获得光催化降解咖啡因的最佳条件:咖啡因初始质量浓度为10 mg/L,纳米TiO2用量为1 g/L,pH为10.89,H2O2质量浓度为1.0 g/L.
光催化降解;纳米TiO2;咖啡因
近十多年来,利用TiO2在一定波长的紫外光照射下会产生具有很强氧化还原能力的电子-空穴对,可以催化降解环境介质中有机污染物的光催化降解方法,受到广泛关注[1-3],而对光催化降解医药废水中咖啡因的研究较少[4].本试验以紫外灯为光源、纳米TiO2为催化剂,探讨了光照时间和溶液初始质量浓度、催化剂用量、pH值及H2O2质量浓度对光催化降解咖啡因的影响和其降解反应动力学特征.
1 试验部分
1.1 仪器和试剂
仪器:UV-2450紫外可见光光度计;ZSZ-20型石英紫外线杀菌灯(20W);QZD-1型电磁振荡机;LP115 pH计;TGL-16C型高速台式离心机.
试剂:纳米锐钛矿型TiO2(粒径≤30 nm,江苏常泰纳米材料有限公司);咖啡因(生化试剂,上海试剂二厂);其他试剂均为分析纯,试验用水为二次蒸馏水.
1.2 试验方法
反应装置为如图1所示.
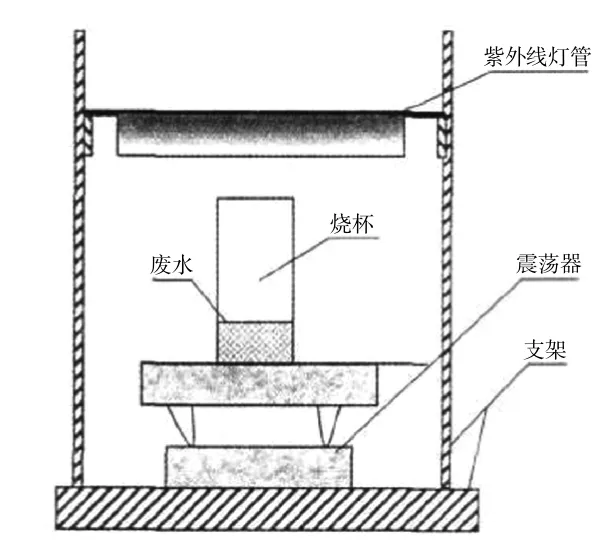
图1 光催化反应装置示意Fig.1 Schematic diagram of photocatalytic reaction
槽中每次装入咖啡因溶液1 L,加入一定量的纳米TiO2,用振荡机使溶液处于悬浮状态,紫外灯管距液面10.0 cm,定时取样,样品以12 000 r/min离心5 min,取离心后的上清液于10 mm石英比色皿内,扫描紫外可见吸收光谱,测量位于206 nm处的吸光值A,依据朗伯比尔定律计算体系的咖啡因质量浓度.按式(1)计算咖啡因降解率.

式(1)中c0为初始溶液质量浓度/(mg/L);c为反应溶液质量浓度/(mg/L).
2 结果与分析
2.1 咖啡因紫外可见光谱图
图2为紫外光照射前后10 mg/L咖啡因废水在不同质量浓度双氧水中的吸收光谱.
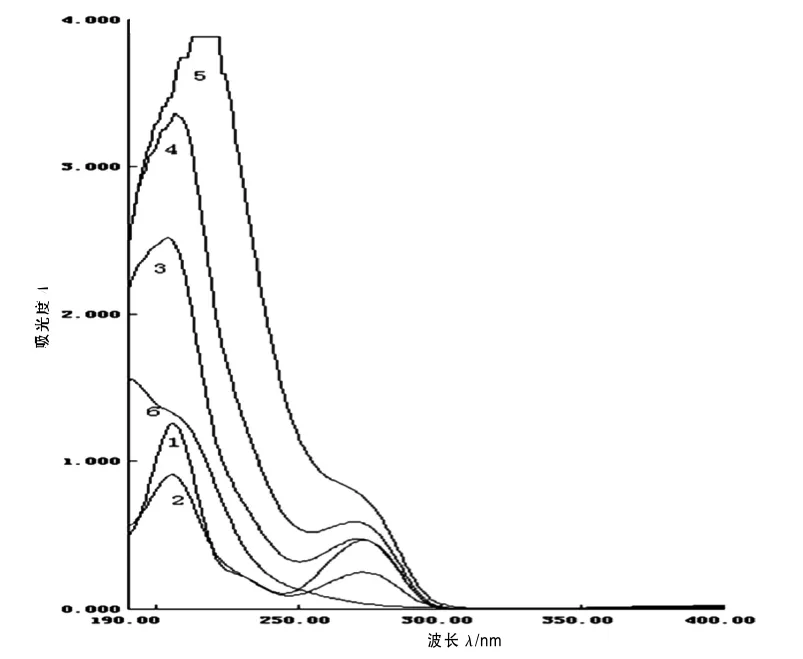
图2 咖啡因吸收曲线Fig.2 Absorption spectra of caffeine
由图2可知,体系中仅有咖啡因存在时,咖啡因水溶液在206 nm和273 nm处有特征吸收.当采用紫外灯照射后,在TiO2的催化作用下咖啡因逐渐分解,其吸光度也逐渐减小.当体系中增加H2O2之后,咖啡因吸收光谱产生了3点变化:随着H2O2质量浓度的增加在273 nm处吸收峰逐渐减小直至消失;206 nm处的特征吸收峰逐渐红移,红移幅度最大达7 nm;随着H2O2加入量的增加,咖啡因的吸光度也大幅增加,且增幅与H2O2加入量成正比.这是因为咖啡因废水中加入了双氧水后,迅速产生大量的羟基自由基导致咖啡因结构发生改变,吸收峰位置和吸光度也随之发生改变.由曲线2和6比较也可得出,紫外光照射6 h的咖啡因废水因为加入了H2O2而使吸收曲线中206 nm和273 nm处的特征峰均消失.这些都表明导致咖啡因分解的主要因素是羟基自由基,这些羟基自由基一部分来自双氧水的分解,更大一部分来自体系经紫外光照射后的产物.
2.2 咖啡因降解效率的影响因素
2.2.1 光照时间和咖啡因废水初始质量浓度的影响 如图3所示,随着时间的推移,不同初始质量浓度的咖啡因被逐渐降解,0~3 h范围内降解速率较快,超过3 h,降解速率较慢,5 h以后降解速率更为缓慢.这主要和光解反应产生的中间体质量浓度高低有关.因此后续试验过程的光照时间控制在6 h为宜.
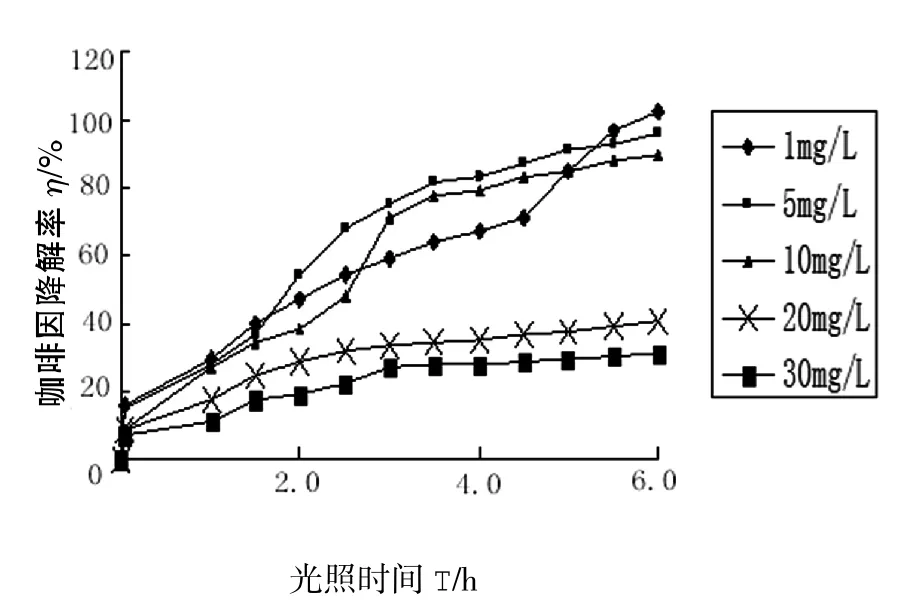
图3 光照时间和咖啡因废水初始质量浓度对光解率的影响Fig.3 Effect of illumination time and initial concentration of wastewater on photodissociation rate
不同初始质量浓度下咖啡因的降解率不同.咖啡因在初始质量浓度小于10 mg/L时光解率比较高,大于10 mg/L时咖啡因光解率显著下降.这是由于初始质量浓度大于10 mg/L时,催化剂TiO2表面吸附达到饱和,咖啡因质量浓度的大小对反应速度影响较小,其降解率主要取决于TiO2表面的电子-空穴对数量[5],而TiO2的质量浓度会直接影响电子-空穴对的产生,所以当催化剂质量浓度一定时,咖啡因质量浓度的再增大对后续的单元反应不会产生影响.所以当质量浓度超过10 mg/L时,光解率表现出相对下降的趋势.因此后续试验咖啡因废水初始质量浓度选定为10 mg/L.
2.2.2 纳米TiO2用量的影响 从图4可以看出,因为光解反应是在TiO2表面进行,所以咖啡因降解率随着咖啡因用量的增加先是迅速增加;当催化剂的用量较小时,咖啡因废水中TiO2的质量浓度较小,被吸附活化的咖啡因少,产生的羟基自由基也少,光催化降解效率不高;随着TiO2投加量的增加,反应液中的TiO2粒子质量浓度不断增加,产生羟基自由基的量也越多,咖啡因处理效果越好.当纳米TiO2用量超过1 g/L时,因为TiO2的不溶性导致反应液的浊度增加,透光率减小,阻挡紫外光的有效辐射深度,不利于羟基自由基的产生,造成催化剂的浪费,使得光催化降解效率下降[6].从经济角度考虑,TiO2的用量取1 g/L为最佳.
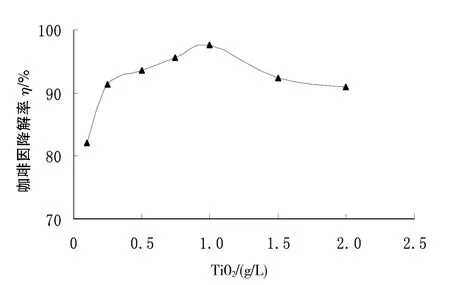
图4 纳米TiO2用量对咖啡因降解率的影响Fig.4 Effect of nano-TiO2dosage on the degradation rate of caffeine
2.2.3 pH的影响 图5为pH对咖啡因降解效率的影响.
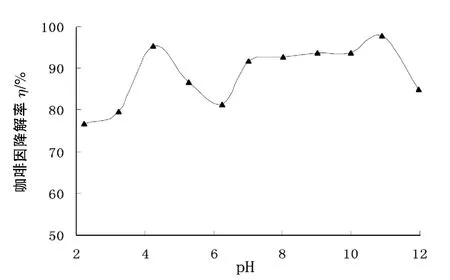
图5 pH值对咖啡因降解率的影响Fig.5 Effect of pH value on the degradation rate of caffeine
由图5可知,当溶液pH值为10.89时,纳米TiO2可以在光催化氧化的条件下最大限度地降解咖啡因,略高于pH值为4.23时的降解率.这是因为pH的变化会影响催化剂表面的电性,从而导致产物在TiO2表面的吸附行为也发生改变[7].不同pH值条件下,反应物在TiO2表面和羟基自由基的竞争吸附会影响光降解率,因为羟基自由基在TiO2表面的质量浓度决定了OH-的产生量[8].咖啡因在碱性条件下的降解率略高于酸性条件,主要是因为碱性条件下存在较多OH-,可直接失去电子生成羟基自由基·OH.综合考虑,反应的最佳pH选为10.89.
2.2.4 H2O2质量浓度的影响 由图6可知,当H2O2加入质量浓度小于1.0 g/L时,随着H2O2质量浓度的增加,咖啡因的降解速率逐渐增大,到1.0 g/L时,降解率达到最高.但H2O2质量浓度超过1.0 g/L时,随着H2O2质量浓度的继续增加,咖啡因降解率却有所降低.主要是因为H2O2是一种比氧更好的电子受体,在受到紫外光照射时会产生具有强氧化能力的·OH[9~10].
当H2O2捕获电子后,能有效降低催化剂表面电子-空穴对的碰撞几率,所以加入小于1.0 g/L的H2O2时,咖啡因降解率迅速增加;当溶液中H2O2大于1.0 g/L时,H2O2又可充当·OH的捕获体[11],导致咖啡因降解率又呈下降趋势.
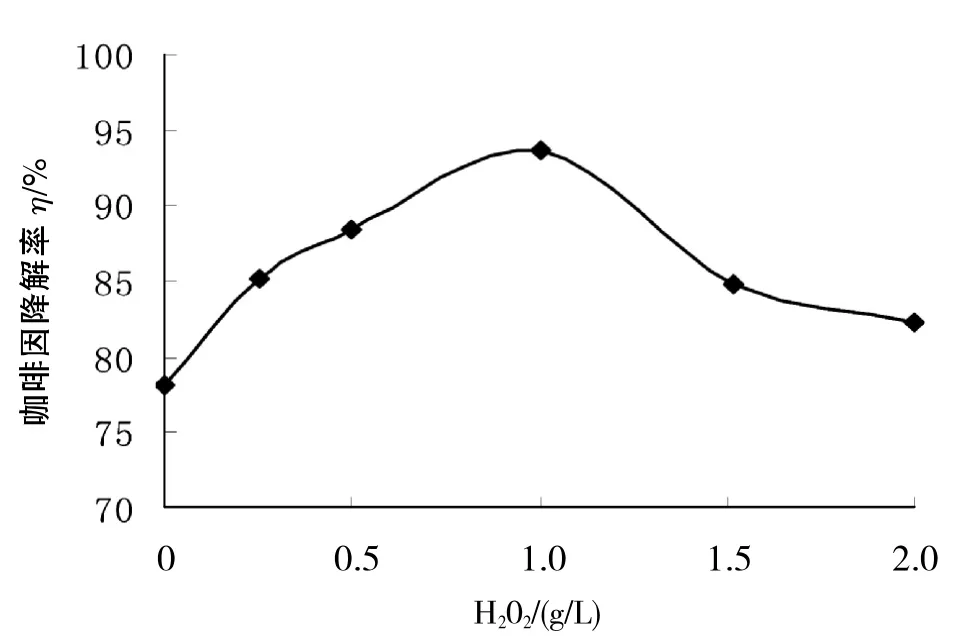
图6 H2O2质量浓度对咖啡因降解率的影响Fig.6 Effect of the concentration of H2O2on the degradation rate of caffeine
3 小结
纳米TiO2光催化降解咖啡因最佳条件是:紫外光照射6 h,pH值为10.89,咖啡因废水初始质量浓度为10 mg/L,纳米TiO2用量为1 g/L,H2O2质量浓度为1.0 g/L.
参考文献:
[1]Swarnalatha B,Anjaneyulu Y.Studies on the heterogeneous photocatalytic oxidation of 2,6-dinitrophenol in aqueous TiO2suspension[J].Chemical,2004,223:161-165.
[2]MichaelL,HitchmanFT.StudiesofTiO2thinfilmspreparedbychemicalvapourdepositionforphotocatalyticand hotoelectrocatalytic degradation of 4-chlorophenol[J].Electroanalytical Chemical,2002,538:165-172.
[3]Andjelka S,Topalov,Daniela V,et al.Photocatalytic activity of synth esized nanosized TiO2toward the degradation of herbicide meloprop[J].Environ,2004,54:125-133.
[4]蔡磊,韩旭,邓慧萍.复合光催化剂ZrO2-TiO2催化降解咖啡因的试验研究[J].河南科学,2013,31(7):29-33.
[5]俞成林,权红恩,康勇.硅藻土基纳米TiO2降解甲醛的试验研究[J].环境科学学报,2012,32(1):116-122.
[6]陈志铮,刘勇弟,化艳娇,等.光催化氧化(UV+TiO2)法处理印染废水生化出水及其各类有机物去除[J].环境化学,2013,32 (9):1792-1796.
[7]李佑稷,李效东,李君文,等.TiO2/活性炭复合体对罗丹明B的光催化降解[J].环境化学,2004,23(6):650-654.
[8]李景印,郭玉凤,张亚通,等.4-氯酚在TiO2纳米膜上光催化降解及反应动力学特征[J].化学研究与应用,2003,15(2):221-223.
[9]Wong C C,Chu W.The hydrogen peroxide-assisted photocatalytic degradation of alachlor in TiO2suspension[J].Environ Sci Technol,2003,37:2310-2316.
[10]So C M,Cheng M Y,Yu J C,et al.Degradation of azo dye procion red MX-5B by photocatalytic oxidation[J].Chemosphere, 2002,46:905-912.
[11]Lingam G S,Priya M H,Madras G.Kinetics of the photodegradation of Substituted phenols by solution combustion synthesized[J]. Applied Catzlysis B:Environmental,2004,51:67-76.
(责任编辑:卢奇)
Photocatalytia degradation of caffeine in the waste water
GAO Xiangyang1,SHAO Linlin2
(1.Henan Nonferrous Aluminum Co.Huiyuan,Pingdingshan 467311,China;2.China-Singapore Suzhou Industrial Park Environmental Technology Co.,Ltd,Suzhou 210054,China.)
UV lamp as light source,nanosize TiO2as photocatalist,the effect of degradation of caffeine in solution on the photocatalytic reaction were discussed.The best reaction facters were as follows:the initial concentration of caffine was 10 mg/L,the concentration of nanosize TiO2was 1 g/L,the pH value was 10.89,the concentration of H2O2was 1.0 g/L.
photocatalytic degradation;nanosize TiO2;caffeine
X703
:A
:1008-7516(2015)05-0071-05
10.3969/j.issn.1008-7516.2015.05.015
2015-06-10
高向阳(1975-),男,河南永城人,助理工程师.主要从事工业及生活污水处理、废水深度治理研究.

