胃袖状切除附加空回肠吻合术对ZDF大鼠GLP-1蛋白表达的影响
周小钢,王恺京,徐安安,高 玮,陆佳军,朱江帆
(同济大学附属东方医院,上海,200120)
近年,减重手术作为治疗2 型糖尿病及相关代谢性疾病的重要手段,其作用效果已得到了众多临床资料与实验数据的证实[1-2]。术式主要有胃袖状切除(sleeve gastrectomy,SG)、胃旁路术及胃袖状切除附加转流术等。研究表明,胰高血糖素样肽-1(glucagonlike peptide 1,GLP-1)分泌水平变化可能是减重手术治疗2 型糖尿病的主要机理[3]。GLP-1 主要是由末端回肠L 细胞分泌,GLP-1 分泌的增强主要由于食物较早地刺激末端回肠L 细胞引起,可有效降低血糖[4-6]。我们之前的研究发现SG 组与胃袖状切除附加空回肠吻合(sleeve gastrectomy plus side-to-side jejunoileal anastomosis,JI-SG)组术后血清GLP-1 水平明显升高[7],然而L 细胞组织学是否发生了改变,对此我们不得而知。基于此,我们在SG 的基础上附加空回肠吻合术,从而使得食物提早刺激末端回肠,观察末端回肠黏膜组织L 细胞组织学改变及相应血液激素水平的改变,从而探讨GLP-1 分泌水平改变的原因,并进一步检验GLP-1 在减重手术中的作用,进而优化减重手术方式。
1 资料与方法
1.1 实验动物准备与分组 雄性10 周龄糖尿病肥胖(Zucker diabetic fatty,ZDF)大鼠30 只(购于北京维通利华实验动物技术有限公司),饲养于同济大学动物实验中心无特定病原体(specific pathogen free,SPF)环境中,将大鼠按随机数字表法分为假手术(sham surgery,SS)组、SG 组与JI-SG组。JI-SG 组行胃袖状切除附加空回肠侧侧吻合术,SG 组行袖状胃切除术,SS 组行假手术。
1.2 实验动物手术干预 SG 组手术方法[8]:沿胃部大弯侧纵行切除整个胃底及约3/4 胃体,缝合胃切缘止血后将胃置于原位;JI-SG 组手术方法:上述胃袖状切除后距Treitz 韧带及回盲瓣各20 cm 游离出空肠、回肠并行侧侧吻合术;SS 组手术方法:大鼠开腹后即关闭。各实验组关腹前均腹腔注射1 ml 庆大霉素,三组实验时间大致相等,以消除手术应激对结果的影响。
1.3 标本的制备 血清学标本:术前2 d 及术后规律两周一次取眶静脉血约0.5 ml,离心后取上清液置于-20 摄氏度冰箱保存;组织学标本:于术后第12 周处死大鼠,并取距回盲瓣5 cm 末端回肠组织,置于4%多聚甲醛溶液中固定24 h,切片机制备石蜡切片。
1.4 检测项目及方法
1.4.1 血糖 术前2 d 及术后两周一次眶静脉采血,使用罗氏血糖仪检测其血糖水平。
1.4.2 末端回肠黏膜GLP-1 水平测定 采用免疫组化SP法,常规脱蜡水化后抗原修复;放入3%过氧化氢溶液,孵育25 min;滴加Ⅰ抗(购自美国Abcam 公司),稀释比例为1∶100;滴加Ⅱ抗,室温孵育50 min;DAB 显色,阳性为棕黄色,苏木素复染,中性树胶封片。显微镜下玻片组织充满视野拍照,应用Image-Pro Plus 6.0 软件选取相同的棕黄色作为判断所有照片阳性的统一标准,对每张照片进行分析得出每张照片阳性的累积光密度值(integral optical density,IOD),保存图片中组织的面积(AREA),IOD/AREA 计算出平均光密度值(Mean Density)。
1.4.3 血清胰岛素、GLP-1 水平测定 采用ELISA 法检测大鼠血清胰岛素及GLP-1 水平,操作步骤严格按照试剂盒说明书(购自美国R&D 公司)进行。
1.5 统计学处理 采用SPSS 17.0 软件进行统计学分析,量化数据用(均数±标准差)表示,所获数据呈正态分布,多组间比较采用单因素方差分析,组间两两显著性检测采用LSD-t 检验;P <0.05 表示差异有统计学意义。
2 结 果
2.1 存活率 SS 组大鼠均存活,存活率100%;SG组大鼠死亡1 只,术后第2 天吻合口漏腹腔感染死亡,存活率为90%;JI-SG 组死亡3 只,其中2 只术后第10 天吻合口粘连狭窄引起梗阻而死亡,另1 只于术后第20 天极度消瘦死亡。3 组总的存活率为86.7%。
2.2 回肠末端黏膜组织学检测 GLP-1 的产生部位主要位于大鼠回肠末端黏膜组织L 细胞,细胞数量较多,胞质深染。阳性强度分为4 级:染色无色计为0,淡黄色为1,棕黄色2,棕褐色为3。平均光密度值评估GLP-1 在回肠末端黏膜组织表达水平,SS组、SG 组及JI-SG 组分别为:0.008492 ±0.0019246,0.009091 ±0.0021523,0.011408 ±0.0027251。JISG 组平均光密度明显高于SS 组及SG 组(P <0.05),局部可见L 细胞增生。SG 组平均光密度值高于SS 组。见图1、图2、表1。
2.3 血清GLP-1 水平改变 术前各组血清GLP-1水平差异无统计学意义(P >0.05),术后SS 组与术前水平差异无统计学意义(P >0.05)。SG 组术后GLP-1 水 平 缓 慢 上 升,至 12 周 达(1. 79 ±0.12)pmol/L,高于SS 组(P <0.05)。术后2 周JISG 组由术前(1.69 ±0.1)pmol/L 上升至(1.92 ±0.12)pmol/L,随后缓慢上升,至12 周达(1.97 ±0.11)pmol/L,术后各时间点与术前相比差异均有统计学意义(P <0.05),术后同时间点与其他两组的差异也具有统计学意义(P <0.05)。见表2。
2.4 血糖水平改变 术前各组血糖水平差异无统计学意义(P >0.05),术后2 周SG 及JI-SG 组血糖即有明显下降,术后2 周SG 组血糖水平由术前(11.4 ±3.1)mmol/L 降至(6.9 ±1.6)mmol/L,随后逐渐恢复上升,并超过术前水平,至12 周升至(13.4 ±2.8)mmol/L,但同时间点低于SS 组,差异有统计学意义(P <0.05)。术后2 周JI-SG 组血糖水平由 术前(12. 4 ± 1. 5)mmol/L 降至(6. 3 ±0.7)mmol/L,随后长时间保持稳定水平,至12 周达到(5.1 ±0.9)mmol/L,同时间点明显低于SS 组及SG 组(P <0.05)。见表3。
2.5 血清胰岛素水平的改变 术前各组胰岛素水平差异无统计学意义(P >0.05),SS 组胰岛素水平呈现缓慢上升,至12 周达(7.51 ±1.6)mU/L。术后2 周,SG 组、JI-SG 组 分 别 由 术 前(5. 13 ±1.2)mU/L、(5. 24 ± 1. 1)mU/L 升 至(6. 53 ±1.4)mU/L、(6.57 ±1.3)mU/L ,呈现与SS 组相同趋势。随后缓慢下降,术后12 周SG 组达到(5.21±1.4)mU/L水平,与术前相比差异无统计学意义(P >0.05);JI-SG 组达到(4.53 ±1.3)mU/L,明显低于术前及其他两组水平(P <0.05)。见表4。
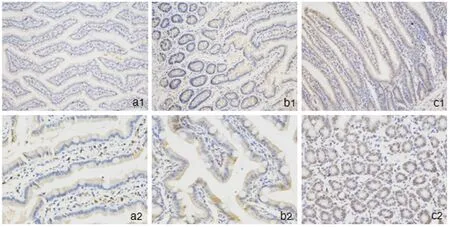
图1 各组末端回肠粘膜组织GLP-1 蛋白表达(1-HE ×200;2-HE ×400)a:SS 组GLP-1 蛋白,胞质淡染;b:SG 组GLP-1 蛋白,胞质染色偏黄色;JI-SG 组GLP-1 蛋白,胞质深染,为棕黄色,细胞数量明显增加。
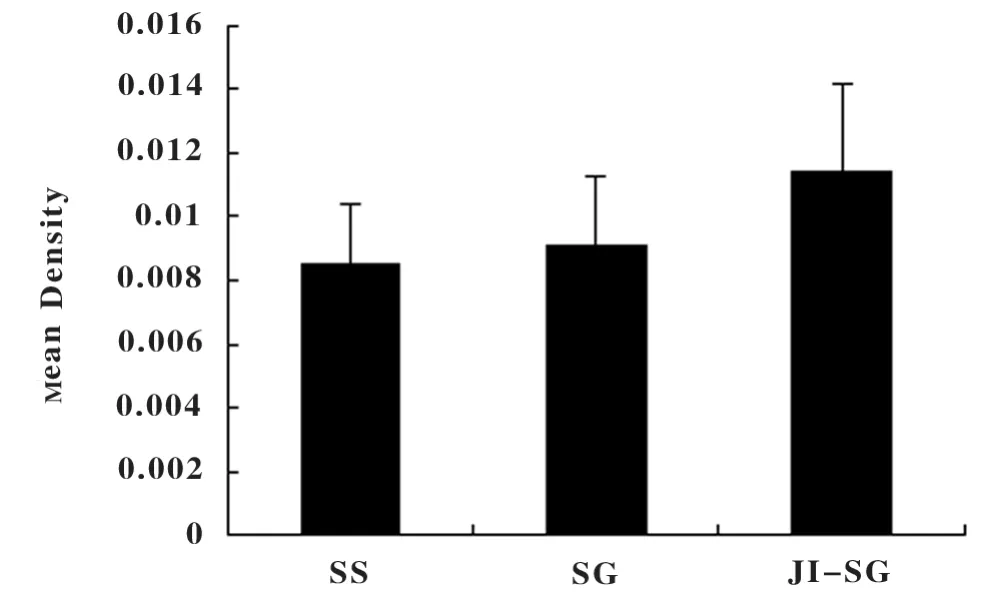
图2 各组GLP-1 在末端回肠黏膜组织表达比较
表1 末端回肠黏膜组织GLP-1 表达光密度值的比较(±s)
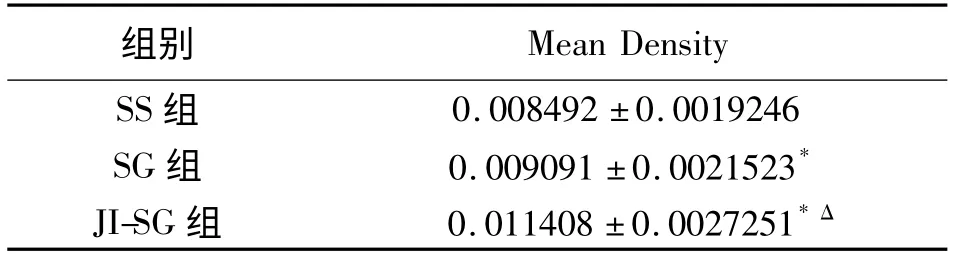
表1 末端回肠黏膜组织GLP-1 表达光密度值的比较(±s)
* P <0.05 vs.SS 组,ΔP <0.05 vs.SG 组
?
表2 各组手术前后血清GLP-1 水平的比较[(±s),ρ/pmol·L-1]
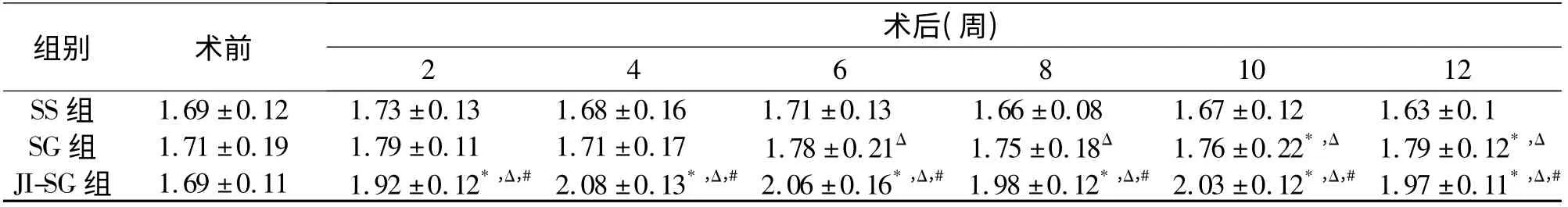
表2 各组手术前后血清GLP-1 水平的比较[(±s),ρ/pmol·L-1]
* P <005 vs.术前;ΔP <0.05 vs.SS 组;#P <0.05 vs.SG 组
?
表3 各组手术前后血糖水平的比较[(±s),ρ/pmol·L-1]

表3 各组手术前后血糖水平的比较[(±s),ρ/pmol·L-1]
* P <005 vs.术前;ΔP <0.05 vs.SS 组;#P <0.05 vs.SG 组
?
表4 各组手术前后胰岛素水平的比较[(±s),ρ/mU·L-1]

表4 各组手术前后胰岛素水平的比较[(±s),ρ/mU·L-1]
* P <005 vs.术前;ΔP <0.05 vs.SS 组;#P <0.05 vs.SG 组
?
3 讨 论
SG 是近年备受关注的减重术式之一,具有手术操作简单、安全、有效、并发症发生率低等优点[9-12],然而一些资料也表明了SG 疗效不如转流术、长期疗效不明确、术后容易反弹等缺点[13-14]。Melissas等[15]将JI-SG 与单纯SG 进行了对比分析,发现JISG 在改善2 型糖尿病方面明显优于SG;同时也发现JI-SG 术后食物自十二指肠到达盲肠时间为11 min,而SG 术后需要31 min;JI-SG 术后未出现死亡或重大手术并发症。JI-SG 操作简单、不改变肠道结构的连续性,因此认为JI-SG 是简单、安全、有效的减重术式;同时空回肠吻合术可在单纯SG 失败或术后出现反弹的情况下再行实施。本实验采用ZDF 大鼠制作JI-SG 模型,观察术后降糖作用及相应激素水平的改变,以探讨可能机制。
通过观察比较我们发现,JI-SG 组GLP-1 水平的血清学检测水平明显高于SG 组与SS 组,组织学检测发现JI-SG 组蛋白表达水平显著增加,染色为棕黄色,同时伴有L 细胞的增生。在血糖控制、胰岛素水平方面,JI-SG 均体现出优势,JI-SG 术后血糖保持稳定的低水平,而SG 组血糖在术后第二周达到最低值后缓慢回升,表明SG 具有降糖的疗效,同时也存在血糖反弹的现象,这与Himpens 等[16]的研究结果一致。然而是什么原因导致了JI-SG 在治疗2型糖尿病方面的显著疗效?食物较早刺激末端回肠可显著增强GLP-1 的分泌,而GLP-1 水平升高是导致血糖下降的关键因素。GLP-1 主要由末端回肠L细胞分泌产生,GLP-1 可促进糖原合成、增加胰岛素基因表达、胰岛素的分泌、抑制胰高血糖素分泌、促进β 细胞增生并抑制其凋亡[17-20];目前GLP-1 降糖疗效已得到证实,相关药物已应用于临床[21]。本实验中血清GLP-1 水平在第2 周即有明显上升,之后保持稳定水平,第12 周组织学检测发现L 细胞分泌GLP-1 功能增强同时伴有显著增生,我们认为L 细胞在发生组织学改变前即有分泌功能增强现象,长期的代偿作用导致细胞的增生,这种组织学改变可能是机体长期维持GLP-1 高水平的重要原因。
SG 组大鼠的胃肠道生理结构并未改变,但其组血浆GLP-1 水平及蛋白表达水平均有提高,现有资料表明[22-24],SG 手术切除胃底、大部分胃体,导致体内Ghrelin 激素水平降低,而Ghrelin 可抑制胰岛素的分泌及外周组织利用葡萄糖,同时Ghrelin 可促进胃排空,使得食物较早刺激回肠产生较多GLP-1,因此Ghrelin 激素水平的降低可能是SG 对2 型糖尿病有治疗效果的原因之一。朱江帆等[25]则提出“胃中心学说”,认为减重手术关键环节在胃大弯,现有主流减重手术均减少了食物对胃的刺激。很有可能导致某种特殊因子分泌减少,从而缓解胰岛素抵抗,交感神经张力降低,导致糖尿病、高血压、多囊卵巢综合征等代谢性疾病得到缓解,因此更多的胃肠道未知激素尚待研究。
本实验证实了JI-SG 治疗ZDF 大鼠2 型糖尿病的持续有效性,其主要作用机制可能与末端回肠L细胞增生及其分泌GLP-1 增强有关。JI-SG 使部分未消化食糜较早进入末端回肠,起到吸收不良的作用,同时未完全消化食糜较早刺激末端回肠L 细胞,促进其分泌GLP-1 激素。空回肠侧侧吻合术使包括旷置肠段在内的肠攀均有食物通过,可避免因肠襻旷置导致的菌群改变、胆汁酸代谢改变、旷置肠襻细胞萎缩等问题。“尽量减少胃肠道结构破坏同时获得最佳减重及改善代谢效果”是减重手术改进的努力方向,此术式为术式改进提供了一个方案,其疗效尚待临床长期的随访研究。
[1]Pories WJ.Diabetes:the evolution of a new paradigm[J].Ann Surg,2004,239(1):12-13.
[2]Kopelman PG.Obesity as a medical problem[J].Nature,2000,404(6778):635-643.
[3]Tammy L,Kindel Stephanie M,Yoder Randy J,et al.Duodenal-jejunal exclusion improves glucose tolerance in the diabetic,Goto-Kakizaki rat by a GLP-1 receptor-mediated mechanism[J].J Gastrointest Surg,2009,13(10):1762-1772.
[4]Wang TT,Hu SY,Gao HD,et al.Ileal transposition controls diabetes as well as modified duodenal jejunal bypass with better lipid lowering in a nonobese rat model of type II diabetes by increasing GLP-1[J].Ann Surg,2008,247(6):968-975.
[5]Patriti A,Facchiano E,Annetti C,et al.Early improvement of glucose tolerance after ileal transposition in a non-obese type 2 diabetes rat model[J].Obes Surg,2005,15(9):1258-1264.
[6]De Paula AL,Stival AR,Macedo A,et al.Prospective randomized controlled trial comparing 2 versions of laparoscopic ileal interposition associated with sleeve gastrectomy for patients with type 2 diabetes with BMI 21-34 kg/m2[J]. Surg Obes Relat Dis,2010,6(3):296-304.
[7]王恺京,徐安安,周小钢,等.袖状胃切除术附加空回肠侧侧吻合术减重与代谢改善作用[J].中华消化外科杂志,已接受.
[8]王恺京,徐安安,周小钢,等.ZDF 大鼠胃袖状切除附加空回肠侧侧吻合术动物模型的建立[J].腹腔镜外科杂志,2015,20(1):1-4.
[9]Melissas J,Koukouraki S,Askoxylakis J,et al.Sleeve gastrectomy-a restrictive procedure?[J].Obes Surg,2007,17(1):57-62.
[10]Aggarwal S,Kini SU,Herron DM.Laparoscopic sleeve gastrectomy for morbid obesity:a review[J].Surg Obes Relat Dis,2007,3(2):189-194.
[11]Cottam D,Qureshi FG,Mattar SG,et al.Laparoscopic sleeve gastrectomy as an initial weight-loss procedure for high—risk patients with morbid obesity[J].Surg Endosc,2006,20(6):859-863.
[12]Kodama Y,Zhao CM,Kulseng B,et al.Eating behavior in rats subjected to vagotomy,sleeve gastrectomy,and duodenal switch[J].Gastrointest Surg,2010,14(10):1502-1510.
[13]Rice RD,Simon TE,Seery JM,et al. Laparoscopic sleeve gastrectomy:outcomes at a military training center[J]. Am Surg,2010,76(8):835-840.
[14]Langer FB,Bohdjalian A,Shakeri-Leidenmiihler S,et al.Conversion from sleeve gastrectomy to Roux-en-Y gastric bypass-indications and outcome[J].Obes Surg,2010,20(7):835-840.
[15]Melissas J,Peppe A,Askoxilakis J,et al.Sleeve gastrectomy plus side-to-side jejunoileal anastomosis for the treatment of morbid obesity and metabolic diseases:a promising operation[J].Obes Surg,2012,22(7):1104-1109.
[16]Himpens J,Dobbeleir J,Peeters G. Long-term results of laparoscopic sleeve gastrectomy for obesity[J]. Ann Surg,2010,252(2):319-324.
[17]Mingrone G,Castagneto-Gissey L.Mechanisms of early improvement/resolution of type 2 diabetes after bariatric surgery[J].Diabetes Metab,2009,35(6):518-523.
[18]Buchwald H,Avidor Y,Braunwald E,et al. Bariatric surgery:a systematic review and meta-analysis[J]. JAMA,2004,292(14):1724-1737.
[19]MaeDonald PE,EI-Koly W,Riedel MJ,et al.The multiple actions of GLP-1 on the process of glucose-stimulated insulin secretion[J].Diabetes,2002,51 Suppl 3:S434-S442.
[20]de Gordejuela AG,Pujol Gebelli J,García NV,et al.Is sleeve gastrectomy as effective as gastric bypass for remission of type 2 diabetes in morbidly obese patients?[J].Surg Obes Relat Dis,2011,7(4):506-509.
[21]Jørgensen NB,Dirksen C,Bojsen-Møller KN,et al.Exaggerated glucagon-like peptide 1 response is important for improved βcell function and glucose tolerance after Roux-en-Y gastric bypass in patients with type 2 diabetes[J].Diabetes,2013,62(9):3044-3052.
[22]Tharakan G,Tan T,Bloom S. Emerging therapies in the treatment of‘diabesity’:beyond GLP-1[J]. Trents Phamacol Sci,2011,32(1):8-15.
[23]Murata M,Okimura Y,lida K,et al.Ghrelin modulates the downstream molecules of insulin signaling in hepatoma cells[J].J Biol Chem,2002,277(7):5667-5674.
[24]Broglio F,Gottero C,Benso A,et al.Effects of ghrelin on the insulin and glycemic responses to glucose,arginine,or free fatty acids load in humans[J].J Clin Endocrinol Metab,2003,88(9):4268-4272.
[25]朱江帆,周小钢.腹腔镜胃袖状切除术临床应用价值[J].中国实用外科杂志,2014,34(11):1032-1035.
- 腹腔镜外科杂志的其它文章
- 胃十二指肠三角吻合术应用于胃癌全腹腔镜远端胃切除术的可行性分析

