鹅输卵管TLR家族基因差异表达的研究
应诗家, 戴子淳,2, 郭佳佳, 李 辉, 雷明明, 施振旦, 沈明君
(1.江苏省农业科学院畜牧研究所/动物品种改良和繁育重点实验室,江苏 南京 210014;2.南京农业大学动物科技学院,江苏 南京 210095;3.扬州朝天歌农牧科技有限公司,江苏 扬州 225000)
禽类输卵管的伞部、峡部、膨大部、子宫部和阴道部在种蛋形成过程中具有重要的作用,其阴道部和泄殖腔特有的生理结构极易导致粪便中的病原微生物经阴道沿输卵管腔感染输卵管其他部位[1]。此外,种鹅的赖水习性也极易引起养殖水体病原微生物通过交配进入种鹅生殖道,诱发输卵管炎症反应,影响种蛋受精率和孵化率[2-3]。因此,种鹅输卵管自身的非特异性免疫功能对抵御病原微生物侵害至关重要。
Toll样受体(TLRs)是一类病原识别模式受体,识别病原微生物及其代谢产物,启动胞内信号级联效应,诱导非特异性免疫反应,抵御病原微生物侵染[4-5]。已发现的禽类TLR家族包括TLR1-1、TLR1-2、TLR2-1、TLR2-2、TLR3、TLR4、TLR5、TLR7、TLR15和TLR21共10个基因[6]。这些TLRs的时空表达对识别病原微生物,启动非特异性免疫反应,维持组织器官功能具有重要的作用。Ozoe等对 TLR1-1、TLR1-2、TLR2、TLR3、TLR14、TLR5和TLR7的研究发现TLR1-1在输卵管各部位均不表达,TLR2、TLR3和TLR14在阴道、子宫和伞部组织表达显著高于膨大部[7]。华国洪和刘少丰等分别研究了鹅TLR2-1和TLR15[8]、TLR3和TLR5[9]基因在皮肤、脾脏和法氏囊等11种组织器官中的差异表达。然而,国内外对鹅输卵管TLR家族基因的研究尚无报道。
本试验拟系统地研究已发现的10种禽TLR家族基因在产蛋高峰期种鹅输卵管伞部、峡部、膨大部、子宫部和阴道部的表达变化,为种鹅输卵管启动非特异性免疫反应,抵御病原微生物侵染的分子调控机理研究奠定基础。
1 材料与方法
1.1 试验动物
在扬州朝天歌农牧科技有限公司所属的瑞农农业专业合作社随机选择5只产蛋高峰期扬州鹅,产蛋后8 h(新生蛋运行至子宫部[10])颈动脉放血屠宰,取输卵管伞部、峡部、膨大部、子宫部和阴道部以及脾脏组织样,液氮保存。
1.2 主要试剂
100 bp Marker和 PrimeScriptTMRT Master Mix购自宝生物工程(大连)有限公司,Taq PCR Master Mix购自南京博尔迪生物科技有限公司,astStart U-niversal SYBR Green Master购自罗氏诊断产品(上海)有限公司,含Dase I的RNA提取试剂盒购自天根生化科技(北京)有限公司。
1.3 总RNA提取和反转录
取小块伞部、峡部、膨大部、子宫部、阴道部和脾脏组织,按天根试剂盒说明书提取总RNA。RNA质量检测合格后,参照TaKaRa反转录试剂盒说明书,合成cDNA第1链,-20℃保存备用。反应体系为10.00 μl(2.00 μl 5×PrimeScript® Buffer,8.00 μl RNA)。反转录程序:37℃ 15 min,85℃ 5 s,4℃保存。
1.5 PCR反应和测序
根据GenBank登录号,利用Primer Premier 5.0软件设计引物,其中TLR1-1、TLR1-2和TLR21的引物根据鸭相应的序列信息设计,引物信息见表1,由上海英骏生物技术有限公司合成。
PCR反应体系为10.00 μl:2×Taq PCR Master Mix 5.00 μl,ddH2O 3.50 μl,上游和下游引物各0.25 μl,RT产物1.00 μl。
反应程序为:95℃预变性5 min;95℃变性30 s,50/57/60℃退火30 s,72℃延伸30 s,40个循环; 72℃延伸7 min,4℃保存。PCR产物用3%琼脂糖凝胶电泳初步鉴定,由上海英骏生物技术有限公司测序。

表1 定量PCR引物信息Table 1 Primer pairs used for real-time PCR
1.6 Real-time PCR分析
以管家基因β-actin为内参,每个样品重复3次,取平均Ct值进行计算,所得试验数据按2-△△Ct结果统计分析。
定量PCR反应体系为20 μl:1.00 μl RT产物,上游引物和下游引物各0.60 μl,7.80 μl ddH2O,10.00 μl FastStart Universal SYBR Green Master (ROX)。反应程序为:50℃2 min,95℃预变性10 min;95℃变性15 s,50/57/60℃退火30 s,72℃30 s,共40个循环。
1.7 统计分析
数据采用SPSS 13.0软件统计分析,结果以“平均值 ±标准误”表示。试验数据采用单因子方差分析,Duncan法多重比较。
2 结果与分析
2.1 鹅输卵管TLRs家族基因表达谱
分别采用设计的引物进行RT-PCR扩增,并以脾脏的扩增产物为阳性对照,PCR产物电泳检测结果与欲扩增目的片段大小一致(图1)。通过测序,并与GenBank已登录的序列(表1)比对,相似性达到97%以上,表明PCR扩增片段为鹅TLR家族基因片段。
基因表达试验结果(图1)显示,目前已发现的禽类10种TLR家族基因均在鹅输卵管中表达,除膨大部未发现TLR1-1表达和子宫部组织未发现TLR5表达外,输卵管伞部、峡部、膨大部、子宫部和阴道部均表达其他TLR家族基因。

图1 鹅输卵管和脾脏TLR1-1家族基因表达谱Fig.1 Gene expression profiling of Toll-like receptors in geese oviduct and spleen tissues
2.2 鹅TLR家族基因在输卵管不同功能部位的差异表达
鹅TLR家族基因在输卵管不同功能部位的差异表达见表2。TLR2-2和TLR21在输卵管伞部、峡部、膨大部、子宫部和阴道部表达差异不显著(P>0.05);TLR1-1、TLR3、TLR5和TLR15 4个基因在阴道部高表达;TLR14和TLR5 2个基因在峡部高表达;TLR1-2和 TLR2-1 2个基因在伞部高表达; TLR2-1和TLR7分别在膨大部和子宫部中高表达。
阴道部TLR1-1表达显著高于伞部(P<0.05),TLR3表达显著高于伞部、峡部和膨大部 (P<0.05),TLR5表达显著高于伞部和膨大部 (P<0.05),TLR15表达显著高于子宫部(P<0.05);伞部TLR1-2和TLR2-1表达显著高于峡部和阴道部(P<0.05);峡部TLR14表达显著高于子宫部和阴道部 (P<0.05),TLR5显著高于伞部和膨大部(P<0.05);膨大部TLR2-1表达显著高于峡部和阴道部(P<0.05);子宫部TLR7表达显著高于伞部、峡部、膨大部和阴道部(P<0.05)。
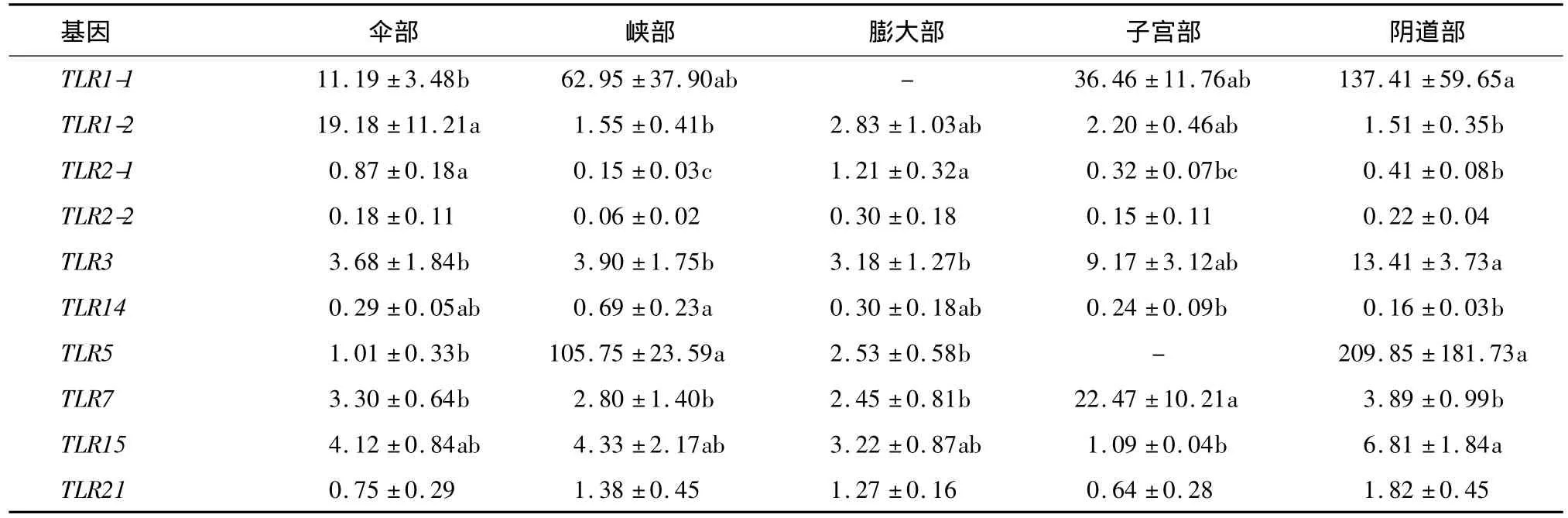
表2 鹅TLR家族基因在输卵管不同功能部位的差异表达Table 2 Differential expression of TLRs gene in all segments of geese oviduct
3 讨论
非特异性免疫反应是机体抵抗感染性疾病的第一道屏障,而TLR家族基因是非特异性免疫反应的关键调节基因[11-12],也是连接非特异性免疫和特异性免疫的桥梁[13]。目前已发现禽类TLR家族包含10种基因,其中大多数基因在禽类卵巢[6]、输卵管[7]和睾丸[14]中表达,参与性腺免疫反应,维持性腺功能稳态。本试验系统研究了10种TLR家族基因在鹅输卵管不同功能部位的差异表达,结果显示禽类10种TLR家族基因均在鹅输卵管中表达,表明鹅输卵管存在抵御病原微生物侵染的非特异性免疫反应。与鸡输卵管的研究结果类似[7],TLR1-1、TLR2、TLR3、TLR4和TLR7均在输卵管各个功能部位表达,TLR5在鹅输卵管的子宫部不表达。TLR5具有识别细菌鞭毛蛋白的功能[15],因此,本试验的结果也表明家禽和水禽输卵管非特异性免疫反应存在种间差异,并且鹅输卵管子宫部识别细菌鞭毛蛋白的能力可能弱于鸡的子宫。
禽类的输卵管极易受多种病原微生物感染,如沙门氏菌[16-17]、支气管炎病毒[18]和禽流感病毒[19]等,而TLR家族基因可识别广泛的病原微生物及其代谢产物[20]。研究结果表明TLR1可识别肽聚糖、脂磷壁酸、阿拉伯糖甘露糖脂及酵母和真菌的酵母多糖[15];TLR2除具有TLR1的识别功能外还可识别革兰氏阴性菌释放的LPS[15];TLR3识别双链RNA,同时可以感受到dsRNA病毒、SSRNA病毒和DNA病毒的感染[15,21];TLR4识别革兰氏阴性菌释放的LPS[6,7,22];TLR5识别细菌鞭毛蛋白[15];TLR7识别单链RNA[15];TLR15识别革兰氏阴性菌;TLR21识别细菌基因组产生的未甲基化CpG DNA序列[20]。因此,鹅输卵管不同功能部位表达大多数TLR家族基因,可有效识别各类病原微生物及其代谢产物,启动非特异性免疫反应。本试验中,TLR家族的4个基因在阴道部高表达,2个基因分别在峡部和伞部高表达,仅1个基因在膨大部和子宫部高表达,说明鹅输卵管的两端部位识别病原微生物的能力最强。
[1] MIYAMOTO T,HORIE T,FUKATA T,et al.Changes in microflora of the cloaca and oviduct of hens after intracloacal or intravaginal inoculation with Salmonella enteritidis[J].Avian Dis,1998,42(3):536-544.
[2] 林 勇,赵 伟,施振旦,等.经济实用型发酵床旱养鸭舍设计与建造[J].江苏农业科学,2012,40(8):372-373.
[3] JIANG D L,LIU L,WANG C L,et al.Raising on water stocking density reduces geese reproductive performances via water bacteria and lipopolysaccharide contaminations in‘Geese-Fish’production system[J].Agricultural Sciences in China,2011,10(9):1459-1466.
[4] KAISHO T,AKIRA S.Toll-like receptor function and signaling[J].J Allergy Clin Immunol,2006,117(5):979-987,988.
[5] 应诗家,赵伟,施振旦.禽类生殖系统非特异性免疫反应的研究进展[J].中国畜牧杂志,2013,49(23):87-90.
[6] SUBEDI K,ISOBE N,NISHIBORI M,et al.Changes in the expression of toll-like receptor mRNAs during follicular growth and in response to lipopolysaccharide in the ovarian follicles of laying hens[J].J Reprod Dev,2007,53(6):1227-1235.
[7] OZOE A,ISOBE N,YOSHIMURA Y.Expression of Toll-like receptors(TLRs)and TLR4 response to lipopolysaccharide in hen oviduct[J].Vet Immunol Immunopathol,2009,127(3-4):259-268.
[8] 华国洪.鹅TLR2-1、15基因的克隆、组织表达谱分析[D].广东:广东海洋大学,2012.
[9] 刘少丰.鹅TLR3和TLR5基因的克隆及其功能研究[D].广东:广东海洋大学,2012.
[10]马春祥,吴和光.白罗曼母鹅排卵与鹅蛋之形成[J].畜牧兽医学报,1996,27(1):32-39.
[11]SONODA Y,ABDEL MAGEED A M,ISOBE N,et al.Induction of avian beta-defensins by CpG oligodeoxynucleotides and proinflammatory cytokines in hen vaginal cells in vitro[J].Reproduction,2013,145(6):621-631.
[12]ADEREM A,ULEVITCH R J.Toll-like receptors in the induction of the innate immune response[J].Nature,2000,406(6797): 782-787.
[13]AKIRA S,TAKEDA K,KAISHO T.Toll-like receptors:critical proteins linking innate and acquired immunity[J].Nat Immunol,2001,2(8):675-680.
[14]ZHANG M,NII T,ISOBE N,et al.Expression of Toll-like receptors and effects of lipopolysaccharide on the expression of proinflammatory cytokines and chemokine in the testis and epididymis of roosters[J].Poult Sci,2012,91(8):1997-2003.
[15]KOGUT M H,IQBAL M,HE H,et al.Expression and function of Toll-like receptors in chicken heterophils[J].Dev Comp Immunol,2005,29(9):791-807.
[16]TAKATA T,LIANG J,NAKANO H,et al.Invasion of salmonella enteritidis in the tissues of reproductive organs in laying Japanese quail:an immunocytochemical study[J].Poult Sci,2003,82 (7):1170-1173.
[17]WIGLEY P,HULME S D,POWERS C,et al.Infection of the reproductive tract and eggs with Salmonella enterica serovar pullorum in the chicken is associated with suppression of cellular immunity at sexual maturity[J].Infect Immun,2005,73(5):2986-2990.
[18]CHOUSALKAR K K,ROBERTS J R.Ultrastructural study of infectious bronchitis virus infection in infundibulum and magnum of commercial laying hens[J].Vet Microbiol,2007,122(3-4): 223-236.
[19]PROMKUNTOD N,ANTARASENA C,PROMMUANG P.Isolation of avian influenza virus A subtype H5N1 from internal contents (albumen and allantoic fluid)of Japanese quail(Coturnix coturnix japonica)eggs and oviduct during a natural outbreak[J].Ann N Y Acad Sci,2006,1081:171-173.
[20] BROWNLIE R,ALLAN B.Avian toll-like receptors[J].Cell Tissue Res,2011,343(1):121-130.
[21]LEE H K,DUNZENDORFER S,SOLDAU K,et al.Doublestranded RNA-mediated TLR3 activation is enhanced by CD14[J].Immunity,2006,24(2):153-163.
[22] HEUMANN D,ROGER T.Initial responses to endotoxins and Gram-negative bacteria[J].Clin Chim Acta,2002,323(1-2): 59-72.

