虫草素的合成
刘 君,丁 杰,何 巍,谢 欢,梁兴勇
(四川理工学院化学与制药工程学院,四川自贡 643000)
虫草素又称 3'-脱氧腺苷,由 Cunningham[1]于1950年第一次从蛹虫草中分离得到。生物学研究发现虫草素具有抗肿瘤、抑菌、抗病毒、消炎等[2]广谱生物活性和药理作用。近年来研究人员发现虫草素可能具有增强人类免疫力[3]和清除因老龄化引起的体内自由基的功效[4]。另外,临床上已有以虫草素为主要成分的新药用于白血病的治疗[5],应用前景良好,因此具有巨大的市场潜力。但是,虫草素纯品的获得非常不易,因此国际市场上虫草素的价格非常昂贵。
目前,虫草素纯品主要通过从人工培育的蛹虫草中提取分离得到,操作繁琐、制备成本较高[6]。为了大规模的获取虫草素用于生物活性研究,我们首先尝试了对虫草花进行分离,但是最终只获得500 mg样品,纯度约93%。该方法成本太高,因此我们试图通过化学合成的方法获取虫草素。
通过对骨架分析可知,虫草素由一个3-脱氧的核糖和腺嘌呤进行糖苷化连接而成。目前文献报道的虫草素的化学合成工艺主要有两种:一是以腺苷(1)为原料,通过将1的3'-位羟基溴代,接着用自由基还原去除3'-位的卤素制备虫草素[7];二是利用木糖为原料通过多步基团保护,单独裸露出3-位羟基,接着用自由基还原反应制得3-脱氧核糖,再与1进行糖苷化连接制得虫草素[8]。
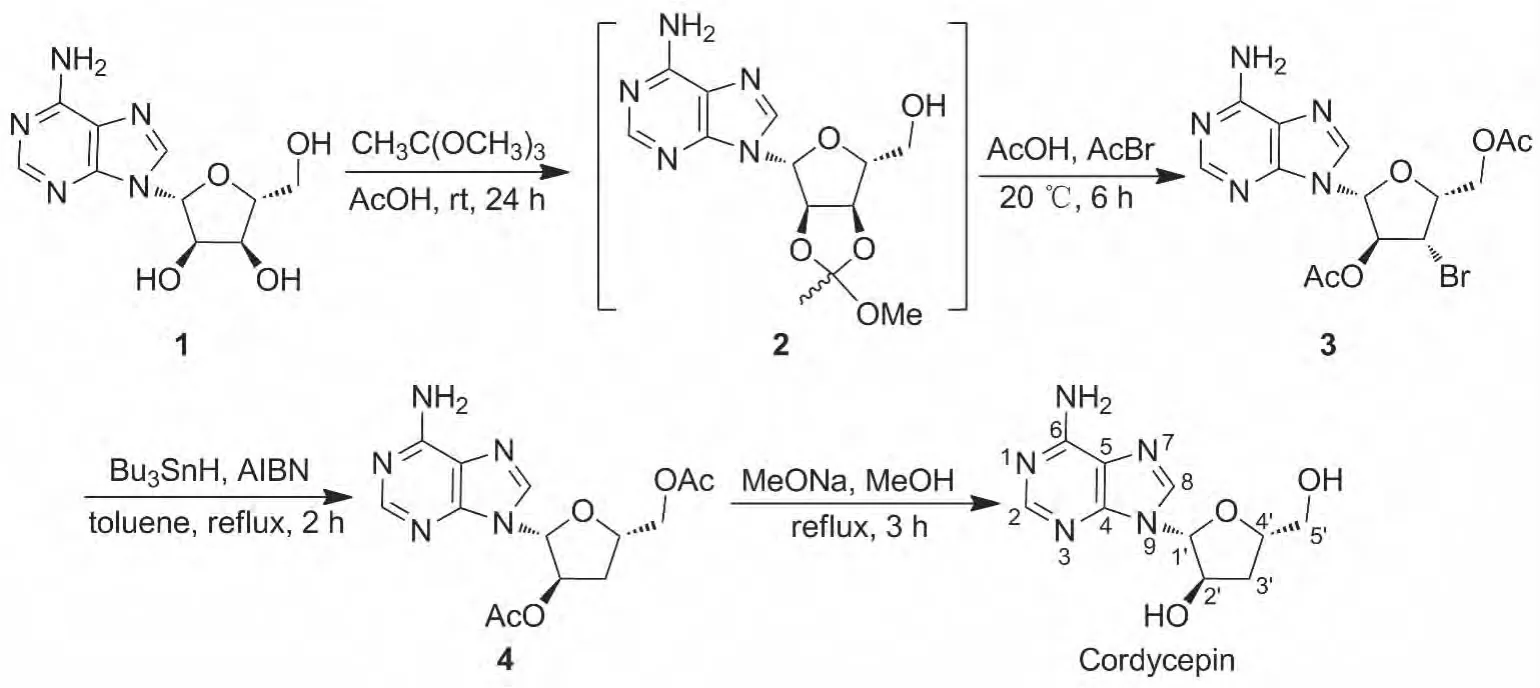
本文以1为原料[9],经3步反应简单快速地合成了虫草素。即1与原乙酸三甲酯在醋酸作用下反应制得2',3'-羟基原酸酯化的中间体(2),接着加入乙酰溴,水解2',3'-原酸酯,通过一锅两步法以40.5% 的收率制得 2',5'-O-二乙酰基-3'-溴代腺苷(3);3在三丁基氢化锡和偶氮异二丁腈(AIBN)作用下经还原脱溴反应制得2',5'-O-二乙酰基-3'-脱氧腺苷(4);4经水解去除糖环羟基上的乙酰基合成了虫草素,3步总收率29.8%,纯度>95%,其结构经1H NMR和MS确证[7]。本文还重点对3的合成条件进行了优化。
Scheme 1
1 实验部分
1.1 仪器与试剂
UV1900型双光束紫外分光光度计;Bruker 400 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Hitachi型高效液相色谱仪;5500 Q-Trap型液质联用仪。
高效薄层层析板,青岛海浪;柱层析用硅胶,200目~300目,青岛海洋化工厂;Sephendex LH-20,北京绿百草公司;其余所用试剂均为分析纯,爱斯特试剂公司,其中醋酸、甲苯和甲醇使用前经干燥和纯化。
1.2 合成
(1)3的合成
在反应瓶中依次加入1 10.0 g(37.5 mmol)和冰醋酸75 mL,氮气保护,水浴冷却,搅拌下缓慢滴加原乙酸三甲酯14.4 mL(112 mmol),滴毕;于室温反应过夜(TLC检测);冰水浴冷却下反应15 min;缓慢滴加乙酰溴 7.6 mL(93.7 mmol)(30 min);升温至20℃,反应6 h(TLC检测)。低温蒸去大部分乙酸和过量乙酰溴,残余物用氯仿(80 mL)溶解,用饱和NaHCO3溶液调至pH 7~8,依次用水和饱和食盐水洗涤,无水硫酸钠干燥,蒸干溶剂后经硅胶柱层析[洗脱剂:A=V(DCM)∶V(MeOH)=15 ∶1]纯化得黄色油状物 3 6.26 g,收率40.5%;MSm/z:414,416{[M+H]+}。
(2)4的合成
在反应瓶中加入3 5.53 g(13.4 mmol)和无水甲苯67 mL,搅拌使其溶解;加入AIBN 0.44 g(2.68 mmol),于室温反应10 min;氮气保护下滴加三丁基氢化锡 5.8 g(20.1 mmol),滴毕;回流(110℃)反应2 h(TLC检测)。倾入100 mL轻石油醚中(析出淡黄色固体),过滤,滤饼用冰轻石油醚洗涤得4粗品3.87 g,收率87.0%,直接进行下步反应。
(3)虫草素的合成[8]
在反应瓶中依次加入无水甲醇37 mL和4 640 mg(1.87 mmol),搅拌使其溶解;回流反应3 h(TLC检测)。缓慢冷却至室温,减压浓缩后经Sephendex LH-20柱层析[洗脱剂:V(H2O)∶V(MeOH)=10∶1]纯化得淡黄色固体虫草素405 mg,收率 85.1%,Rf=0.3(展开剂:A=4 ∶1),m.p.226 ℃ ~228 ℃,[α]20D- 35.2 °(c0.10,MeOH);UV-Vis(CH3OH)λmax:213,260 nm;1H NMR δ:8.36(s,1H,2-H),8.15(s,1H,8-H),7.30(s,2H,NH2),5.87(d,J=6.0 Hz,1H,1'-H),5.69(d,J=5.6 Hz,1H,2'-H),5.19 ~5.17(m,1H,5'-OH),4.57(s,1H,2'-OH),4.34(s,1H,4'-H),3.69 ~3.66(m,1H,5-Ha'),3.51 ~3.46(m,1H,5-Hb'),2.27 ~2.20(m,1H,3-Ha'),1.93~1.90(m,1H,3-Hb')(与文献[8]值一致);MSm/z:274.1{[M+Na]+}。
2 结果与讨论
2.1 合成
本文参照文献方法通过两步反应合成3:一是1的环化;二是乙酰溴开环。实验中我们发现该反应虽然收率较好,但伴随生成的副产物5(Chart 1)较多,很难分离纯化。其次,第一步反应产物2在乙酸乙酯、二氯甲烷及乙醚中的溶解性均较差,只在氯仿中有一定的溶解度。因此,萃取时氯仿用量较大。此外,由于第二步反应中DMSO会干扰反应的进行(DMSO会和原位生成的HBr反应),所以需要将其尽量除净。文献方法通过大量水洗和柱层析处理,后处理操作步骤较为繁琐。在第二步溴解反应中,我们发现按文献方法操作,3/5=4/1,选择性不理想,给后处理分离纯化带来了较大困难。
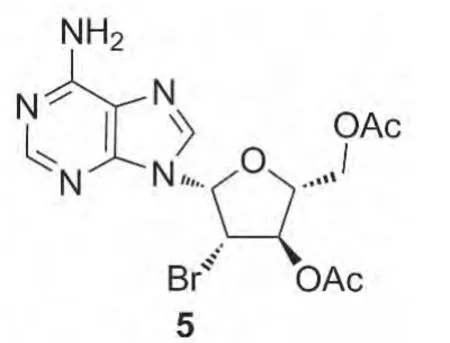
Chart 1
2.2 反应条件优化
在1的原酸酯化反应中,为了克服现有方法的缺点,寻找更加合理的合成工艺,对反应的溶剂进行了筛选,考察不同溶剂对反应的影响,结果见表1。由表1可见,以 DMSO为溶剂时,2收率82%;以醋酸和DMF为溶剂时,收率较高,分别为72%和65%,且杂质较少,可以作为DMSO的替代溶剂;乙腈和二氯甲烷为溶剂时收率较低,不能作为替代溶剂。
在2的溴解反应过程中,考察了溶剂对反应的影响,结果见表2。首先参照文献[9]方法以乙腈为溶剂时,以78%的收率获得3和5的混合物,3/5=4/1[较文献值(6/1)稍低];尝试以乙酸为溶剂,3和5总收率为63%,3/5最佳能达6/1。因此在进行溴解反应时,乙酸可作为较佳溶剂。
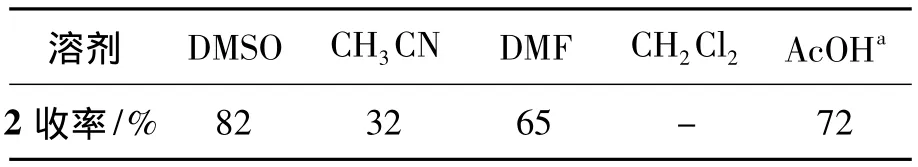
表1 溶剂对腺苷原酸酯化反应的影响*Table 1 Effect of the solvent on ortho-esterification
鉴于此,可将原酸酯化反应和溴解反应合并进行,反应以40.5%收率制得3和5,3/5=6/1。该方法提高了反应选择性的同时也简化了后处理程序。由于醋酸的沸点相对较低,因此可以在低温下将乙酸和过量乙酰溴蒸馏出,大大简化了后处理难度。但是反应选择性一般,需进一步改进以利于工业化生产。
3 结论
以廉价易得的腺苷(1)为原料,经3步反应以29.8%总收率成功合成了具有抗肿瘤、抑菌、抗病毒活性的天然产物虫草素。合成中间体2',5'-O-二乙酰基-3'-溴代腺苷的最佳反应条件为:1 37.5 mmol,醋酸 75 mL(作为溶剂和催化剂),将原乙酸三甲酯112 mmol在冰水浴条件下缓慢滴加入体系,于室温反应过夜;冰浴条件下,将乙酰溴93.7 mmol在30 min内缓慢滴加入反应体系,于20℃反应6 h,收率40.5%。
该改进方法为虫草素工业化合成提供了新的途径。
[1]Cunningham K G,Manson W,Spring F S,et al.Cordycepin,a metabolic product isolated from cultures of Cordyceps militaris(Linn.)Link[J].Nature,1950,166:949-951.
[2]Paterson R R.Cordyceps-A traditional Chinese medicine and another fungal therapeutic biofactory?[J].Phytochemistry,2008,69(7):1469 -95.
[3]Ng T B,Wang H X.Pharmacological actions of Cordyceps,a prized folk medicine[J].Pharm Pharmacol,2005,57(12):1509 -1519.
[4]Jeong M H,Seo M J,Park J U,et al.Effect of cordycepin purified from Cordyceps militaris on Th1 and Th2 cytokines in mouse splenocytes[J].J Microbiol Biotechnol,2012,22(8):1161 -1164.
[5]Ramesh T,Yoo S K,Kim S W,et al.Cordycepin(3'-deoxyadenosine)attenuates age-related oxidative stress and ameliorates antioxidant capacity in rats[J].Exp Geronto,2012,47(12):979 -987.
[6]Kodama E N,Meeafrey R P,Yusa K.Antileukemic activity and mechanism of action of cordycepin against terminal deoxynucleotidyl transferase-positive(TdT+)leukemic cells[J].Biochem Pharmacol,2000,59(3):273-281.
[7]王英娟,李多伟,王义潮,郑婷婷.蛹虫草中虫草素、虫草多糖综合提取工艺研究[J].西北植物学报,2005,25(9):1863 -1867.
[8]Robins M J,Wilson J S,Madej D Low,et al.Nucleic acid related compounds.88.Efficient conversions of ribonucleosides into their 2',S'-anhydro,2'(and S')-deoxy,2',3'-didehydro-2,3'-dideoxy,and 2,3'-dideoxynucleoside analogues[J].J Org Chem,1995,60(24):7902-7908.
[9]Meier C,Huynh D T.Improved conversion of adenosine to 3'-deoxyadenosine[J].Synlett,1991,4:227 -228.
[10]Kumar A,Khan S I,Manglani A,et al.Synthesis and antifungal activity of 3'-deoxyribonucleosides[J].Nucleosides and Nucleotides,1994,13(5):1049-1058.
[11]Herdewijn P.Reaction of adenine nucleosides,tosylated in the carbohydrate moiety,with lithium triethylborohydride[J].Tetrahedron,1989,45(20):6563-6580.
[12]Hansske F,Robins M J.Regiospecific and stereoselective conversion of ribonucleo sides to 3'-deoxynucleosides.A high yield three-stage synthesis of cordycepin from adenosine[J].Tetrahedron Letters,1985,26(36):4295 -4298.
[13]Xiao Q,Li Q H,Yang R C.Total synthesis of cordycepin[J].Chin J Org Chem,2013,33:1340.
[14]涂红艳.从腺苷合成虫草素的工艺研究[D].杭州:浙江大学,2006.

