成人不典型表现髓母细胞瘤1例及文献复习
刘怀贵 李威
髓母细胞瘤(medulloblastoma)是儿童后颅窝最常见的恶性肿瘤,典型部位为小脑蚓部及第四脑室。成人髓母细胞瘤罕见,发病率仅占成人颅内肿瘤的0.4%~1%[1],且好发于小脑半球。关于髓母细胞瘤的典型影像表现已有许多报道[2],不典型表现也有论述[3],但表现为双侧小脑半球、蚓部弥漫性生长的髓母细胞瘤鲜有报道。现结合文献对1例经病理证实的具上述影像特征的髓母细胞瘤的临床表现、病理及影像特点进行分析,以利于更全面地认识髓母细胞瘤。
1 病例资料
病人男,36岁。2013年12月出现头晕,可自行缓解,偶伴有走路不稳,于2014年1月加重伴恶心。CT平扫和多次MRI平扫、增强检查均发现双侧小脑半球、小脑蚓部及左侧桥臂弥漫性病变,PET/CT提示局部病变呈11C-MET高代谢。2014年4月手术切除11C-MET高代谢部分,病理证实为髓母细胞瘤。术后化疗3个疗程。
2 影像表现
2013年12 月CT平扫:双侧小脑半球、小脑蚓部呈弥漫高密度(图1)。2014年1月MRI平扫:双侧小脑半球、小脑蚓部及左侧桥臂在T1WI上呈稍低信号,T2WI、DWI上呈稍高信号,ADC图上呈稍低信号,病变边界不清,占位效应不明显,脑沟脑回变浅。增强扫描:病灶大部未见明显强化,邻近左侧小脑幕下方病变呈脑回状强化(图2)。MRS检查:取双侧桥臂为兴趣区,左侧桥臂MRS表现为Cho峰轻度升高,NAA峰轻度降低,Cho/NAA比值(1.2)稍增大;右侧正常桥臂区Cho/NAA比值为0.44。PET/CT检查:小脑蚓部、部分小脑半球呈11C-MET高代谢,18F-FDG低代谢(图3)。
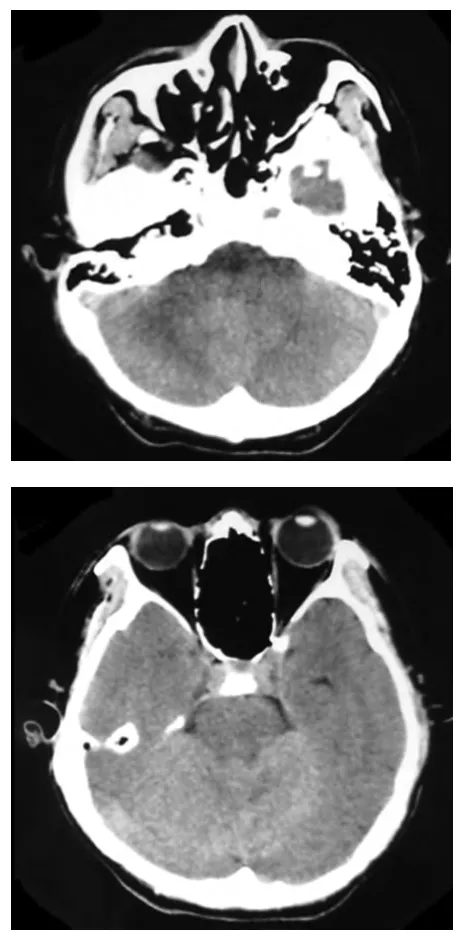
图1 CT平扫示双侧小脑半球、小脑蚓部弥漫高密度影

图2 MRI上病变位于双侧小脑半球、小脑蚓部及左侧桥臂。A T2WI呈稍高信号,脑沟脑回变浅;B DWI呈稍高信号(箭头);C ADC图呈稍低信号(箭头);D T1WI呈稍低信号,病变边界不清。E、F病灶大部未见明显强化,邻近左侧小脑幕下方病变呈脑回状强化

图3 MRS上可见病变区Cho峰轻度升高,NAA峰轻度降低,Cho/NAA比值为1.2(A);对侧正常桥臂Cho/NAA比值为0.44(B)。PET显像示小脑蚓部、部分小脑半球呈11C-MET高代谢(C),18F-FDG低代谢(D)
2014年5 月术后第1次MRI增强检查:第四脑室右后部明可见显强化结节,双侧小脑幕缘及邻近部分脑沟内可见线样强化;T2WI、DWI序列上双侧小脑半球、小脑蚓部、左侧桥臂弥漫稍高信号(图4A-D)。2014年8月术后、化疗后MRI平扫可见原双侧小脑半球、小脑蚓部、左侧桥臂病变范围较前明显缩小,于T2WI、DWI上信号较前减低(图4E、F)。2015年1月MRI增强检查发现,原第四脑室右后部明显强化结节未见显示,原双侧小脑半球、小脑蚓部、左侧桥臂病变区未见明显强化及异常信号(图4G、H)。
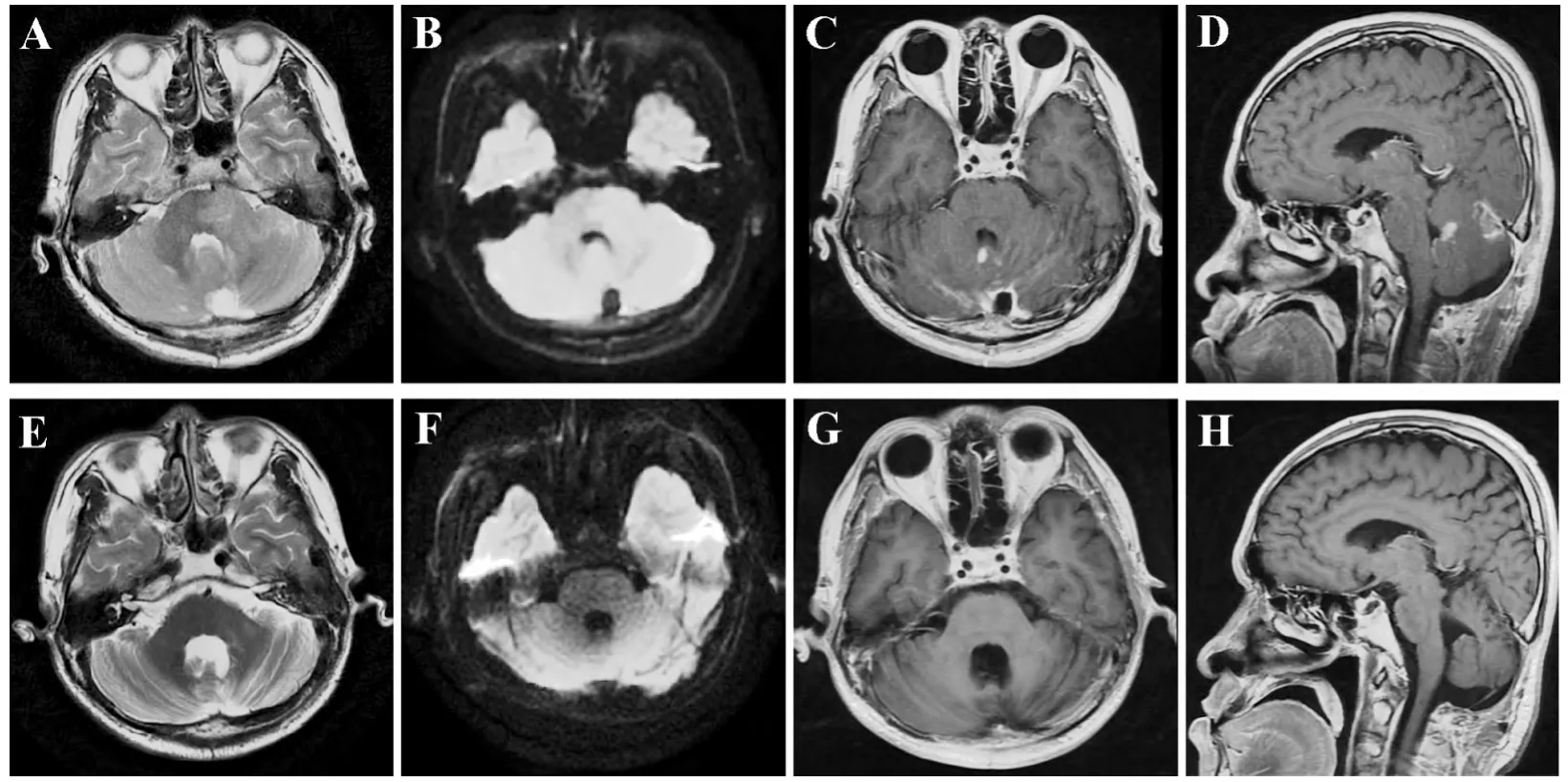
图4 A、B术后第一次MRI增强检查:双侧小脑半球、小脑蚓部、左侧桥臂T2WI、DWI呈弥漫稍高信号;C、D横断面、冠状面MRI增强影像显示第四脑室右后部明显强化结节。E、F术后化疗后MRI平扫:原双侧小脑半球、小脑蚓部、左侧桥臂病变范围较前明显缩小,于T2WI、DWI上信号较前减低。G、H术后化疗后MRI增强:原第四脑室右后方部明显强化结节未显示
3 手术与病理
术中双侧小脑半球皮质未见明显异常,小脑蚓部上部皮质颜色呈灰白色,浸润生长。显微镜下见病变沿小脑蚓部向双侧小脑半球浸润生长,并向脑干方向生长,病变边界不清,质地软,血运较丰富,色灰白。因病变广泛,无法全切除,切除PET/CT提示11C-MET高代谢部分。病理诊断结果为(小脑蚓部)弥散结节型髓母细胞瘤(Ⅳ级),伴黑色素细胞分化(图5)。
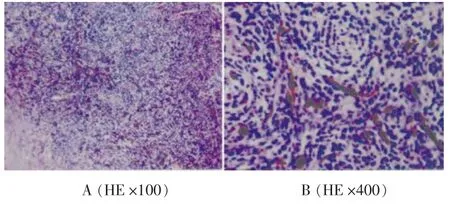
图5 病理图示肿瘤核分裂象多见,伴黑色素细胞分化
4 讨论
4.1 概述髓母细胞瘤由Baily与Cushing于1925年首先报道,是小儿后颅窝最常见的原发恶性肿瘤,占儿童颅内肿瘤的30%~40%[4-5]。成人偶可发生,发病高峰年龄在30~40岁,且男性多发[2,6]。关于肿瘤的起源,目前较多研究者认为典型的髓母细胞瘤多起自第四脑室顶部髓帆生殖中心的胚胎残余细胞,因此肿瘤绝大多数好发于小脑蚓部并向第四脑室内生长[7]。但文献报道中成人髓母细胞瘤多位于小脑半球或脑桥,且其中50%位于小脑半球背面[8]。因此有研究者[8-9]认为,此类肿瘤起源于小脑外颗粒层细胞,由于该细胞多位于小脑软膜下分子层表面,所以肿瘤生长部位易偏离中线,且多靠近小脑表面。本例为36岁成年男性,其发病部位基本与文献报道相符。
4.2 髓母细胞瘤的影像特征髓母细胞瘤显微镜下显示细胞密集,胞质少,核大且浓染,肿瘤细胞可排列呈菊花团状,肿瘤含水成分少,所以病灶CT平扫一般为高密度[10-11],MRI平扫无论T1WI还是T2WI都倾向为等信号,T1WI略低或等信号,T2WI略高或等信号[11-12]。其典型MRI表现为小脑下蚓部圆形或类圆形,长或等T1长或等T2软组织肿块影,病变边界清晰,信号常较均匀,偶可见多发斑片状囊变区。常推压第四脑室,引起梗阻性脑积水。增强扫描常有明显强化效应。容易发生沿脑脊液通路在蛛网膜下腔种植转移,多为粟粒状或结节状散在分布;转移灶也同样呈显著异常强化征象[13]。
成人小脑髓母细胞瘤术前影像检查确诊较儿童困难。除发病率低外,其影像学表现与儿童相比常有以下不同:①发生位置:在儿童中有90%位于后颅窝中线位置,而成人中非中线位置的可达50%[2]。②囊变和强化:儿童髓母细胞瘤血供丰富,很少发生囊变或坏死,但成人髓母细胞瘤坏死囊变更常见[14]。儿童肿瘤多明显强化,成人肿瘤实性部分多呈轻至中度强化。③钙化:儿童肿瘤钙化罕见,成人瘤内钙化相对较多。④边界:发生在儿童的髓母细胞瘤大多边界清楚,而在成人中边界清楚者较少[14-15]。
本例病人,术前考虑低级别神经上皮肿瘤,未考虑髓母细胞瘤诊断,手术病理证实为弥散结节型髓母细胞瘤;术后化疗病变基本消失,疗效较好。其表现与典型的成人髓母细胞瘤相比仍有以下特点:①病变部位不典型,病变主要位于小脑半球表面,分布广泛且呈弥漫性生长,累及两侧小脑半球、脑桥及桥臂;②MRI征象不典型,病变呈弥漫异常信号,边界不清,无明显肿块影,占位效应不显著,增强扫描无明显强化;③MRS表现不典型,通常髓母细胞瘤的MRS特点为Cho峰显著升高,NAA峰明显降低,Cho/Cr及Cho/NAA比值显著增大,Lac峰轻度升高,部分倒置,均提示髓母细胞瘤的恶性程度非常高。本例MRS信号与文献报道[16]不太相符,仅表现为Cho峰轻度升高,NAA峰轻度降低,Cho/NAA比值(1.2)稍增大。值得注意的是MRS能在一定程度上反映组织的代谢情况,但无法单独对髓母细胞瘤做出诊断和鉴别诊断。
4.3 鉴别诊断位于小脑半球非中线区的髓母细胞瘤误诊率相对较高。而该部位的髓母细胞瘤主要需与好发于小脑半球的其他类型神经上皮肿瘤鉴别。其中生长比较局限者主要需与毛细胞性星形细胞瘤、多形性黄色星形细胞瘤及含有节细胞成分的小脑半球肿瘤鉴别。上述肿瘤多发生于儿童,均有囊变倾向,而髓母细胞瘤即使较大也不易囊变,为鉴别要点。生长比较弥漫的需与小脑间变性星形细胞瘤、多形性胶质母细胞瘤、大脑胶质瘤病等鉴别。这几类肿瘤也好发于成人,其中前两种肿瘤坏死囊变常见,占位效应显著,强化明显是其特点;而大脑胶质瘤病更易同时累及幕上、幕下,病变更广泛,但占位效应轻,多无强化。值得提出的是,Rasalkar等[17]认为DWI高信号而ADC低信号为髓母细胞瘤的特征性表现,可作为与上述病变鉴别的主要依据。
成人小脑髓母细胞瘤发生率相对较低,与儿童典型的髓母细胞瘤有许多不同点,且表现多样,影诊断相对困难。因此,当发现成人出现小脑半球弥漫浸润性病变且不能用小脑半球常见肿瘤解释时,联合应用多种影像方法,在确定为肿瘤性病变的基础上鉴别诊断,应考虑到髓母细胞瘤的可能性。
[1] Maleci A,Cervoni L,Delfini R.Medulloblastoma in children and in adults:a comparative study[J].Acta Neurochir(Wien),1992,119:62-67.
[2] Koeller KK,Rushing EJ.From the archives of the AFIP:medulloblastoma:a comprehensive review with radiologic-pathologic correlation[J].Radiographics,2003,23:1613-1637.
[3] Meshkini A,Vahedi A,Meshkini M,et al.Atypical medulloblastoma:a case series[J].Asian J Neurosurg,2014,9:45-47.
[4] Barkovich AJ.Pediatric neuroimaging[M].New York:Raven Press,1990:149-203.
[5] Nelson M,Biebler C,Forbes WS.Paediatric medulloblastoma:atypical CT features at presentation in the SIOP Ⅱtrial[J].Neuroradiology,1991,33:140-142.
[6] Giordana MT,Schiffer P,Lanotte M,et al.Epidemiology of adult medulloblastoma[J].Int J Cancer,1999,80:689-692.
[7] Spreafico F,Gandola L,Marchianò A,et al.Brain magnetic resonance imaging after high-dose chemotherapy and radiotherapy for childhood brain tumors[J].Int J Radiat Oncol Biol Phys,2008,70:1011-1019.
[8] Chan AW,Black PM.Adult medulloblastoma;prognostic factors and patterns of relapse[J].Neurosurgery,2000,47:623-632.
[9] Gupta A,Kasliwal MK.Unusual MR features of adult cerebellar medulloblastoma[J].J Neurooncol,2006,78:47-48.
[10] Sandhu A,Kendall B.Computed tomography in management of medulloblastomas[J].Neuroradiology,1987,29:444-452.
[11] Arora R.Imaging spectrum of cerebellar pathologies:a pictorial essay[J].Pol J Radiol,2015,80:142-150.
[12] Meyers SP,Kemp SS,Tarr RW.MR imaging features of medulloblastomas[J].AJR,1992,158:859-865.
[13] Rollins N,Mendelsohn D,Mulne A,et al.Recurrent medulloblas-toma:frequency of tumor enhancement on Gd-DTPA MR imaging[J].AJR Am J Roentgenol,1990,155:153-157.
[14] Bourgouin PM,Tampieri D,Grahovac SZ,et al.CT and MR imaging findings in adults with cerebellar medulloblastoma:comparison with findings in children[J].AJR,1992,159:609-612.
[15] Hubbard JL,Scheithauer BW,Kispert DB,et al.Adult cerebellar medulloblastomas:the pathologic,radiographic,and clinicaldisease spectrum[J].J Neurosurg,1989,70:536-544.
[16] Schneider JF,Confort-Gouny S,Viola A,et al.Multiparametric differentiation of posterior fossa tumors in children using diffusion weighted imaging and short echo-time1H-MR spectroscopy[J].J Magn Reson Imaging,2007,26:1390-1398.
[17] Rasalkar DD,Chu WC,Paunipagar BK,et al.Paediatric intra-axial posterior fossatumours:pictorial review[J].Postgrad Med J,2013,89:39-46.