HERV参与肿瘤发生的研究进展
于红莲
(济宁医学院基础学院,山东 济宁272067)
约50%的人类基因组序列是由转座元件组成。绝大多数转座元件的是由反转座子组成,而反转座子又可以分为含长末端重复序列(LTR)的转座子和不含LTR的转座子。人内源性逆转录病毒(human endogenous retrovirus,HERV)和solitary LTR(solo-LTR)占人类基因组的8%,而非LTR反转座元件占人类基因组的34%。其中,HERV是由外源性逆转录病毒侵染宿主后在种系内部垂直传播并保留下来形成的。而同时在此插入后通过胞内反转座和重组过程增加了家族的拷贝数[1]。HERV可分为3大家族,包括1)Class I家族:γ逆转录病毒相似元件,其中包括HERVT、 HERV-I、 HERV-H、 HERV-W、ERV-9、HEVV-R等;2)Class II家族:β逆转录病毒相似元件又称为HERV-K超家族;3)Class III家族为泡沫病毒相似元件,包括HERV-L、HERV-S等。
HERV LTR高度转座活性使HERV及solo-LTR都可以在宿主基因组内大量扩增。随着人类基因组的进化,HERV发生了突变和缺失、易位或重组,使较多的蛋白编码基因缺陷不能成功编码功能蛋白,仅有少数可编码完整功能的蛋白的基因如HERV-K或W家族的env。而LTR作为调控元件仍含有转录活性。已有研究证实HERV及LTR的激活参与多发性硬化,风湿性关节炎,I型糖尿病,癌症[2]、精神类疾病[3]的发生。其中病毒基因的异常表达和LTR的调节和转录活性正是HERV参与肿瘤发生的主要因素。本文从HERV的起源、分布、在生理状态中的作用、在肿瘤发生中的现状及分子机制5个角度来阐述。
1 HERV的起源
关于HERV的起源主要存在两种假说。一种假说认为,HERV起源于外源性逆转录病毒的感染到人生殖系细胞,并以孟德尔方式遗传下来;另一种假说认为,HERV序列是正常的细胞基因,通过逆转录方式进化而来[4]。目前大部分研究者支持第一种假说。而逆转录病毒的这种特征是需要逆转录酶来发挥作用的。逆转录酶能将逆转录病毒的单链RNA生成一个双链DNA中间体(原病毒)。同时产生原病毒的LTR。随后原病毒DNA借助整合酶的作用整合到宿主DNA中。逆转录病毒感染生殖细胞后,在稳定的染色体位置建立原病毒结构,从而导致HERV的产生。随后,原病毒DNA通过整合到基因组的不同位点,产生与HERV相关的家族。HERV在人类基因组中的再激活为肿瘤发生提供了条件。
2 HERV的结构与分布
典型 的 HERV 的 结 构 为 LTR-gag-pol-env-LTR。其中Gag编码病毒衣壳、基质等结构蛋白,Pol编码反转录酶、蛋白水解酶和整合酶,Env编码包膜蛋白。LTR含有U3、R、U5 3个主要的结构。HERV LTR根据存在位置的可以分为3种:3'LTR、5'LTR和solo-LTR。LTR含有增强子、激素反应元件、启动子以及负调控区等调控序列。
不同的HERV家族插入到人类基因组的时间不同,拷贝数也不同[5]。尽管HERV广泛分布在人类基因组中,但它们在染色体上的分布并不是随机的,而是呈现一定的分布多态性。研究发现HERV LTR长定位于中心粒近侧区和端粒近侧区,中心粒和端粒部位属于异染色质区域。同时异染色质区域一般含有较高比例的GC碱基,但LTR并未位于高GC区,未受到高度抑制的作用,这对其增强子,启动子,激素反应元件各个顺式作用元件作用的发挥提供了证据。不同的LTR在染色体上分布不同也决定着部分HERV和LTR的失活不仅是缺失,突变也可能是高度异染色质导致。LTR一般富集在转录单位的区域[5]。LTR可以正向或反向定位在相邻基因附近,对HERVLTR在基因内含子的方向性研究中发现HERVLTR更容易在相邻宿主基因转录的反向定位。此外LTR可随机插入到基因的不同部位,包括5'非翻译区,内含子区、外显子区及3'非翻译区。LTR可以与编码基因联合插入,也可独立转座。这就导致LTR在不同染色体上均有定位,且表现为不均匀分布[6]。LTR分布情况为其能够通过多种方式调控它们相邻基因的表达提供了条件。
3 HERV在生理状态下的作用
HERV经过长期的进化过程仍有部分基因保存完整的开放读码框,如同外源性逆转录病毒基因在生理状态中的重要作用。20世纪80年代病毒学家发现HERV基因可能保护胎儿。Okahara等发现5个位点的HERV在人类的多个组织中有表达,其中只有一个存在着组织特异性表达,其它的为组成型表达。HERV-W在正常的生理过程中,目前研究最多的基因为HERV-W env(syncytin-1)基因,在胚胎组织中检测到syncytin-1基因的显著高表达。并能促使胎盘合胞体滋养层细胞的融合[7]。还有研究者发现syncytin-1在怀孕后前3个月中的表达比3个月以后的表达高[8]。syncytin-1糖蛋白都具有一个保守的免疫抑制结构域。这个免疫抑制结构域与选择性宿主免疫抑制相关,胎盘表达的HERV的免疫抑制亚基可能在胎盘屏障的免疫调节中起着重要的作用。研究显示外源性逆转录病毒通过免疫抑制区域能够抑制白细胞的免疫反应。由于包膜蛋白的免疫抑制区域高度保守,在内源性逆转录病毒中存在的这一区域也许能够在胎盘的发生中起着特异性免疫调节作用。
HERV LTR插入到基因的附近后调节这些基因的表达。LTR元件和相邻的基因已经形成的双向互惠互利的关系。LTR可以随着基因传递到下一代,而基因可以获得LTR的某些特征而实现表达或改变表达水平。基因可以从LTR上获得增强子和启动子、腺基化位点。基因的表达水平也可以受到LTR的影响。例如,HERV-E LTR是反向定位于胰腺淀粉酶基因的上游调节淀粉酶基因的表达,LTR可以为人胰腺淀粉酶基因的提供启动子的活性。此外,HERV-K LTR可以为周围的报告基因提供双向启动子活性。LTR可以作为可选择启动子可以增强载脂蛋白C1和内皮素B的受体基因的自身启动子[9]。Dunn等发现L型内源性逆转录病毒(human endogenous retrovirus L,ERV-L)家族的LTR是人类结肠和小肠中半乳糖苷转移酶的主要的启动子。HERV-E LTR通过为人内皮素B受体(EDNRB)提供选择性启动子而调节内皮素B受体的表达,而内皮素B受体信号传导通路在胚胎发育期神经嵴细胞分化、迁移、发育为神经节细胞的过程中起到关键作用。有研究报道HERV-K LTR拥有组织特异性增强子活性。HERV LTR 关联蛋白2(HERV-LTR-associating protein 2,HHLA2)可以由 HERV-H LTR基因提供腺基化(polyA)位点并在可以参与免疫应答[10]。HERV-F(XA24)的5'LTR 可以为Kruppel锌指基因提供选择性多聚腺苷酸位点,Kruppel锌指基因是真核细胞转录调控密切相关的一类蛋白。因此,HERV可能在生物体内行使不同的功能。Andersson等阐述了HERV-R在婴儿的多种组织中呈现高表达。在胚胎发展过程中,HERV-R参与组织的发展与分化。以上证据都表明HERV病毒基因及LTR在胚胎发育、生长发育等生理过程中起着重要的作用。
4 HERV在肿瘤病理状态下的作用
20%的肿瘤发生都是由于外源性病毒的引发的,例如I型人类嗜T细胞病毒(human T lymphatropic viruses,HTLV-I)和 HTLV-II都可以引起T细胞白血病、淋巴瘤和多毛细胞白血病;1型人类免疫缺陷病毒(human immunodeficiency virus 1,HIV-1)和 HIV-2都可以直接引起淋巴瘤和卡波西氏肉瘤;人类乳头状瘤病毒引起宫颈癌和阴茎癌。而HERV的病毒在肿瘤组织中的激活也逐步被发现。研究者发现睾丸癌组织中的HERV-K和肝癌组织的HERV-P与癌旁组织相比都有较高水平的表达。在肝癌和肺癌组织中HERV-R也有较高水平的表达。在人前列腺癌中检测到了HERV-E env转录物的表达。通过抑制消减杂交法检测结直肠癌发生过程中表达上调的基因,发现X染色体短臂上HERV-H的env基因在肿瘤组织中有高表达,而在相应的正常组织中不表达。该研究还指出HERV-H gag基因也在肿瘤组织中表达上调。此外,数项研究表明,HERV-K可能在乳腺癌的发病过程中起着重要的作用。Schmitt等发现在黑色素瘤组织中,大量的HERV-K env的转录物的存在激活[11]。Bjerregaard等研究发现HERV-W env在乳腺癌组组织中高表达。Gimenez等发现HERV-W env在睾丸癌组织中高表达。2014年,我们发现在膀胱肿瘤组织中HERV-W env基因呈现高表达,而在癌旁组织中呈现低表达,并且env的表达与膀胱肿瘤的分级和分期显著相关[12]。Aagaard等[13]研究表明env基因具有使肿瘤细胞的融合能力。Env基因的促增殖能力及抗凋亡能力也有报道。这些结果都支持HERV的病毒基因表达可能参与肿瘤的发生发展过程中。
LTR作为调控元件的激活参与肿瘤的发生也是HERV引发肿瘤的一个重要因素。LTR拥有多种调控元件,激活后可以调节HERV编码基因的表达与其临近基因的表达从而参与癌症的发生。一项研究表明HERV-L LTR在转移能力不同的人肺腺癌系中均有表达,且在多数转移性非小细胞淋巴癌病人中表现为高表达。另有报道HERVLTR的转录活性可以受到顺式作用元件和P53抑癌蛋白的负向调控[14]。研究报道HERV-H LTR反向定位在GSDML的上游,在HCT-116和He-La和肾脏细胞系Cos-7中都检测到LTR的转录活性,同时反向定位比正向定位转录活性高,但这种转录活性的高低存在着组织特异性。Rec和Np9受到5'LTR的调控,这两种蛋白直接结合到早幼粒细胞白血病锌指蛋白(PLZF),对精子的发生有重要作用,PLZF作为一种转录抑制因子,损害其功能可能引起原癌基因的激活从而促使细胞大量增殖,最终致肿瘤的发生[15]。因此,LTR作为一种潜在的危险靶分子具有重要的研究价值。
5 HERV在肿瘤中发生机理
HERV-LTR的异常激活引起的病毒基因及宿主基因的异常表达都是引发肿瘤发生的重要原因。接下来我们主要从遗传不稳定性、甲基化、反式激活和RNA干扰4个方面来进行探讨,见图1。
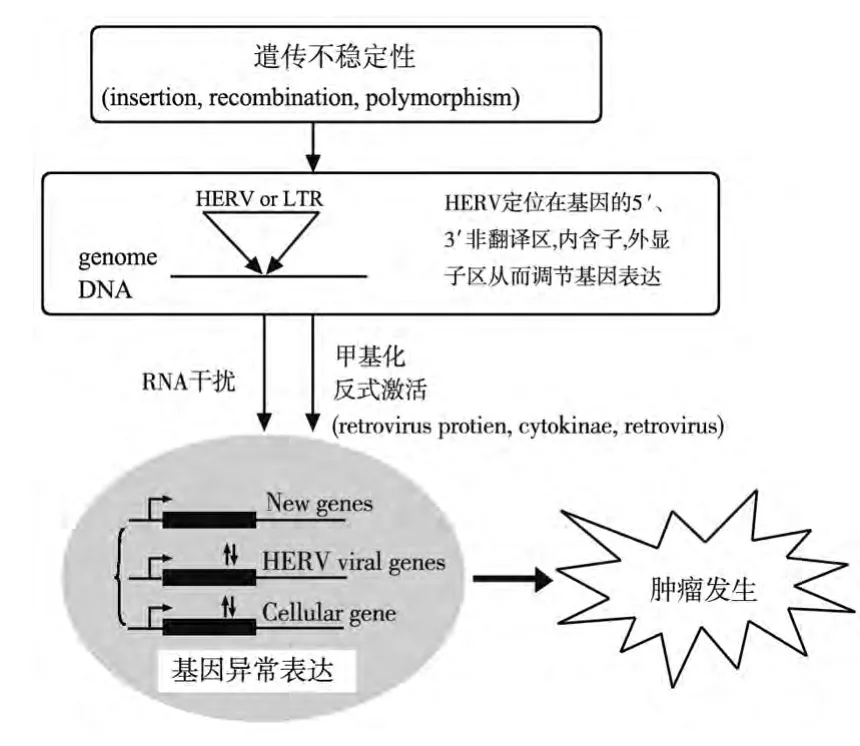
图1 人类内源性逆转录病毒引发肿瘤发生的分子机制
HERV的遗传不稳定性使HERV在人类基因组中有不同方式的定位和分布,这些不同的HERV调节基因表达受到多种因素的因素的影响包括甲基化,反式激活及RNA干扰。最终引发基因的异常表达而导致肿瘤的发生。
5.1 遗传不稳定性
遗传不稳定性是导致肿瘤发生和进展的重要的因素之一。插入、重组及多态性都可以引起遗传不稳定性。首先,外源性逆转录病毒可以通过插入突变和病毒基因的异常表达介导肿瘤的发生。相似的,HERV也可以通过插入机制参与肿瘤的发生。HERV插入到人类基因组时的扩增的方式就是通过复制、剪切和转导3种方式来完成的。HERV LTR插入到人类基因组并含有多种生物学功能。HERV的插入可以引起异常的相邻基因的表达或者产生新的基因。已有研究报道HERV LTR的插入导致PTN基因的遗传表达引起人绒毛膜癌,如果HERV或solo-LTR的插入发生在精细胞内,可以直接导致细胞的恶性转化[16]。其次,HERV的重组是导致HERV在体内分布广泛的一个重要原因。其中在重组的过程中能够产生solo-LTR,可以通过四种方式的重组引发基因组的重新组合[5]。LTR33和LTR7是重组产生的可以调节肿瘤细胞内DNAJC15基因的表达 .因此HERV重组可以参与肿瘤的进展。最后,多态性是由插入多态性和序列多态性两大类,已有研究报道HERV-K115和K113的序列多态性,但对其是否能参与疾病的发生研究较少,原因尚不清楚。而HERV-K115和K113可以通过插入多态性参与到多种肿瘤的发生中[17]。因此,HERV的遗传不稳定性为HERV在染色体上多样化的分布提供了理论基础,也为调节周围的基因表达提供了条件。
5.2 甲基化水平
遗传不稳定性导致了HERV与LTR广泛分布在人类基因组中,而它们的激活受到甲基化水平的控制。例如有研究报道,HERV U3启动子区域的低甲基化使得其在肿瘤组织中的表达高于正常组织中的表达。利用DNA甲基化和组蛋白乙酰化抑制剂处理的结肠癌细胞中HERV-H的表达显著改变。这些结果证实低甲基化状态影响结肠癌中 HERV-H的表达[18]。黑色素瘤中 HERV-K的表达可能是由于其5'LTR相应的启动子区域的低甲基化。因此,HERVLTR的低甲基化会导致HERV序列的高表达。大部分HERV基因在人类基因组进化中受到宿主基因的甲基化酶的作用,不同的病毒序列甲基化在不同组织中甲基化水平不同,这种甲基化水平的变化也可影响其转录活性,从而影响病毒编码基因和宿主基因的表达,调节细胞增殖和免疫应答的功能等各种功能。
5.3 RNA干扰机制
HERV和LTR经常反向定位到相应的宿主基因[19]。反义转录物可以通过调节转录和后转录过程影响相邻基因的功能。有研究发现定位于基因内含子的10HERV-K LTR中,9个都是反向定位。反向定位为RNA干扰提供了条件。有研究提出假说LTR通过产生反义RNA来调节基因的表达[5]。这一假说也经过了多个研究支持。反义转录物能够形成双链RNA并能招募RNAi相关蛋白。以上研究证实LTR反转座的翻译转录物的异常表达可能是导致肿瘤发生的一个重要因素。
5.4 病毒基因和LTR的反式激活
HERV的再激活可能受到多种内外环境因素的影响,包括细胞因子、射线以及外源性逆转录病毒蛋白等[5]。一些能调控宿主基因的细胞因子可以对HERV的调控区域进行调控,如干扰素-γ,IL-11,IL-2,TNF-α都可以对 HERV-W 启动子区域进行调控激活其启动转录的功能。射线可以激活HERV-R的活性从而上调HERV-R env基因的表达1型单纯疱疹病毒 (herpes simplex virus 1,HSV-1)的感染能够引发 HERV-K家族的LTR起始的转录。并且HSV-1早期蛋白ICP-50能都上调 HERV-K LTR的活性。研究报道 HTLX Tax蛋白可以激活HERV LTR活性并能参与疾病的发生[20]。小眼畸形相关转录因子 M (MITFM)基因可以激活HERV-K的高表达并参与黑色素瘤,乳腺癌,和崎胎瘤的发生。这些研究都证实HERV的再激活可以增强病毒基因和宿主基因的表达并参与人类恶性肿瘤的病理过程。
6 总结与展望
总之,大量的研究证实HERV的激活可能在多种水平参与肿瘤的发生(图1)。首先是HERV的遗传不稳定性包括插入、重组和多态性使HERV在人类基因组上分布广泛,并可以正向和反向定位于基因的任何部位包括5'非翻译区,内含子、外显子和3'非翻译区,从而影响病毒基因和宿主基因的异常表达,并且HERV及LTR可以受到宿主甲基化及内外环境因素的影响,也可以通过起始一些RNAi的转录物调节基因的表达。这些相邻基因或者新的宿主基因、病毒基因的异常表达都是肿瘤发生、发展的引导因素。在以后对HERV的研究中,我们可以通过发现深刻探讨HERV的干扰机制以及LTR-相关的肿瘤基因来研究HERV与肿瘤的发生关系。探讨病毒引发肿瘤的分子机制能够为肿瘤的预防和治疗提供理论依据。
志谢:本文课题组受国家自然科学基金项目(81402119)和山东省自然科学基金项目(ZR2014HL071)的资助。
[1] Suntsova M,Garazha A,Ivanova A,et al.Molecular functions of human endogenous retroviruses in health and disease[J].Cell Mol Life Sci,2015,Jun 18.[Epub ahead of print].
[2] Rycaj K,Plummer J B,Yin B,et al.Cytotoxicity of human endogenous retrovirus K-specific T cells toward autologous ovarian cancer cells[J].Clin Cancer Res,2015,21(2):471-483.
[3] Li S,Liu Z C,Yin S J,et al.Human endogenous retrovirus W family envelope gene activates the small conductance Ca(2+ )-activated K + channel in human neuroblastoma cells through CREB[J].Neuroscience,2013,247:164-174.
[4] Nisbet-Brown E,Wegmann TG.Is acquired immunological tolerance genetically transmissible?[J].Proc Natl Acad Sci U S A,1981,78(9):5826-5828.
[5] Yu H L,Zhao Z K ,Zhu F.The role of human endogenous retrovirus long terminal repeat in human cancer[J].Int J Mol Med,2013,32(4):755-762.
[6] Cegolon L,Salata C,Weiderpass E,et al.Human endogenous retroviruses and cancer prevention:evidence and prospects[J].BMC Cancer,2013,13:4.
[7] Lokossou A G,Toudic C,Barbeau B.Implication of human endogenous retrovirus envelope proteins in placental func-tions[J].Viruses,2014,6(11):4609-4627.
[8] Holder B S,Tower C L,Abrahams V M,et al.Syncytin 1in the human placenta[J].Placenta,2012,33(6):460-466.
[9] Medstrand P,Landry J R and Mager DL.Long terminal repeats are used as alternative promoters for the endothelin B receptor and apolipoprotein C-I genes in humans[J].J Biol Chem,2001,276(3):1896-1903.
[10]Zhao R,Chinai J M,Buhl S,et al.HHLA2is a member of the B7family and inhibits human CD4and CD8T-cell function[J].Proc Natl Acad Sci U S A,2013,110(24):9879-9884.
[11]Schmitt K,Reichrath J,Roesch A,et al.Transcriptional profiling of human endogenous retrovirus group HERV-K(HML-2)loci in melanoma[J].Genome Biol Evol,2013,5(2):307-328.
[12]Yu H L,Liu T,Zhao Z K,et al.Mutations in 3'long terminal repeat of HERV-W family in chromosome 7upregulate syncytin-1expression in urothelial cell carcinoma of the bladder through interacting with c-Myb[J].Oncogene,2014,33(30):3947-3958.
[13]Aagaard L,Bjerregaard B,Kjeldbjerg A L,et al.Silencing of endogenous envelope genes in human choriocarcinoma cells shows that envPb1is involved in heterotypic cell fusions[J].J Gen Virol,2012,93(Pt 8):1696-1699.
[14]Chang N T,Yang W K,Huang H C,et al.The transcriptional activity of HERV-I LTR is negatively regulated by its cis-elements and wild type p53tumor suppressor protein[J].J Biomed Sci,2007,14(2):211-222.
[15]Kaufmann S,Sauter M,Schmitt M,et al.Human endogenous retrovirus protein Rec interacts with the testicular zinc-finger protein and androgen receptor[J].J Gen Virol,2010,91(Pt 6):1494-1502.
[16]Wildschutte J H,Ram D,Subramanian R,et al.The distribution of insertionally polymorphic endogenous retroviruses in breast cancer patients and cancer-free controls[J].Retrovirology,2014,11:62.
[17]Zwolińska K,Knysz B G,Siorowski J,et al.Frequency of human endogenous retroviral sequences(HERV)K113and K115in the Polish population,and their effect on HIV infection[J].PLoS One,2013,8(10):e77820.
[18]Liang Q,Xu Z,Xu R,et al.Expression patterns of non-coding spliced transcripts from human endogenous retrovirus HERV-H elements in colon cancer[J].PLoS One,2012,7(1):e29950.
[19]Gosenca D,Gabriel U,Steidler A,et al.HERV-E-mediated modulation of PLA2G4Atranscription in urothelial carcinoma[J].PLoS One,2012,7(11):e49341.
[20]Toufaily C1,Landry S,Leib-Mosch C,et al.Activation of LTRs from different human endogenous retrovirus(HERV)families by the HTLV-1tax protein and T-cell activators[J].Viruses,2011,3(11):2146-2159.

