巨大肝海绵状血管瘤经导管动脉硬化栓塞治疗的有效性和安全性分析
张 欣, 熊 斌, 姚 琦, 郑传胜
肝海绵状血管瘤(CHL)是源自肝脏血窦胚胎发育障碍所致的先天性肝脏血管(门静脉)畸形[1],大多较小且不引起明显临床症状,仅在体检时偶然发现,但部分CHL可不断增大或引起右上腹胀痛不适、黄疸、血小板减少等[2]。较大CHL可自发性破裂出血,虽极为少见,但病死率却很高(60%~75%)[3]。过去认为外科手术切除是治疗CHL较为有效的方法,但对巨大CHL风险较大,患者创伤严重[4-5]。介入医学的发展及广泛应用为CHL治疗提供了新思路。我科近年收治了一些巨大CHL患者,采用经导管动脉硬化栓塞术(TASE)治疗后取得了满意疗效。现报道如下。
1 材料与方法
1.1 临床资料
回顾性收集我科2011年4月至2014年11月采用TASE治疗的巨大CHL(瘤体最大直径>10 cm)患者22例,其中男7例,女15例,中位年龄46岁(29~65岁);9例体检时偶然发现,13例均有不同程度上腹部不适、腹胀、腹痛等症状。全部患者均由增强CT、增强MRI及肝动脉DSA确诊,单发12例,多发10例,有4例瘤体最大直径>20 cm。所有患者甲胎蛋白(AFP)、癌胚抗原(CEA)均正常,Child-Pugh肝功能分级均为A级。
1.2 方法
1.2.1 诊断方法 ①CT检查:平扫表现为肝实质内境界清楚的圆形或类圆形低密度肿块;对比增强动脉期可见瘤体边缘散在斑状、结节状明显强化灶,门脉期散在强化灶相互融合,同时向瘤体中央扩展,静脉期整个瘤体均匀强化,且强化程度高于或等于周围正常肝实质,即表现为所谓“早出晚归”特征。②MRI检查:T1WI瘤体表现为圆形或边缘分叶的类圆形均匀低信号肿块,T2WI瘤体表现为均匀高信号,随着回波时间延长,信号强度增高,在肝实质低信号背景衬托下,瘤体表现为边缘锐利的明显高信号灶,成为所谓“灯泡”征;对比增强后行T1WI动态扫描,瘤体亦从边缘强化,逐渐向中央扩展,最后充盈整个瘤体,形成高信号肿块。③DSA检查:供血动脉增粗,巨大瘤体压迫周围血管弧形移位,呈抱球征;早期动脉相瘤体边缘出现斑点、棉花团状显影,即“树上挂果”征,静脉期瘤体显影逐渐向中央扩散,表现为密度均匀、轮廓清楚的瘤体染色,且对比剂排空延迟,瘤体染色持续到肝实质后期不退,表现为所谓“早出晚归”征象。
1.2.2 治疗方法 手术在局部麻醉下进行,采用改良Seldinger技术穿刺右侧股动脉,引入5 F Yashiro导管至腹腔干动脉及肠系膜上动脉行DSA造影,明确血管瘤位置、数目及供血动脉,超选择至瘤体供血动脉(超选择有困难时使用2.7 F Terumo微导管);将10 ml碘油与8 mg平阳霉素用5 ml注射器反复抽吸制成平阳霉素碘油混合乳剂(PLE),根据血管瘤大小注入适量PLE,以碘油沉积与之前DSA造影实质期瘤体染色区域相符为满意,再序贯补充适量350~560μm明胶海绵颗粒完成TASE治疗;复查造影见栓塞满意后拔管,加压包扎。
1.2.3 观察指标 TASE术后所有患者随访3~6个月,复查CT或B超检查,了解患者腹部症状是否好转、瘤体变化及是否出现严重并发症。
1.2.4 统计学方法 采用SPSS 20.0软件进行统计学分析,患者病灶大小数据用t检验和方差分析,P<0.05为差异有统计学意义。
2 结果
DSA造影显示22例CHL均为肝动脉供血,稍增粗,实质期对比剂排空延迟,呈典型“树上挂果”征;其中2例可见少许与肝动脉支伴行的小门静脉支早显,余未见明显静脉及门脉早显;注入PLE后碘油沉积,补充适量明胶海绵颗粒后复查造影未见明显“血池”显影。22例患者共接受30次TASE术(14例分别1次,8例分别2次)。(图1)
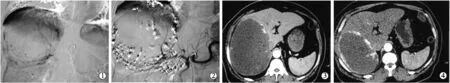
图1 巨大CHL患者TASE术治疗前后影像学对比
TASE术成功率100%。术后所有患者随访3~6个月,13例术前有症状患者有不同程度好转或消失,余患者未见明显不适;CT、B超检查示血管瘤均缩小,由术前平均瘤体最大直径(14.4±4.7)cm缩小为术后平均最大直径(9.5±4.1)cm,差异有统计学意义(P<0.05)(图 2)。

图2 22例患者TASE术前后血管瘤大小对比(P<0.05)
TASE术后有少数患者出现肝区疼痛症状,给予对症处理后3 d内消失。术后5 d复查肝肾功能及血常规均正常,无白细胞、红细胞和血小板下降等骨髓抑制表现。术后3~6个月随访复查时未出现肝脓肿、胆管狭窄、胆管坏死等严重并发症。
3 讨论
CHL通常为肝脏良性病变,女性可能多发,迄今无任何研究显示有恶性或恶变倾向。组织病理学检查证实CHL仅由多数大小不等扩张的腔壁衬以单层内皮细胞的异常血窦构成,既未见内皮细胞异、管瘤增大是血窦内压力升高造成瘤体扩张的缘故,而非血管瘤本身生长[6]。有学者发现CHL周边正常肝组织中原本正常的肝窦淤血扩张,并与CHL异常血窦相互沟通,逐渐增大,这也许与CHL增大存在联系[1]。
CHL由肝动脉供血为主,肝动脉被结扎或栓塞致CHL异常血窦内压力变化时,门静脉血液可逆流而成为其供血动脉。根据血流动力学变化,CHL可分为血窦丰富型(或富血型)、血窦较丰富型和血窦稀少型(或乏血型)[1]。
平阳霉素是由平阳链霉素产生的博莱霉素类抗肿瘤抗生素,能抑制细胞DNA合成和切断DNA链,影响细胞代谢功能,促进细胞变性坏死,属于细胞周期非特异性药物,对机体免疫功能和造血功能无明显影响[7];同时,对血管内皮细胞有非特异性抑制和破坏作用,即所谓“祛血管作用”[8]。 肖晋昌等[9]报道采用CT或超声引导下经皮穿刺注入盐酸平阳霉素方法治疗CHL,取得了一定疗效;认为平阳霉素可有效破坏CHL异常血窦内内皮细胞,从而使CHL缩小。
最初有报道用弹簧圈、聚乙烯醇(PVA)颗粒等栓塞CHL供血血管,效果并不理想[10-13]。我们分析原因在于栓塞材料虽阻断了CHL血供,但并未进入血窦内,供血动脉被阻塞后与CHL异常血窦相联通的门静脉因压力变化发生逆流,从而成为新的供血动脉,使栓塞效果大打折扣。CHL由异常血窦构成,其内血流缓慢使得对比剂易于沉积而排出延迟,因此在造影时呈现“早出晚归”表现。利用血管瘤这一血流动力学特性,液态栓塞剂PLE可进入瘤体内栓塞血窦及末梢血管,再补充适量明胶海绵颗粒阻断远端血流,使得碘油在异常血窦内充分沉积。PLE可缓慢释放出平阳霉素,使之在血管瘤内充分发挥作用,破坏异常血窦内皮细胞而不会引起其它血管和组织损伤,极大地降低了不良反应。明胶海绵颗粒是可吸收栓塞材料,不会影响部分巨大血管瘤必要时接受第2次手术治疗。这种阻断瘤体血供并破坏瘤体血管内皮细胞的方法可取得栓塞更彻底而不易复发的效果。蒋旭远等[14]报道采用PLE栓塞治疗CHL,术后5~10年有效率为96.4%。这说明TASE术治疗CHL是安全有效的。
肝血管瘤是一种良性病变,因此一定要注意把握治疗程度,尤其是在治疗巨大CHL时,尽量减少术后并发症发生。孔鹏等[15]报道采用PLE治疗肝血管瘤,瘤体栓塞后可见瘤体旁充盈碘的油的小草状门静脉周围支。我们认为巨大CHL治疗主要目的是控制并缩小CHL,缓解患者临床症状。如果PLE进入门静脉分支,平阳霉素就会同样破坏门静脉血管内皮,甚至造成肝纤维化,尤其是对巨大CHL患者,减少对正常肝组织的损伤可降低术后并发症发生。因此,没有必要注射过多PLE致使门静脉小分支显影。
本组22例患者中有8例分别行2次TASE术治疗,均因第1次治疗时部分瘤体供血动脉无法超选择插管,使得瘤体栓塞并不完全,而非选择性栓塞会损伤较多正常肝组织,故6个月后行2次栓塞治疗。我们建议,对部分巨大CHL不必追求1次栓塞完全,可分次栓塞,这样可降低术后并发症发生概率。
部分CHL伴有动静脉瘘或动脉门静脉瘘,在注射PLE前,应根据瘘的程度选择相应大小明胶海绵颗粒封闭瘘口,这样可避免PLE经瘘口进入肺或门静脉内,造成肺纤维化或肝纤维化等严重并发症[16]。但明胶海绵堵瘘后可能造成血管瘤栓塞不彻底,若残存瘤体较大则可再次栓塞。另外,对部分血供不丰富的血管瘤,可采取直接穿刺、平阳霉素瘤体内注射方法治疗,但往往需多次反复进行。近来也有学者采用射频消融方式治疗CHL,但疗效和安全性仍需要更多临床研究加以检验和证实。
TASE术治疗CHL后最常见症状是肝区疼痛,多由栓塞后组织缺血坏死及血栓形成引起的炎性反应或化疗药物直接刺激所致,给予对症治疗可缓解。有文献报道,CHL术后最常见严重并发症为胆囊炎(甚至胆囊坏死)及肝内胆管坏死[17-18]。胆囊炎(甚至胆囊坏死)是误栓胆囊引起,因此在超选择插管时应仔细辨认胆囊动脉,避开后再注射PLE及明胶海绵颗粒,并注意术中不反流;若胆囊动脉显示不清,应尽量超选择至瘤体供血动脉,一定不能在主干行硬化栓塞治疗。肝内胆管损伤或坏死也多由未行超选择超管或PLE注入过多引起。因此,治疗时超选择插管、把握治疗程度犹为重要。
总之,TASE术是一种安全有效地治疗巨大CHL的方法,创伤小、并发症少、恢复快,值得推广应用于临床治疗,但须注意尽量超选择性插管并把握栓塞程度。
[1]欧阳墉,张学军,欧阳雪晖,等.肝海绵状血管瘤的研究进展——图例式阐述[J].介入放射学杂志,2012,21:1-6.
[2]Biecker E,Fischer HP,Strunk H,et al.Benign hepatic tumours[J].Z Gastroenterol,2003,41:191-200.
[3]Corigliano N,Mercantini P,Amodio PM,et al.Hemoperitoneum from a spontaneous rupture of a giant hemangioma of the liver:report of a case[J].Surg Today,2003,33:459-463.
[4]Trotter JF,Everson GT.Benign focal lesions of the liver[J].Clin Liver Dis,2001,5:17-42.
[5]Choi BY,Nguyen MH.The diagnosis and management of benign hepatic tumors[J].JClin Gastroenterol,2005,39:401-412.
[6]Trastek VF,van Heerden JA,Sheedy PF 2nd,et al.Cavernous hemangiomas of the liver:resect or observe? [J].Am J Surg,1983,145:49-53.
[7]Herman P,Costa ML,Machado MA,et al.Management of hepatic hemangiomas:a 14-year experience[J].J Gastrointest Surg,2005,9:853-859.
[8]Erdogan D,Busch OR,Van Delden OM,et al.Management of liver hemangiomas according to size and symptoms[J].J Gastroenterol Hepatol,2007,22:1953-1958.
[9]肖晋昌,祖茂衡,徐 浩,等.平阳霉素瘤体内注射治疗肝血管瘤60例临床分析[J].介入放射学杂志,2013,22:334-336.
[10]Srivastava DN,Gandhi D,Seith A,et al.Transcatheter arterial embolization in the treatment of symptomatic cavernous hemangiomas of the liver:a prospective study[J].Abdom Imaging,2001,26:510-514.
[11]Deutsch GS,Yeh KA,Bates WB,et al.Embolization for management of hepatic hemangiomas[J].Am Surg,2001,67:159-164.
[12]Granov AM,Tarazov PG,Polysalov VN.Arterial embolization in treatment of hepatic cavernoushemangioma[J].Khirurgiia (Mosk),1999,4:13-17.
[13]Giavroglou C,Economou H,Ioannidis I.Arterial embolization of giant hepatic hemangiomas[J].Cardiovasc Intervent Radiol,2003,26:92-96.
[14]蒋旭远,徐 克.平阳霉素碘油乳剂动脉栓塞治疗肝血管瘤的中远期疗效评价[J].介入放射学杂志,2012,21:31-34.
[15]孔 鹏,鹿化伟,王家平,等.平阳霉素碘油乳剂超选择硬化性栓塞治疗肝血管瘤[J].介入放射学杂志,2011,20:123-126.
[16]尹 君,梁惠民,冯敢生,等.肝血管瘤合并动静脉瘘的DSA表现及介入治疗[J].放射学实践, 2005, 20: 1010-1013.
[17]黄晓强,黄志强,段伟东,等.肝海绵状血管瘤肝动脉栓塞后的肝胆并发症及其处理(附9例报告)[J].中国实用外科杂志,2001, 21: 319-320.
[18]刘 伟,陈根生,陈洪波,等.肝海绵状血管瘤的肝动脉栓塞治疗及并发症分析[J].介入放射学杂志,2004,13:428-430.

