胰岛素和丙酮酸乙酯联合治疗拮抗严重烫伤后MODS大鼠炎症反应和氧化应激的实验研究
陈荣剑,王占科,张晓云,王建东,祝仲珍,熊圆圆,兰小鹏,汪仕良
·论著·
胰岛素和丙酮酸乙酯联合治疗拮抗严重烫伤后MODS大鼠炎症反应和氧化应激的实验研究
陈荣剑,王占科,张晓云,王建东,祝仲珍,熊圆圆,兰小鹏,汪仕良
目的 观察胰岛素(INS)和丙酮酸乙脂(EP)拮抗严重烫伤后多器官功能不全综合征(MODS)大鼠炎症反应和氧化应激的效果。方法 将80只SD清洁级30%体表面积Ⅲ度烫伤MODS大鼠随机分为INS治疗组(INS组,n=20)、EP治疗组(EP组,n=20)、INS和EP联合治疗组(INS+EP组,n=20)及治疗对照组(对照组,n=20)。INS组、EP组、INS+EP组及对照组分别腹腔注射INS[2.0 U/(kg·d)]、EP[40 mg/(kg·d)]、INS+EP[2.0 U(kg·d)+40 mg/(kg·d)]及等体积林格液。测定并比较各组伤前及伤后1、3、5、7 d血糖、丙氨酸转氨酶(ALT)、肌酸激酶同工酶(CK-MB)、肌酐(Cr)及肿瘤坏死因子-α(TNF-α)、高迁移率族蛋白1(HMGB1)、丙二醛(MDA)、总抗氧化能力(TAC)。结果 INS组、EP组和INS+EP组伤后各时点血糖、ALT、CK-MB、Cr及血TNF-α、HMGB1和MDA水平均明显低于对照组(P<0.01),TAC水平明显高于对照组(P<0.01);INS+EP组伤后各时点血ALT、CK-MB、Cr、TNF-α、HMGB1和MDA水平均明显低于INS组和EP组(P<0.01),TAC水平明显高于INS组和EP组(P<0.01);INS+EP组和INS组伤后各时点血糖均明显低于EP组(P<0.01),INS+EP组伤后各时点血糖和INS组比较无显著差异(P>0.05),INS组伤后各时点血TNF-α、HMGB1、TAC水平均明显低于EP组(P<0.01),血MDA水平均明显高于EP组(P<0.01)。结论 INS和EP可有效降低严重烫伤后MODS大鼠机体过度炎症反应和改善氧化应激程度,但作用各有侧重,二者联合治疗效果优于单独治疗。
烧伤;多器官功能不全综合征;胰岛素;丙酮酸乙酯;炎症因子;氧化应激指标;大鼠,Sprague-Dawley
多器官功能不全综合征(MODS)指严重感染、创伤或大手术后同时或相继发生的两个系统或器官出现功能不全或障碍的并发症,MODS晚期病死率高。严重创伤后并发肠源性感染造成内毒素血症,诱发机体过度炎症反应、氧化应激和高血糖应激等促进MODS发生与发展[1]。研究发现,胰岛素(INS)治疗不仅可以有效控制高血糖而且具有抗炎和保护肝脏功能作用[2-3],丙酮酸乙酯(EP)不仅具有抗氧化作用也具有抗炎效果[4-5],但胰岛素和EP联合治疗拮抗炎症和氧化应激效果如何,国内外报道不多。为此,本研究以30%体表面积(TBSA)的Ⅲ度严重烫伤内毒素血症伴MODS大鼠作为严重创伤MODS动物模型,观察胰岛素和EP单独和联合治疗对血浆肿瘤坏死因子-α(TNF-α)、高迁移率族蛋白1(HMGB1)等炎症因子和丙二醛(MDA)、总抗氧化能力(TAC)等氧化应激指标的影响,探讨胰岛素和EP联合治疗严重创伤内毒素血症的分子机制,为临床应用和推广胰岛素和EP作为严重创伤内素素血症的治疗药物提供参考依据。
1 材料与方法
1.1 动物 清洁级健康SD大鼠80只,体质量为(200±15)g,雌雄各半[江西中医学院实验动物中心提供,动物生产许可证SCXK(赣)2013-0001,质量合格证:1308112]。
1.2 试药与试剂 长效甘精胰岛素注射液[赛诺菲(北京)制药有限公司,批号:20140052,规格:300 U/3.0 ml];EP(美国Sigma公司,纯度98%,密度1.045 g/ml,分析纯);内毒素(LPS,E.coli O111:B4,美国Sigma公司,分析纯)。血浆TNF-α和HMGB1酶联免疫吸附试验检测试剂盒均由美国Sigma公司生产。MDA化学比色法检测试剂盒购自福建新大陆生物技术股份有限公司。TAC化学终点比色法检测试剂盒购自福建新大陆生物技术股份有限公司。血糖、血丙氨酸转移酶(ALT)、血肌酐(Cr)和血肌酸激酶同工酶(CK-MB)生化检测试剂盒购自深圳迈瑞生物技术有限公司。
1.3 仪器 YXJ-2型离心机由江苏常州万合仪器有限公司生产,HH-W21型电热恒温水浴箱由上海医用恒温设备有限公司生产,BIO-RAD550型酶标仪购自美国伯乐BIO-RAD公司,AU2700型全自动生化分析仪购自美国贝克曼公司。
1.4 动物模型制作和分组 80只SD大鼠在解放军94医院动物实验室清洁级大鼠实验环境下进行适应性喂养3 d,伤前1天进行尾静脉采血,标本作为正常对照组,然后参考文献[6]进行乙醚麻醉,背部剪毛后,浸入(92.0±2.0)℃水中20 s,造成30% TBSA Ⅲ度烫伤,伤后2 h按5 mg/kg体重腹腔注射内毒素(1.0 mg/ml,5.0 ml/kg),同时腹腔注射生理盐水3.0 ml抗休克,伤后1 d肝功能、肾功能和心肌酶明显高于伤前并持续到伤后7 d,为MODS模型制作成功。将制备后的严重创伤内毒素血症MODS模型大鼠按照随机数字法随机分为INS治疗组(INS组)、EP治疗组(EP组)、INS和EP联合治疗组(INS+EP组)、治疗对照组(对照组),每组20只。
1.5 治疗方式和检测指标 ①INS组:配制林格液(氯化钠、氯化钾、氯化钙终浓度分别为8.6、0.3、0.28 g/L),然后用林格液配制终浓度为0.2 U/ml的甘精胰岛素治疗液,于大鼠伤后6 h,参考文献[7]按2.0 U/(kg·d)剂量腹腔注射甘精胰岛素、1/d,连续7 d。②EP组:用林格液配制终浓度为80.0 mg/ml的EP治疗液,于大鼠伤后6 h,参考文献[8]按40 mg/(kg·d)剂量腹腔注射EP治疗液、1/d,连续7 d。③INS+EP组:用林格液配制终浓度分别为0.2 U/L和80.0 mg/ml的甘精胰岛素和EP治疗液,于大鼠伤后6 h,分别按2.0 U/(kg·d)和40 mg/(kg·d)剂量同时腹腔注射甘精胰岛素和EP治疗液、1/d,连续7 d。④对照组:于大鼠伤后6 h,注射等体积林格液、1/d,连续7 d。
1.6 观察指标 统计各组伤前及伤后1、3、5、7 d大鼠存活情况,计算7 d存活率。各组大鼠伤前及伤后1、3、5、7 d进行尾静脉采血,采血前禁食8 h,肝素抗凝混匀,离心,分离血浆,-80℃超低温保存。各组血标本统一冻融,严格按照各指标检测试剂盒说明书进行各项指标测定:空腹血糖、ALT、Cr和CK-MB采用酶法在全自动生化分析仪上进行测定。血浆TNF-α和HMGB1采用酶联免疫吸附试验法在酶标仪上进行测定,血浆MDA采用化学比色法、血浆TAC采用终点比色法分别在全自动生化分析上进行测定。
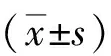
2 结果
2.1 大鼠存活情况 INS+EP组伤后7 d存活率为85%,另3组存活率为80%,组间差异无统计学意义(P>0.05),见表1。

表1 4组严重创伤内毒素血症多器官功能不全综合征模型大鼠不同时点存活情况(只)
注:INS为胰岛素,EP为丙酮酸乙酯;INS+EP组为同时腹腔注射甘精胰岛素和丙酮酸乙脂治疗液,INS组为腹腔注射甘精胰岛素,EP组为腹腔注射丙酮酸乙脂治疗液,对照组为腹腔注射等体积林格液
2.2 大鼠血糖和主要脏器功能指标变化 对照组伤后各时点血糖、ALT、CK-MB和Cr均明显高于伤前(P<0.01),并持续到伤后7 d;INS+EP组、INS组、EP组伤后各时点ALT、CK-MB和Cr均明显低于对照组(P<0.01),且INS+EP组明显低于INS组和EP组(P<0.01);INS+EP组和INS组伤后各时点血糖明显低于EP组(P<0.01),INS+EP组和INS组血糖水平差异无统计学意义(P>0.05)。见表2。
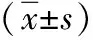
表2 4组严重创伤内毒素血症多器官功能不全综合征模型大鼠血糖、ALT、CK-MB和Cr水平变化
注:INS为胰岛素,EP为丙酮酸乙酯,ALT为丙氨酸转氨酶,CK-MB为肌酸激酶同工酶,Cr为肌酐;INS+EP组为同时腹腔注射甘精胰岛素和丙酮酸乙脂治疗液,INS组为腹腔注射甘精胰岛素,EP组为腹腔注射丙酮酸乙脂治疗液,对照组为腹腔注射等体积林格液;与本组伤前比较,bP<0.01;与对照组比较,dP<0.01;与EP组比较,fP<0.01;与INS组比较,hP<0.01
2.3 大鼠血浆TNF-α和HMGB1水平变化 对照组伤后各时点血浆TNF-α和HMGB1水平均明显高于伤前(P<0.01),并持续到伤后7 d;INS+EP组、INS组、EP组伤后各时点血浆TNF-α和HMGB1水平均明显低于对照组(P<0.01),且INS+EP组明显低于INS组和EP组(P<0.01),INS组又明显低于EP组(P<0.01)。见表3。

表3 4组严重创伤内毒素血症多器官功能不全综合征模型大鼠血浆TNF-α和HMGB1水平变化
注:INS为胰岛素,EP为丙酮酸乙酯,TNF-α为肿瘤坏死因子-α,HMGB1为高迁移率族蛋白B1; INS+EP组为同时腹腔注射甘精胰岛素和丙酮酸乙脂治疗液,INS组为腹腔注射甘精胰岛素,EP组为腹腔注射丙酮酸乙脂治疗液,对照组为腹腔注射等体积林格液;与本组伤前比较,bP<0.01;与对照组比较,dP<0.01;与EP组比较,fP<0.01;与INS组比较,hP<0.01
2.4 大鼠血浆MDA和TAC水平变化 对照组伤后各时点血浆MDA含量明显高于伤前(P<0.01),TAC明显低于伤前(P<0.01),并持续到伤后7 d;INS+EP组、INS组、EP组伤后各时点血浆MDA含量均明显低于对照组(P<0.01),且INS+EP组明显低于INS组和EP组(P<0.01);INS+EP组、INS组、EP组伤后各时点血浆TAC水平均明显高于对照组(P<0.01),且INS+EP组明显高于INS组和EP组(P<0.01);INS组伤后各时点血浆MDA含量均明显高于EP组(P<0.01),TAC水平却明显低于EP组(P<0.01)。见表4。
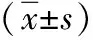
表4 4组严重创伤内毒素血症多器官功能不全综合征模型大鼠血浆MDA和TAC水平变化
注:INS为胰岛素,EP为丙酮酸乙酯,MDA为丙二醛,TAC为总抗氧化能力; INS+EP组为同时腹腔注射甘精胰岛素和丙酮酸乙脂治疗液,INS组为腹腔注射甘精胰岛素,EP组为腹腔注射丙酮酸乙脂治疗液,对照组为腹腔注射等体积林格液;与本组伤前比较,bP<0.01;与对照组比较,dP<0.01;与EP组比较,fP<0.01;与INS组比较,hP<0.01
3 讨论
MODS患者器官功能尚未衰竭,早期发现和干预可得到改善[9]。本研究结果显示,严重烫伤内毒素血症MODS大鼠肝功能指标ALT、肾功能指标Cr、心肌酶谱指标CK-MB和血糖均明显高于伤前,并持续到伤后7 d,提示创伤MODS动物模型复制成功。健康大鼠生命力与人类不同,MODS患者可能有其他基础疾病或本身处于亚健康水平,这可能是本研究实验MODS动物模型病死率仅为20%的原因。
本研究结果显示,INS组、EP组、INS+EP组伤后各时点肝功能、肾功能、心肌酶谱指标和血糖等均明显低于对照组,提示INS和EP治疗均可以改善创伤后MODS大鼠相关器官功能,且联合治疗效果优于单独治疗,但各治疗组伤后器官功能指标均没有完全恢复到正常水平,说明INS和EP只是治疗创伤后MODS的手段之一,创伤后MODS需综合治疗,而不是单一治疗。
胰岛素是促进机体葡萄糖有效利用和降低高血糖的体内唯一激素。严重创伤后内毒素血症诱发过度炎症反应和氧化应激,导致胰岛B细胞功能障碍和胰岛素抵抗造成机体高血糖促进MODS发生与发展,胰岛B细胞功能不全可作为MODS重要组成部分。创伤后感染炎症应激、氧化应激、高血糖应激和MODS互为因果,互相促进MODS发生与发展[10-11]。
严重烧伤后早期TNF-α升高促进MODS发生与发展[12]。HMGB1是一种存在于真核细胞,可与染色体结合的非组蛋白类蛋白质,HMGB1可分泌到细胞外与TNF-α相互诱导,参与机体的过度炎症反应,并在脓毒血症和弥漫性血管内凝血(DIC)发生机制中发挥重要作用[13-15]。氧化应激指机体氧自由基生成过多,机体抗氧化能力下降,造成机体组织细胞膜被氧化损伤的病理状态。MDA为组织细胞膜多不饱和脂肪酸被氧化的降解产物,血浆MDA水平可作为间接反映机体氧自由基损害的指标。TAC是测定机体内还原性物质含量的指标,体内还原性物质含量越高,抗氧化能力就越强。MDA和TAC可作为评估机体氧化应激的相关指标[16-17]。本研究结果显示,严重烫伤MODS大鼠伤后不同时点血浆TNF-α,HMGB1和MDA均明显高于伤前,TAC明显低于伤前,提示严重烫伤MODS大鼠同时存在炎症反应和氧化应激状态。
有文献报道,胰岛素治疗可有效控制高血糖,明显降低严重创伤危重患者外周血TNF-α和HMGB1等炎症因子水平,抑制外周血单个核细胞核转录因子κB(NF-κB)基因表达,从而降低多种炎症细胞因子的水平,改善MODS患者的预后[18-23]。本研究结果表明,胰岛素治疗控制高血糖可明显降低严重烫伤MODS大鼠TNF-α和HMGB1水平,同时降低血浆MDA水平,提示胰岛素具有抗炎和抗氧化作用,其抗氧化机制不甚清楚,可能是通过抗炎效果的间接作用[24-26]。EP是一种还原剂,溶解在林格液中稳定性好、无毒性。有文献报道,EP不仅具有抗氧化作用,也具有抗炎效果[27-28]。其抗氧化作用机制与丙酮酸分子上存在还原性酮基有关,还原性酮基可清除细胞内活性氧自由分子,而不需要酶的催化。有文献报道,EP可改善脓毒血症大鼠肠道屏障功能损害,并可调节脓毒血症小鼠炎症细胞因子和抗炎细胞因子的表达[29-31]。本研究结果表明,EP可明显降低严重烫伤MODS大鼠血浆MDA含量、提高血浆TAC水平,同时降低血浆TNF-α和HMGB1水平,提示EP同时具有抗氧化和抗炎作用,也可作为防治创伤后MODS的辅助治疗药物。
本研究进一步发现,胰岛素降低炎症因子效果明显优于EP,而EP抗氧化效果明显优于INS,提示INS和EP在抗炎和抗氧化方面作用各有侧重,INS和EP联合治疗降低严重烫伤MODS大鼠炎症因子及抗氧化效果明显优于二者单独应用,为临床防治创伤后MODS提供了新思路。
[1] 胡桂华,鲍海咏.多器官功能障碍综合征的研究进展[J].中国临床研究,2014,27(12):1542-1544.
[2] Jeschke M G, Kraft R, Song J. Insulin protects against hepatic damage postburn[J].Mol Med, 2011,17(5-6):516-522.
[3] 李金林,周姚,邹玲,等.强化胰岛素治疗对严重多发伤患者炎症介质和预后的影响[J].江苏医药,2014,40(4):474-476.
[4] 张庆伟,王春亭,王启志,等.丙酮酸乙酯对脓毒症大鼠小肠黏膜屏障的保护作用及其机制[J].山东大学学报(医学版),2014,52(5):30-34.
[5] Cruz R J Jr, Harada T, Sasatomi E,etal. Effects of ethyl pyruvate and other α-keto carboxylic acid derivatives in a rat model of multivisceral ischemia and reperfusion[J].J Surg Res, 2011,165(1):151-157.
[6] 王占科,杨莉萍,褚芳,等.严重创伤多器官功能不全综合征大鼠模型建立[J].实验动物与比较医学,2005,25(4):218-220,232
[7] Wang Z, Liu L, Hu T,etal. Protective effect of glucose-insulin-potassium (GIK) on intestinal tissues after severe burn in experimental rats[J].Burns, 2012,38(6):846-854.
[8] 祝仲珍,蔺静,王占科,等.丙酮酸乙酯对严重烫伤内毒素血症大鼠炎症反应及氧化应激的作用[J].中华烧伤杂志,2014,30(5):443-446.
[9] 陈敏,王海芳,王艳,等.连续性血液净化联合参麦注射液治疗多器官功能障碍综合征效果观察[J].山东医药,2015,50(12):90-92.
[10]王占科.创伤高血糖与感染和MODS早期诊断和干预[J].现代诊断与治疗,2010,21(3):129-133.
[11]黄可强. 血糖水平在判断合并应激性高血糖的ICU患者预后中的应用价值[J].中国当代医药,2014,21(10):53-54.
[12]梁蓉,荣新洲,张涛,等.甘露醇对新西兰兔严重烧伤早期血清TNF-α和IL-6的影响及其脏器功能的保护机制[J].南方医科大学学报,2013,33(4):598-602.
[13]孙立,陈旭林,郭峰,等.高迁移率族蛋白B1对严重烧伤大鼠枯否细胞的影响及晚期糖基化终末产物受体的作用[J].中华烧伤杂志,2013,29(2):158-161.
[14]Eskici Z M, Acikgoz S, Piskin N,etal. High mobility group B1 levels in sepsis and Disseminated Intravascular Coagulation[J]. Acta Biochim Pol, 2012,59(4):561-566.
[15]陈晓林,李建英,王小众,等.脓毒症大鼠肠道损伤中高迁移率族蛋白 B1的变化及丙酮酸乙酯的保护作用[J].中国急救医学,2015(6):481-485.
[16]刘颐轩,宋桉,王芸,等.氧化应激在肥胖及胰岛素抵抗中的作用研究进展[J].解放军医药杂志,2014,26(1):99-101.
[17]向毅,陈钢,王胜军,等.不同幅度脉冲膈肌起搏对兔膈肌SOD、MDA、总抗氧化能力的影响[J].中华物理医学与康复杂志,2004,26(5):269-271.
[18]Ingels C, Derese I, Wouters P J. Soluble RAGE and the RAGE ligands HMGB1 and S100A12 in critical illness: impact of glycemic control with insulin and relation with clinical outcome[J].Shock, 2015,43(2):109-116.
[19]周虹,马俊勋,高诗博,等.胰岛素强化治疗对严重创伤患者炎症介质和外周血核转录因子κB的影响[J].临床急诊杂志,2014,10(12):709-712.
[20]王占科.血糖应激适度理论与多器官功能障碍综合征早期诊断与干预[J].中国全科医学,2008,11(12):1027-1029.
[21]Sun Q, Li J, Gao F.New insights into insulin: The anti-inflammatory effect and its clinical relevance[J].World J Dibdetes, 2014,15(2):89-96.
[22]张胜兰,李乾望,范西红,等.胰岛素强化治疗对危重症合并高血糖患者外周血单核细胞NF-κB活性的影响[J].解放军医学杂志,2008,33(2):207-209.
[23]王琪,张雪枝.早期胰岛素强化治疗重度颅脑损伤的疗效观察[J].中国医药导报,2011,8(11):190-191.
[24]陈涛,刘先保,陈郡兴,等.地塞米松对大鼠产后出血致多器官功能障碍综合征氧化应激和炎症因子释放的影响[J].中华产科急救电子杂志,2013,2(3):202-206.
[25]黄海,宋成运,马建新,等.氧化应激和炎症反应在糖尿病性心肌病中的作用及相互关系[J].中华临床医师杂志(电子版),2012,6(16):4905-4906.
[26]关国宏,黄宝强,肖杰扬,等.强化胰岛素治疗危重症患者应激性高血糖的临床研究[J].中国当代医药,2013,20(17):82-83.
[27]施宏,梁伟民,高艳琴,等.丙酮酸乙酯(EP)的抗炎作用及机制[J].复旦学报(医学版),2012,39(3):309-312.
[28]乔晓辉,王怀立,黄明海,等.感染性脑损伤中血清高迁移率族蛋白B1的表达及丙酮酸乙酯的保护作用[J].实用药物与临床,2013,16(9):774-777.
[29]张庆伟,王春亭,王启志,等.丙酮酸乙酯对脓毒症大鼠小肠黏膜屏障的保护作用及其机制[J].山东大学学报(医学版),2014,24(5):30-34.
[30]陈雷,张晓菲,王丽纯,等.丙酮酸乙酯对脓毒症小鼠细胞因子信号转导调节机制研究[J].现代生物医学进展,2013,13(19):3629-3631.
[31]张晓云,陈荣剑,王占科,等.脓毒症氧化应激与抗氧化治疗研究进展[J].中华临床医师杂志(电子版),2014,8(12):2350-2354.
An Experimental Study on Insulin Combined with Ethyl Pyruvate in Treatment of MODS Rats with Inflammatory Response and Oxidative Stress after Severe Burns
CHEN Rong-jian1a, WANG Zhan-ke1b, ZHANG Xiao-yun2, WANG Jian-dong3, ZHU Zhong-zhen1c, XIONG Yuan-yuan1b, LAN Xiao-peng4, WANG Shi-liang5
(a. Department of General Surgery, b. Department of Clinical Laboratory, c. Department of Infection Control and Management, 1. 94 Hospital of PLA, Nanchang 330002, China; 2. Department of Clinical Laboratory, 184 Hospital of PLA, Yingtan, Jiangxi 335000, China; 3. Department of Pathology, Nanjing General Hospital of Nanjing Military Area Command, Nanjing 210002, China; 4. Department of Clinical Laboratory, Fuzhou General Hospital of Nanjing Military Area Command, Fuzhou 350100, China; 5. Institute of Burns of PLA, the First Affiliated Hospital of the Third Military Medical University, Chongqing 400038, China)
Objective To observe the effect of Insulin (INS) combined with Ethyl Pyruvate (EP) in treatment of multiorgan dysfunction syndrome (MODS) rats with inflammatory response and oxidative stress after severe burns. Methods A total of 80 MODS rats with degree III burns over 30% of body surface area were randomly divided into INS treatment group (n=20), EP treatment group (n=20), INS+EP group (n=20) and control group (n=20). The INS, EP, INS+EP and control groups were respectively given peritoneal injection with INS [2.0 U/(kg·d)], EP [40 mg/(kg·d)], INS+EP [2.0 U/(kg·d)+40 mg/(kg·d)] and same volume of Ringer Solution. The values of alanine transarninase (ALT), MB isoenzyme of creatine kinase (CK-MB), creatinine (Cr) of blood glucose and concentrations of tumor necrosis factor-α (TNF-α), high mobility group protein-1 (HMGB1), malondialdehyde (MDA) and total anti-oxidant capability (TAC) of blood in all groups were detected and compared before the injury and on 1st, 3rd, 5thand 7thd after the injury. Results The levels of ALT, CK-MB and Cr of blood glucose, and TNF-α, HMGB1, and MDA levels of blood in INS, EP and INS + EP groups at different time points were significantly lower (P<0.01), while TAC levels were significantly higher than those in the control group (P<0.01). The levels of ALT, CK-MB and Cr of blood glucose, and TNF-α, HMGB1 and MDA of blood at different time points in INS + EP group after burns were significantly lower (P<0.01), while the TAC levels were significantly higher than those in INS and EP groups (P<0.01). The levels of blood glucose at different time points in INS + EP and INS groups after burns were significantly lower than those in EP group (P<0.01). There were no significant differences in levels of blood glucose at different time points in INS + EP and INS groups after burns (P>0.05). The levels of TNF-α, HMGB1 and TAC were significantly lower (P<0.01), and the MDA levels were significantly higher at different time points in INS group after burns than those in EP group (P<0.01). Conclusion Insulin and Ethyl Pyruvate can effectively weaken the inflammatory response and oxidative stress of MODS rats after severe burns. Both Insulin and Ethyl Pyruvate have their own advantages, and the effect of combination therapy is better than that of mono-therapy.
Burns; Multiple organ dysfunction syndrome; Insulin; Ethyl pyruvate; Inflammatory factor; Oxidative stress index; Rat, Sprague-Dawley
江西省科技支撑重点项目(2008BAI52B03);江西省卫生厅课题(20082044)
330002 南昌,解放军94医院普通外科(陈荣剑),检验科(王占科、熊圆圆),感染管理科(祝仲珍);335000 江西 鹰潭,解放军184医院检验科(张晓云);210002 南京,南京军区南京总医院病理科(王建东);350025 福州,南京军区福州总医院检验科(兰小鹏);400038 重庆,第三军医大学第一附属医院全军烧伤研究所(汪仕良)
王占科,E-mail:wangzhanke@sina.com
R365;R-332
A
2095-140X(2015)08-0045-06
10.3969/j.issn.2095-140X.2015.08.012
2015-06-16 修回时间:2015-07-05)

