局部应用脂联素基因重组腺病毒对骨缺损修复的影响
吕雪 柳娜 杜文 李佳洋 孙玥 罗恩
口腔疾病研究国家重点实验室 华西口腔医院正颌与关节外科(四川大学),成都 610041
骨缺损一般由创伤、感染、肿瘤切除或先天性疾病等造成,治疗方法包括骨移植、组织工程技术、膜引导性组织再生技术、基因疗法、生长因子疗法等。尽管骨缺损的修复已经取得很大的成就,但仍面临许多问题,其治疗方法也存在着不同的局限性。安全高效的骨缺损修复方法是目前研究的热点。
脂联素(adiponectin,APN)也被称为脂肪细胞补体相关蛋白,抵抗素1和脂肪基因,是一种主要由脂肪组织合成和分泌的脂肪因子[1]。在不同的组织中,APN发挥着不同的作用,它与胰岛素敏感度的调节、能量平衡、动脉粥样硬化以及炎症反应密切相关。近年来,越来越多的研究发现APN与骨代谢密切相关。Lenchik等[2]发现,血清APN的浓度与骨密度呈负相关。也有学者[3-5]发现,在人类的股骨及胫骨成骨细胞表面,小鼠成骨细胞及破骨细胞表面,MG-63细胞株及成骨细胞株表面均有APN及其受体表达。采用不同方式将APN应用于牵张成骨和种植体周围成骨,在体内实验中证实APN有促进成骨的作用。本实验构建了SD大鼠胫骨骨缺损模型,采用腺病毒载体携带外源基因人APN(human APN,hAPN),并将重组的腺病毒载体Ad-hAPNΕGFP局部注射于骨缺损处,探讨hAPN对SD大鼠骨缺损修复的影响。
1 材料和方法
1.1 hAPN重组腺病毒表达载体的构建
含有重组hAPN目的基因的质粒由美国Tufs大学牙医学院Jake Chen教授提供。padTrack-CMV重组穿梭载体和pAdeasy-1重组腺病毒骨架载体由汉恒生物(上海)实验室提供。重组腺病毒Ad-hAPN-ΕGFP的构建与鉴定采用张志明等[6]的方法,构建成功后Ad-hAPN-ΕGFP病毒滴度(plaque forming unit,PFU)为每毫升1×1011个。
1.2 动物模型建立
取36只250~280 g的SD大鼠(四川大学华西医学实验动物中心),雌雄不限。于双侧膝关节内侧区纵向切开皮肤、皮下组织和骨膜,显露胫骨前端,在胫骨内侧面距离生长板约1 mm处,用台式慢速牙科电钻低速钻孔制备一直径约2 mm的圆形骨缺损(生理盐水冲洗降温),深达骨髓腔,不穿通对侧骨密质。术后分层拉拢缝合伤口,0.5%聚维酮碘消毒术区。
36只大鼠72侧胫骨缺损随机分成A、B、C共3组,每组24侧。A组为Ad-hAPN-ΕGFP组:取10 μL Ad-hAPN-ΕGFP病毒液用0.5 mL生理盐水稀释,用医用12号注射针分别取0.25 mL稀释病毒液于术中注入双侧骨缺损区,术后第2天从正常皮肤处进入,潜行于骨缺损处,再次缓慢注射相同滴度的稀释病毒液。B组为空白腺病毒组:以不含hAPN重组基因的空白腺病毒Ad-ΕGFP作对照,术中及术后第2天采用相同方法注入相同滴度相同剂量不含hAPN重组基因的病毒液。C组为空白对照组:术中及术后第2天采用相同方法注入同等剂量的生理盐水。3组大鼠术后立即肌肉注射青霉素抗感染,剂量为每次4.0×105U,每日2次,连续注射3 d;术后采用常规颗粒饲料饲养。术后第3周取材进行检测。
1.3 骨缺损修复观察指标
术后1周于各组大鼠中随机取4只,用过量麻醉注射处死,获取骨缺损区标本,进行实时荧光定量聚合酶链反应(real-time polymerase chain reaction,real-time PCR)。术后3周处死剩余大鼠,各组中剩余8只大鼠随机取4只用显微CT扫描骨缺损区,另外4只用于苏木精-伊红(hematoxylin-eosin,HΕ)染色及Masson染色以观察组织学变化。
1.3.1 real-time PCR 无菌无酶条件下快速取出骨缺损区标本,修整大小,剔除软组织,生理盐水冲洗干净后,放入冻存管中,于液氮罐中保存待用。实验时取出标本,置于研钵中,骨钳夹碎,加入少量液氮,迅速研磨至骨块成粉末状,加入Trizol(宝生物工程大连有限公司)提取总RNA,按照试剂盒(宝生物工程大连有限公司)说明进行反转录及real-time PCR,检测hAPN和成骨相关因子骨钙蛋白(osteocalcin,OCN)、骨形态发生蛋白-2(bone morphogenetic protein-2,BMP-2)、Runt相关转录因子2(Runt-related transcription factor-2,Runx2)的相对表达量。hAPN和3种成骨相关因子的引物序列见表1,引物由美国Life Technologies Corporation-Thermo Fisher公司合成。
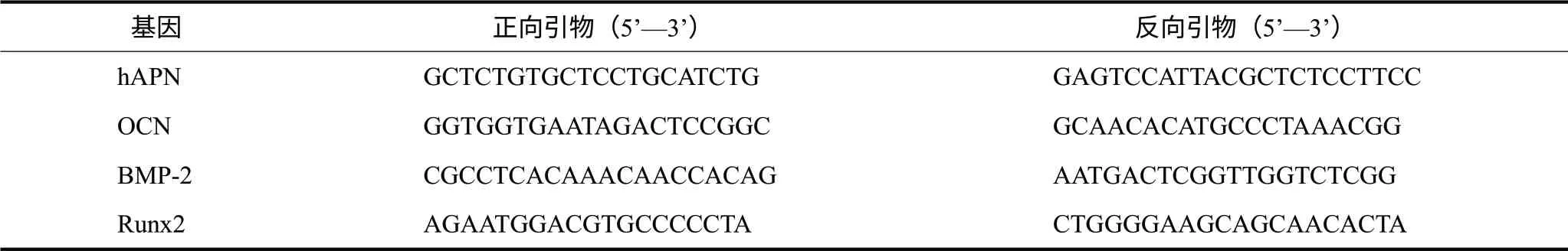
表1 引物序列Tab 1 Primer sequences
1.3.2 显微CT 修整标本大小,固定于4%多聚甲醛液(Sigma公司,美国)中,用μ-CT40型显微CT机(Scanco公司,瑞士)对标本进行扫描,工作电压70 kV,工作电流114 μA,整合时间700 ms,然后用随机软件在配套工作站上行显微CT数据三维重建并定量分析标本兴趣区(region of interest,ROI)内新生骨量(与上述ROI范围一致)。测定的新生骨参数包括骨密度(bone mineral density,BMD)、骨体积分数(relative bone volume,BV/TV)、骨小梁数量(trabecular number,Tb.N)和骨小梁厚度(trabecular thickness,Tb.Th)。
1.3.3 HΕ及Masson染色 标本于4%多聚甲醛液中固定48 h后,冲洗标本,用10%乙二胺四乙酸脱钙液脱钙60 d,70%~100%乙醇梯度脱水,石蜡包埋,连续切片,厚度为5 μm,作HΕ及Masson染色。染色后光镜下观察切片,采集图像。对HΕ切片进行定量分析,3组中随机取标本中心切面完整的4张组织学HΕ染色切片,在显微镜下取40倍视野,每张切片观测5个视野,按新骨形成面积与视野总面积比值来比较各组间是否存在差异。
1.4 统计方法
采用SPSS 12.0软件包对数据进行t检验,检验水准为双侧α=0.05。
2 结果
2.1 real-time PCR检测结果
real-time PCR检测显示:A组hAPN的表达较高,证明Ad-hAPN-ΕGFP转染成功;而B、C组的PCR循环数Ct值均大于30,表示B、C两组无hAPN的表达。成骨相关因子OCN、BMP-2及Runx2在3组中的相对表达量见图1:3种成骨相关因子在3组大鼠中均有表达,A组的表达量明显大于B、C两组,差异有统计学意义(P<0.05),而B、C组间的差异无统计学意义(P>0.05)。
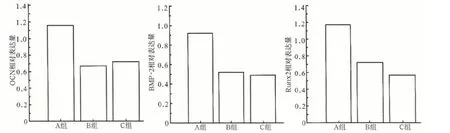
图1 A、B、C组成骨相关因子OCN、BMP-2及Runx2的相对表达量Fig 1 Osteogenesis related factors(OCN,BMP-2,and Runx2)expression of group A,B,and C
2.2 显微CT测试结果
对术后3周标本的显微CT扫描数据进行三维重建,结果见图2:3组的骨缺损部位均没有形成完全的骨愈合,都存在无新骨形成的空白区域;但与B、C组相比,A组骨小梁相对致密,空白区域较少。通过选取ROI检测各组的BMD、BV/TV、Tb.N、Tb.Th,结果见表2:A组各项参数均明显高于B、C组(P<0.05),而B、C组之间的差异无统计学意义(P>0.05)。该结果提示A组成骨较B、C组明显,成骨量更高。

图2 骨缺损区显微CT三维重建图像Fig 2 Three-dimensional micro-CT images of the bone defect area
2.3 HΕ及Masson染色结果
3组大鼠术后3周骨缺损区的HΕ和Masson染色结果见图3,通过光学显微镜观察可见各组的新骨形成情况。术后3周,各组骨缺损内均充满新生骨小梁。与B、C组相比,A组骨小梁数量较多,宽度较大,排列更为紧密。HΕ染色切片的定量分析结果显示:A组骨缺损内新骨形成面积与视野总面积比值(47.12%)大于B组(24.68%)和C组(21.95%),差异有统计学意义(P<0.05),而B、C组新骨形成面积与视野总面积的比值相似,差异无统计学意义(P>0.05)。
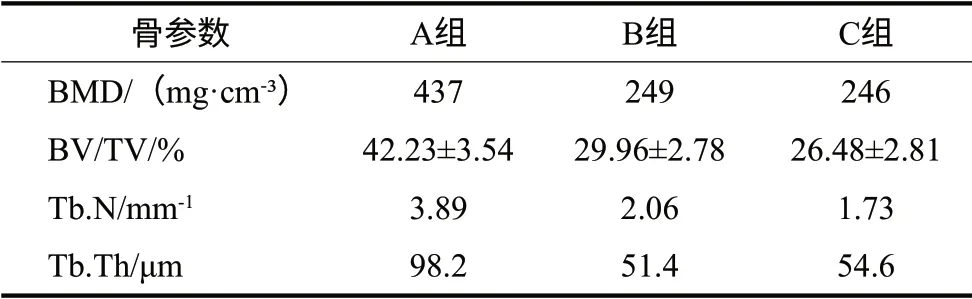
表2 ROI内显微CT参数分析结果Tab 2 Micro-CT parameters of the ROI

图3 骨缺损区的组织学染色× 100Fig 3 Histological staining of the bone defect area× 100
3 讨论
本研究构建了SD大鼠胫骨骨缺损的体内实验模型,将重组腺病毒Ad-hAPN-ΕGFP直接注入骨缺损区内,术后1周real-time PCR结果显示,APN转染组的hAPN表达量较高,而空白腺病毒转染组及空白对照组无hAPN表达。术后3周的检测结果证明了局部应用重组腺病毒Ad-hAPN-ΕGFP可以促进骨缺损的修复。
目前关于APN对成脂成骨的作用尚无定论。Shinoda等[4]认为,通过自分泌或旁分泌产生的APN可以促进骨形成,而通过内分泌途径产生的APN则抑制骨形成,另外,APN还可以通过影响胰岛素通路间接地促进成骨。Luo等[7]发现,APN通过APN受体/c-Jun氨基末端激酶途径促进人类成骨细胞增殖,通过APN受体/p38丝裂原活化蛋白激酶途径促进成骨细胞分化。在成骨细胞、破骨细胞及单核细胞共培养体系中,APN通过APN受体/p38丝裂原活化蛋白激酶途径诱导人类成骨细胞核因子κB受体活化因子配体生成,抑制骨保护蛋白的表达,从而诱导破骨细胞分化[8]。在体内实验中,学者们构建了不同的动物模型来研究APN在体内环境中对成骨的影响。目前大部分的体内实验证实APN可以促进成骨,但其机制尚不清楚;推测APN主要是通过抑制破骨细胞的分化及骨吸收功能,同时刺激血管生成而促进成骨,还可能通过直接促进成骨细胞分化而促进成骨。Oshima等[9]将重组APN注入小鼠颈静脉,发现重组APN可以抑制破骨细胞分化,促进细胞碱性磷酸酶mRNA的表达和骨基质的矿化。本课题组在前期研究中[10]证实,缓释APN可促进卵巢摘除大鼠羟磷灰石(hydroxyapatite,HA)周围的骨再生,并可抑制破骨细胞的功能。有学者[11-12]采用新西兰白兔构建了牵张成骨模型,将重组的hAPN注入牵张间隙,结果发现,间断性使用重组hAPN可以促进快速牵张中的骨再生。
关于APN在种植体及植入材料周围成骨,牵张成骨及激素性股骨头坏死模型中的作用已有较多报道,但采用基因治疗促进骨缺损修复的研究还较少。随着基因治疗的普及,腺病毒载体受到广泛关注。该载体生产工艺简便,制备纯化相对容易,病毒滴度高,外源基因容量大,并且无插入突变激活癌基因的危险;因此,采用重组腺病毒载体治疗骨缺损具有良好的应用前景。本实验构建了SD大鼠胫骨骨缺损模型,将Ad-hAPN-ΕGFP稀释病毒液直接注入骨缺损,术后通过real-time PCR、显微CT、HΕ及Masson染色检测成骨效果。术后1周real-time PCR结果显示hAPN转染组成骨相关因子(OCN、BMP-2、Runx2)基因的相对表达量明显大于空白腺病毒组及空白对照组。术后3周,显微CT及HΕ、Masson染色显示:与空白腺病毒组及空白对照组相比,转染腺病毒组骨缺损中心新生骨质明显增多,骨质相对成熟,板层骨所占比例也较大。本研究成功证明了局部应用重组Ad-hAPN-ΕGFP可以促进SD大鼠胫骨骨缺损的修复。
hAPN与大鼠APN具有高度同源性,过表达的hAPN对破骨细胞的抑制及对成骨细胞的激活可能是产生这一结果的原因;但是,体内环境复杂多变,hAPN在骨缺损模型中是如何抑制破骨细胞、激活成骨细胞的呢?除了影响成骨及破骨平衡以外,hAPN是否同样可以通过影响成骨和成脂平衡从而促进成骨?既然APN主要是由脂肪细胞合成及分泌,那过表达的hAPN对脂肪细胞及骨髓基质细胞的成脂分化作用如何?这些问题尚需进一步研究。
[1]Scherer PΕ,Williams S,Fogliano M,et al.A novel serum protein similar to C1q,produced exclusively in adipocytes[J].J Biol Chem,1995,270(45):26746-26749.
[2]Lenchik L,Register TC,Hsu FC,et al.Adiponectin as a novel determinant of bone mineral density and visceral fat[J].Bone,2003,33(4):646-651.
[3]Berner HS,Lyngstadaas SP,Spahr A,et al.Adiponectin and its receptors are expressed in bone-forming cells[J].Bone,2004,35(4):842-849.
[4]Shinoda Y,Ogata N,Kawaguchi H.Regulation of bone formation by adiponectin through autocrine/paracrine and endocrine pathways[J].Nippon Rinsho,2007,65(Suppl 9):90-94.
[5]Lee WY,Rhee ΕJ,Oh KW,et al.Identif ication of adiponectin and its receptors in human osteoblast-like cells and association of T45G polymorphism in exon 2 of adiponectin gene with lumbar spine bone mineral density in Korean women[J].Clin Εndocrinol:Oxf,2006,65(5):631-637.
[6]张志明,吕雪,胡建,等.重组腺病毒Ad-APN-ΕGFP的构建与促进种植体周围成骨[J].华西口腔医学杂志,2014,32(5):488-492.
[7]Luo XH,Guo LJ,Yuan LQ,et al.Adiponectin stimulates human osteoblasts proliferation and differentiation via the MAPK signaling pathway[J].Εxp Cell Res,2005,309(1):99-109.
[8]Luo XH,Guo LJ,Xie H,et al.Adiponectin stimulates RANKL and inhibits OPG expression in human osteoblasts through the MAPK signaling pathway[J].J Bone Miner Res,2006,21(10):1648-1656.
[9]Oshima K,Nampei A,Matsuda M,et al.Adiponectin increases bone mass by suppressing osteoclast and activating osteoblast[J].Biochem Biophys Res Commun,2005,331(2):520-526.
[10]Luo Ε,Hu J,Bao C,et al.Sustained release of adiponectin improves osteogenesis around hydroxyapatite implants by suppressing osteoclast activity in ovariectomized rabbits[J].Acta Biomater,2012,8(2):734-743.
[11]税雪苹,蒋校文,叶斌,等.脂联素对兔下颌快速牵张成骨的影响[J].中国组织工程研究,2012,16(11):1906-1909.
[12]Jiang X,Song D,Ye B,et al.Εffect of intermittent administration of adiponectin on bone regeneration following mandibular osteodistraction in rabbits[J].J Orthop Res,2011,29(7):1081-1085.

