人牙龈干细胞的分离鉴定及基质细胞衍生因子-1对其趋化效应的研究
杜令倩 杨丕山 葛少华
1.山东大学第二医院口腔科,济南 250033;2.山东大学口腔医院牙周病科 山东省口腔生物医学重点实验室,济南 250012
牙周病治疗的最终目标是重建因炎症而破坏的牙周支持组织,关键是有足够量的功能细胞迁移到组织缺损区域,发挥干细胞作用,引导牙周缺损组织的再生。然而,由于长期慢性炎症的影响,病损区域功能细胞数量不足,功能不佳,如何获得更多的再生性功能细胞是牙周病治疗的关键。近年来,从牙龈组织中分离的牙龈干细胞(gingival mesenchymal stem cells,GMSCs)受到了高度关注,无论是在体内环境还是在体外环境中,GMSCs都显示出具有多向分化、自我更新和免疫调节的能力,并具有组织愈合能力强且无瘢痕愈合的特点[1-2]。此外,GMSCs还具有取材容易、来源丰富、抗炎和免疫调节功能。从病变牙龈组织中分离培养的GMSCs,其自我更新及多向分化能力与健康牙龈组织无明显差异[3],因此,牙周病治疗过程中,募集病损周围的GMSCs迁移到缺损区域,发挥干细胞作用以重建牙周组织为牙周组织再生提供新的思路。
趋化因子基质细胞衍生因子-1(stromal cellderived factor-1,SDF-1)即CXCL12,属于趋化因子CXC家族,它通过激活G-蛋白偶联的特异性受体CXCR4,调控细胞的分化、增殖,细胞迁移及细胞形态等活性[4-6]。SDF-1能够募集骨髓基质干细胞归巢,调控其增殖和分化,从而在组织和器官的再生中发挥重要作用。本课题组在前期研究[7]中证实,趋化因子具有募集包括牙周膜干细胞迁移到牙周创区从而促进牙周组织再生的能力。目前关于SDF-1对GMSCs的趋化效应却知之甚少,本研究的目的是观察趋化因子SDF-1受体CXCR4在人GMSCs上的表达及SDF-1对人GMSCs的趋化效应。
1 材料和方法
1.1 主要试剂和仪器
α-MEM培养基、胎牛血清(fetal bovine serum,FBS)(Hyclone公司,美国),Ⅰ型胶原酶、DispaseⅡ、胰蛋白酶(Gibco公司,美国),维生素C、地塞米松、β-甘油磷酸钠、抗坏血酸、茜素红、油红O(Sigma公司,美国),SDF-1(Santa Cruz公司,美国),CXCR4抗体(R&D Systems公司,美国),抗CD44、抗CD73、抗CD90、抗CD105、 抗CD166、抗CD45、抗CD14、抗CD34抗体(BioLegend公司,美国),异硫氰酸荧光素(fluorescein isothiocyanate,FITC)荧光标记二抗、4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)(北京中杉金桥生物科技有限公司)。各型号培养板、培养瓶、冻存管、离心管等(Corning公司,美国),70 μm细胞筛网(Falcon公司,美国)。GBB16 CO2紫外清洁型培养箱(Heraeus公司,德国),DL-CJ-IN型高性能超净工作台(哈尔滨市东联电子技术公司),BP221S型电子分析天平(德国赛多利斯股份公司),OLYMPUS荧光显微镜和成像系统(Olympus公司,日本),流式细胞分析仪(Beckman Coulter公司,美国)等。
1.2 实验方法
1.2.1 原代细胞培养 标本的取得经山东大学医学院医学伦理委员会批准(审批编号为2010015),并获取患者的知情同意,签署知情同意书。标本取自临床上需行牙冠延长术的6例牙周健康患者术中切除的牙龈组织,分别将牙龈组织剪碎后,移入6个离心管中,加入3 g·L-1的Ⅰ型胶原酶和4 g·L-1DispaseⅡ轻轻振荡,37 ℃下消化2 h,通过细胞筛网获得单个离散的细胞,将细胞密度调整为60个·cm-2,接种于含α-MEM培养基的培养皿中,培养基中含20% FBS、2 mmol·L-1L-谷氨酰胺、1 mmol·L-1丙酮酸钠、50 U·mL-1青霉素、50 μg·mL-1链霉素和2.5 μg·mL-1两性霉素B,37 ℃、5%CO2、饱和湿度条件下培养,每隔3 d换液,待细胞铺满培养瓶底70%~80%后传代。来自6个样本的细胞分别进行以下实验。
1.2.2 有限稀释法分离人GMSCs 取对数生长期的细胞,消化成单细胞悬液,稀释至每毫升10个细胞,接种于96孔板中,加液至每孔0.1 mL,培养24 h后,在显微镜下挑出只含单个细胞的孔并标记,每隔3 d换液。显微镜下观察孔内细胞形成较大克隆并长至孔底1/3~1/2后,消化并扩大培养,此时获得的细胞即GMSCs。
1.2.3 人GMSCs克隆形成能力分析 将GMSCs以每孔500个细胞的密度分别接种于六孔板中,培养液为含20%FBS的α-MEM,5%CO2、37 ℃饱和湿度条件下培养14 d,PBS冲洗2遍,4%多聚甲醛固定,甲苯胺蓝染色,显微镜下观察计数,多于50个细胞的集落记为1个克隆。克隆形成率(colony forming unitfibroblastic,CFU-F)计算公式如下:CFU-F=细胞克隆形成数/接种细胞数×100%。
1.2.4 人GMSCs表面抗原的检测 将GMSCs制成单细胞悬液,调整细胞密度为1×105个·mL-1,分别与FITC标记的单克隆抗体CD44、CD73、CD90、CD105、CD166、CD14、CD34、CD45在冰上孵育1 h后,加入二抗(CD14、CD34、CD45不用二抗),冰上孵育30 min,1%多聚甲醛固定,4 ℃避光保存,用流式细胞仪分析相关抗原标志物的表达。
1.2.5 人GMSCs多向分化能力的检测 分别用成骨诱导剂(0.1 μmol·L-1地塞米松,50 mg·L-1维生素C,10 mmol·L-1β-甘油磷酸钠)、成脂诱导剂(0.5 μmol·L-1地塞米松,60 μmol·L-1吲哚美辛,0.5 mmol·L-1异丁基甲基黄嘌呤,10 mg·L-1牛胰岛素)诱导GMSCs向成骨和成脂方向分化,并分别用茜素红钙盐染色法、油红O染色法来测定GMSCs的多向分化能力。
1.2.6 免疫荧光法检测SDF-1受体CXCR4在人GMSCs上的表达 将人GMSCs制成细胞爬片,进行免疫荧光染色。4%多聚甲醛室温固定15 min,10%山羊血清37 ℃封闭30 min后滴加适量稀释后的CXCR4抗体(1∶50),以PBS代替一抗作阴性对照,置于湿盒中4 ℃孵育过夜。次日在37 ℃下避光孵育l h后加入FITC荧光标记的二抗,避光孵育1 h,用5 μg·mL-1DAPI复染细胞核5 min,检测趋化因子SDF-1受体CXCR4的表达。
1.2.7 SDF-1对人GMSCs的趋化效应 用多聚碳酸膜上有8 μm微孔的24孔Transwell细胞培养室检测人GMSCs对SDF-1的趋化反应[7-8]。将第3代GMSCs调整至细胞密度为5×105个·mL-1,在细胞培养室的上腔分别加入200 μL细胞悬液(含0.01% FBS的α-MEM培养基),实验组的下腔分别加入终质量浓度为100、200 ng·mL-1SDF-1和50 μg·mL-1CXCR4中和抗体的含0.01%FBS的α-MEM培养基500 μL。空白对照组下腔中加入含0.01%FBS的α-MEM培养基500 μL。为证实细胞的迁移效应是由于SDF-1的趋化效应而非细胞的化学运动,消除细胞培养室上下腔中SDF-1的浓度梯度,上下腔中所用培养液均含有100 ng·mL-1SDF-1。所有的样本均设有复孔。37 ℃、5%CO2、饱和湿度条件下培养24 h后,用4%多聚甲醛固定滤膜上下表面附着的细胞30 min,用棉签轻轻拭去滤膜上表面的细胞,PBS冲洗。伊红染色滤膜3 min,PBS冲洗。待滤膜干燥后,计数已迁移至滤膜下侧面的细胞,每个滤膜随机观察3个不重叠的高倍视野。
1.3 统计学处理
每组实验重复4次,所得数据使用SPSS 13.0统计软件包进行处理。计量资料统计结果以均数±标准差表示,多组样本均数比较采用单因素方差分析,检验水准为双侧α=0.05。
2 结果
2.1 形态学观察
原代培养的人GMSCs呈集落样生长(图1A),有限稀释法体外分离扩增获得人GMSCs(图1B),人GMSCs具有成纤维细胞的形态特征,细胞多呈长梭形,具有2~3个细胞突起,细胞核居中(图1C)。
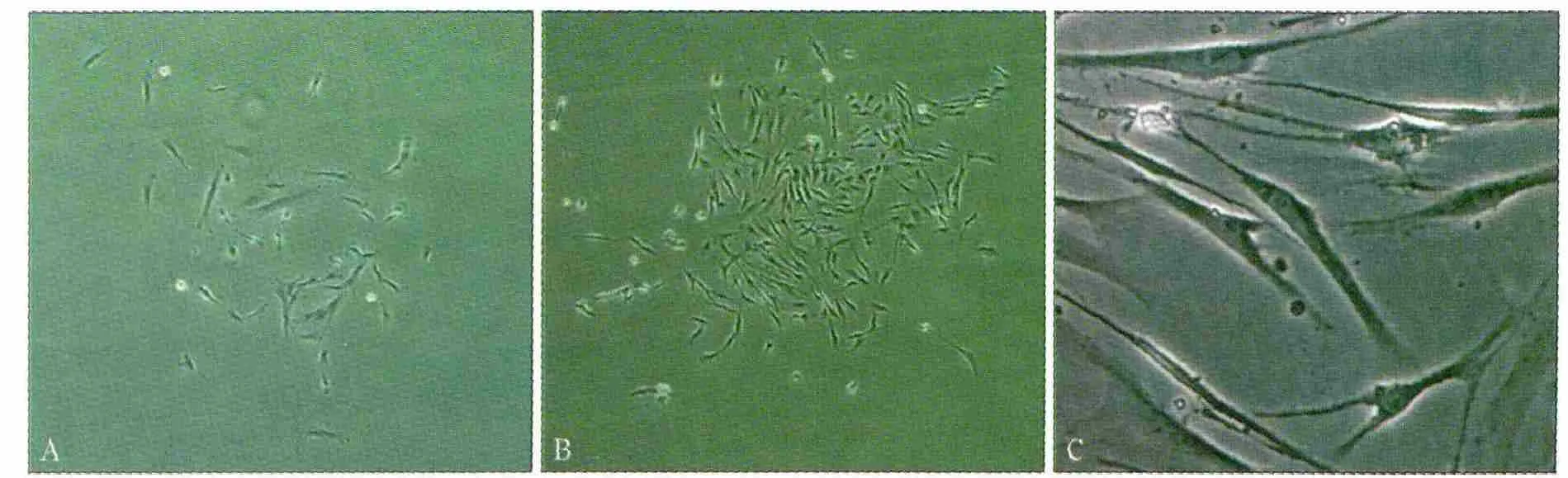
图1 人GMSCs的分离培养 倒置相差显微镜Fig 1 Isolation and characterization of human GMSCs inverted phase contrast microscope
2.2 人GMSCs的CFU-F分析
GMSCs在体外呈集落样增殖,形成克隆细胞簇(图2),经计算,GMSCs的CFU-F为21.4%±2.8%。
2.3 人GMSCs表面标志物的表达
通过流式细胞仪检测,人GMSCs表面标志物表达见图3:GMSCs阳性表达间充质干细胞表面标志物CD44、CD73、CD90、CD105和 CD166(阳性率分别为99.40%、99.86%、99.95%、99.39%、99.89%),而造血干细胞表面标志物CD14、CD34和CD45表达为阴性(阳性率分别为0.57%、0.79%、0.80%)。

图2 人GMSCs形成的单克隆集落 甲苯胺蓝染色Fig 2 Human GMSCs cell clusters derived from a single colony toluidine blue
2.4 人GMSCs向成骨细胞及成脂细胞分化
经成骨诱导剂诱导4周后,茜素红钙盐染色显示红色的矿化结节形成(图4左),呈散在分布,周边界限不清,周围可见GMSCs,生长中心处矿化结节较多。经成脂诱导剂诱导4周后,油红O染色显示细胞内出现密集红染的脂肪小滴(图4右),GMSCs向脂肪细胞分化。
2.5 SDF-1受体CXCR4在人GMSCs上的表达
免疫荧光检测的结果如图5所示:人GMSCs上趋化因子SDF-1受体CXCR4呈阳性表达,细胞膜和细胞质发出红色荧光,细胞核经DAPI染色后发出蓝色荧光。
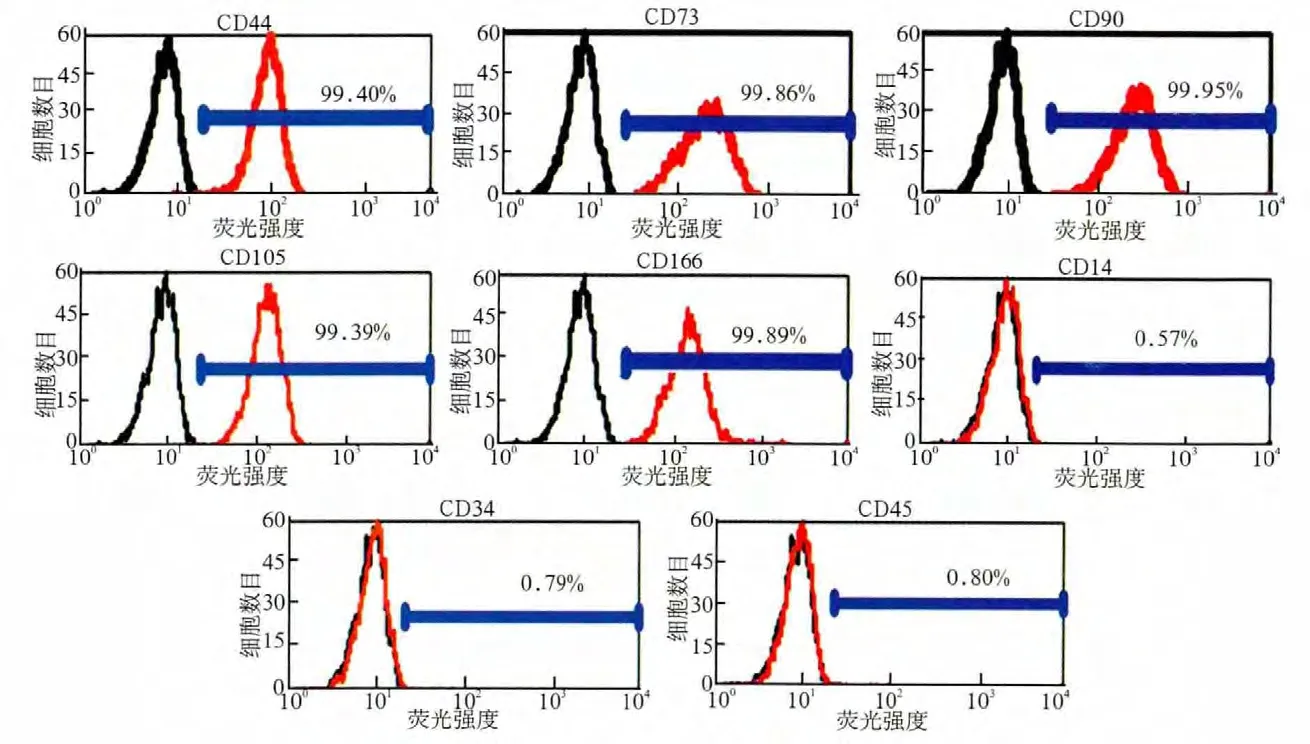
图3 流式细胞仪检测人GMSCs表面标志物表达Fig 3 The result of flowcytometry analysis of human GMSCs
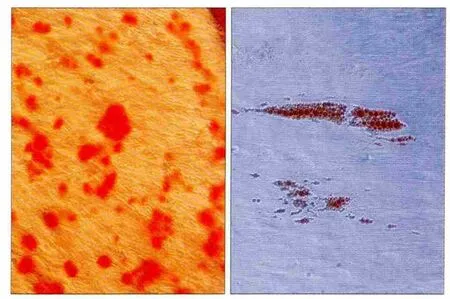
图4 人GMSCs向成骨细胞和成脂细胞分化情况× 40Fig 4 Osteogenic and adipogenic differentiation potentials of human GMSCs× 40
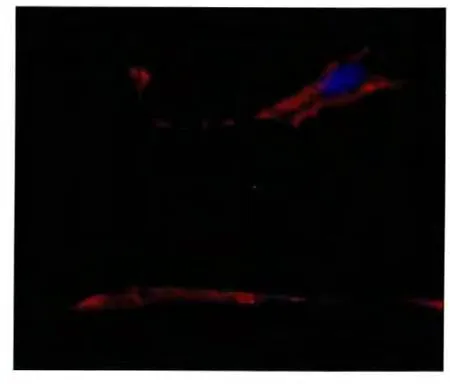
图5 人GMSCs表达CXCR4,CXCR4发出红色荧光,细胞核发出蓝色荧光 免疫荧光染色× 400Fig 5 Expression of CXCR4 on human GMSCs,CXCR4 red fluorescent signals and nuclei blue signals immunohistochemical staining× 400
2.6 SDF-1对人GMSCs的趋化效应
在不同质量浓度的SDF-1作用下,人GMSCs对SDF-1显示不同的趋化反应。SDF-1为100、200 ng·mL-1时,GMSCs迁移至膜下表面的每高倍视野细胞数目分别是189.3±4.4和164.6±4.9,细胞数目明显多于空白对照组的47.8±2.5,差异有统计学意义(P<0.01)。经50 μg·mL-1CXCR4中和抗体处理后,与空白对照组相比,迁移的细胞数目明显减少,每高倍视野细胞数从47.8±2.5减少到29.0±2.4,其差异有统计学意义(P<0.01),这提示SDF-1的促迁移效应是由CXCR4介导的。在消除细胞培养室上下腔中SDF-1浓度梯度后,迁移至膜下表面的每高倍视野细胞数目为51.3±3.0,明显少于下腔中含100 ng·mL-1SDF-1实验组的189.3±4.4(P<0.01),说明GMSCs细胞的迁移是由SDF-1引起的趋化效应而不是GMSCs的化学运动。
3 讨论
牙周缺损组织的再生是牙周病治疗的难点,近年来,以干细胞为基础的再生性治疗措施使牙周缺损修复取得了一定的进展。干细胞移植[9]及各种生长因子的应用[10]等方式可以通过增加牙周病损区域间充质干细胞的数量并促进其增殖分化以修复牙周缺损;但是干细胞介导的治疗需要从患者健康组织处取材,进行大量的体外操作,而在体外培养中,间充质干细胞会丧失其原有表型,增殖、分化、迁移、归巢等很多干细胞的特性逐渐丧失[11-12],移植细胞的成瘤性、免疫排斥还无法解决,而且还存在伦理道德等方面的不利因素,因此,从牙周病损周围组织及血管中募集更多的再生性细胞可能是牙周组织再生研究的一个更重要方向。
GMSCs一直以来被看作是牙周组织再生的不利因素,然而近年来的研究证实,从牙龈组织中分离的GMSCs具有自我更新能力并有多向分化潜能,比骨髓基质细胞具有更强的增殖能力且表型稳定,经长期的体外培养仍能保持正常的细胞核型和端粒酶活性[13],这可能是造成牙龈组织愈合能力强且能够无瘢痕愈合的原因之一。研究[14]表明,GMSCs在体内具有成骨能力,可以有效修复裸鼠下颌及颅骨缺损,提示GMSCs在牙周病的治疗中具有广阔的研究前景和开发空间。还有研究[3]发现,虽然牙周病变组织存在长期的慢性炎症,但从病变牙龈组织中分离培养的GMSCs的自我更新及多向分化能力与健康牙龈组织无明显差异。由此推测,将GMSCs应用于牙周组织再生具有可行性,并具有良好的临床推广价值,因此将GMSCs从牙周缺损周围募集到缺损区可能促进炎症组织早期愈合修复及再生。
本研究成功分离出人GMSCs,有较高的自我更新能力,并高表达间充质干细胞表面标志物CD44、CD73、CD90、CD105和CD166,而造血干细胞标志物CD14、 CD34和CD45表达阴性。体外克隆形成实验表明,GMSCs有较高的克隆形成能力。在体外诱导环境下,GMSCs具有向成骨细胞及成脂细胞分化的能力。
本实验将趋化因子SDF-1引入GMSCs中。SDF-1和CXCR4是研究最多的一对趋化因子配体和受体,SDF-1能够促进骨髓基质干细胞和其他前体细胞活化、生长和迁移。本研究检测了趋化因子SDF-1受体CXCR4在人GMSCs上的表达,并研究了SDF-1对GMSCs迁移能力的影响,结果显示,SDF-1对体外培养的人GMSCs具有趋化效应。趋化因子SDF-1受体CXCR4的表达得到证实,并且CXCR4的中和抗体能显著降低SDF-1引起的迁移效应,进一步证实CXCR4为SDF-1的特异性受体,并提示这种趋化效应可能是通过其特异性受体CXCR4介导的。在本研究中,100 ng·mL-1的SDF-1促迁移效应要优于200 ng·mL-1,而对于牙周膜干细胞,SDF-1在200 ng·mL-1时促细胞迁移作用更佳[7],原因可能与不同细胞表面SDF-1受体CXCR4的数目及表达水平存在差异有关。SDF-1/CXCR4信号通路在局部炎症及牙周组织修复过程中扮演着双重角色[15]。与健康对照组比较,牙周炎局部病损部位SDF-1与CXCR4表达水平升高,SDF-1募集GMSCs到病损区域的同时可能也募集了宿主防御细胞,在参与创伤愈合及组织修复的过程中也可能参与了宿主防御细胞的免疫监视。此外,前期实验[7]结果表明,SDF-1通过其特异性受体CXCR4对人牙周膜干细胞有剂量依赖性的趋化效应,并且SDF-1能够提高人牙周膜干细胞的细胞活性,促进其增殖并促进胶原形成。所有这些研究结果表明,有希望通过原位组织工程的方法,利用SDF-1募集牙周膜干细胞及GMSCs到达病损区域,通过促进这些细胞的活性、增殖及分化以修复牙周缺损;这些设想尚需进一步的体内实验去证实。
[1]Mitrano TI,Grob MS,Carrión F,et al.Culture and characterization of mesenchymal stem cells from human gingival tissue[J].J Periodontol,2010,81(6):917-925.
[2]Zhang Q,Nguyen AL,Shi S,et al.Three-dimensional spheroid culture of human gingiva-derived mesenchymal stem cells enhances mitigation of chemotherapy-induced oral mucositis[J].Stem Cells Dev,2012,21(6):937-947.
[3]Ge S,Mrozik KM,Menicanin D,et al.Isolation and characterization of mesenchymal stem cell-like cells from healthy and inflamed gingival tissue:potential use for clinical therapy[J].Regen Med,2012,7(6):819-832.
[4]Kortesidis A,Zannettino A,Isenmann S,et al.Stromalderived factor-1 promotes the growth,survival,and development of human bone marrow stromal stem cells[J].Blood,2005,105(10):3793-3801.
[5]Stich S,Loch A,Leinhase I,et al.Human periosteum-derived progenitor cells express distinct chemokine receptors and migrate upon stimulation with CCL2,CCL25,CXCL8,CXCL12,and CXCL13[J].Eur J Cell Biol,2008,87(6):365-376.
[6]Lataillade JJ,Clay D,Dupuy C,et al.Chemokine SDF-1 enhances circulating CD34(+)cell proliferation in synergy with cytokines:possible role in progenitor survival[J].Blood,2000,95(3):756-768.
[7]Du L,Yang P,Ge S.Stromal cell-derived factor-1 signif icantly induces proliferation,migration,and collagen type Ⅰexpression in a human periodontal ligament stem cell subpopulation[J].J Periodontol,2012,83(3):379-388.
[8]杜令倩,杨丕山,赵宁,等.人牙周膜干细胞的分离鉴定及骨形态发生蛋白-2对其趋化效应的研究[J].华西口腔医学杂志,2012,30(1):13-17.
[9]Liu Y,Zheng Y,Ding G,et al.Periodontal ligament stem cell-mediated treatment for periodontitis in miniature swine[J].Stem Cells,2008,26(4):1065-1073.
[10]Dereka XE,Markopoulou CE,Vrotsos IA.Role of growth factors on periodontal repair[J].Growth Factors,2006,24(4):260-267.
[11]Honczarenko M,Le Y,Swierkowski M,et al.Human bone marrow stromal cells express a distinct set of biologically functional chemokine receptors[J].Stem Cells,2006,24(4):1030-1041.
[12]Rombouts WJ,Ploemacher RE.Primary murine MSC show highly eff icient homing to the bone marrow but lose homing ability following culture[J].Leukemia,2003,17(1):160-170.
[13]Tomar GB,Srivastava RK,Gupta N,et al.Human gingivaderived mesenchymal stem cells are superior to bone marrowderived mesenchymal stem cells for cell therapy in regenerative medicine[J].Biochem Biophys Res Commun,2010,393(3):377-383.
[14]Wang F,Yu M,Yan X,et al.Gingiva-derived mesenchymal stem cell-mediated therapeutic approach for bone tissue regeneration[J].Stem Cells Dev,2011,20(12):2093-2102.
[15]Havens AM,Chiu E,Taba M,et al.Stromal-derived factor-1alpha(CXCL12)levels increase in periodontal disease[J].J Periodontol,2008,79(5):845-853.

