基于RNA-Seq识别山羊肉品质候选基因
孟宪然,杜 琛,王 静,付绍印,郑竹清,张文广*,李金泉*
(1.内蒙古农业大学动物科学学院,动物遗传育种与繁殖自治区重点实验室,呼和浩特 010018; 2.内蒙古医科大学附属医院 妇产科生殖医学中心,呼和浩特 010050)
基于RNA-Seq识别山羊肉品质候选基因
孟宪然1#,杜 琛2#,王 静1,付绍印1,郑竹清1,张文广1*,李金泉1*
(1.内蒙古农业大学动物科学学院,动物遗传育种与繁殖自治区重点实验室,呼和浩特 010018; 2.内蒙古医科大学附属医院 妇产科生殖医学中心,呼和浩特 010050)
通过研究不同年龄和不同性别绒山羊背最长肌之间的差异表达基因,筛选影响绒山羊肉品质的候选基因。本研究基于RNA-Seq技术对4个绒山羊背最长肌的转录组进行高通量测序,在测序评估的基础上,对差异表达基因进行筛选、功能注释和富集分析。本研究通过CLC Genomics Workbench 6.0软件共找到263个候选基因,其中包含123个高表达有利基因和140个高表达有害基因。GO功能注释结果显示,高表达有利基因主要与骨骼肌的生长发育、细胞器的形成和蛋白结合功能有关;高表达有害基因主要与脂质代谢、细胞骨架以及结合功能有关。利用KEGG数据库作为参考,这些基因主要参与糖酵解/糖异生、丝裂原活化蛋白激酶、凝血-补体级联反应和色氨酸代谢等通路中。结合其他家畜基因组学研究,ADIPOQ、PDK4和CD36可能作为参与肉品质重要的候选基因。该结果为绒山羊肉品质的改善以及候选基因的研究提供了理论依据。
绒山羊;背最长肌;肉品质;RNA-Seq;候选基因
羊肉是人类饮食中主要的蛋白质来源之一,已被证实具有良好的营养价值,其肉质特性与现在消费者对营养肉的需求相一致,具有令人满意的食用品质[1]。羊肉品质易受去势、性别、年龄以及品种等多种因素影响。远在殷商时代中国已有家畜去势的记载,目的是消除家畜的性欲,使家畜的肉质得以改善、产量提高。去势能够增加肌内脂肪沉积,降低瘦肉率、屠宰率和剪切力值,提高肉的嫩度,同时能够增加血液中FSH和LH水平,降低促性腺激素和雄激素睾酮浓度,减少肉的膻味,进而改善公畜肉品质[2-3]。郑中朝等[4]对波杂肉羊的屠宰性能以及肉品质进行了研究,发现随着年龄的增长,成年羊的屠宰性能优于羔羊,肌内脂肪含量增加,但成年羊肉的剪切力值较高,肉的嫩度变差;母羊的生长优势显著低于公羊,但成年母羊的肌内脂肪含量显著高于成年公羊,剪切力值显著降低,成年母羊肉的嫩度明显优于成年公羊。王梦霖等[5]研究表明,随着年龄的增长,周岁羊的产肉性能明显优于羔羊,剪切力值和纤维直径显著增加,嫩度降低;母羊的屠宰性能显著低于公羊,但随着肌内脂肪沉积增加,肥肉率显著高于公羊,肉的嫩度增加。由此可知,公羊肉因其肉质特性较差,膻味重等特点很难被消费者接受。
转录组是指特定组织或细胞在某一发育阶段或功能状态下转录出来的所有基因转录产物的总和,不仅包括mRNA,而且还包括非编码RNA,是连接基因组遗传信息与蛋白质组生物功能的桥梁[6-7]。转录组技术不仅能够分析转录本结构和表达水平,同时也能发现未知转录本和稀有转录本,精确地识别可变剪切位点,提供更为全面的转录组信息[8-9]。近年来,随着高通量测序技术的不断发展,特别是RNA高通量测序技术的应用,使得转录组学研究得到了长足的进步,并应用于不同领域的多方位研究[10]。RNA高通量测序技术(RNA-Seq),即利用大规模测序技术直接对cDNA序列进行测序,产生数以千万计的reads,从而使得一段特殊的基因组区域的转录水平可以直接通过比对到该基因组区域的reads数来衡量[11]。目前主要应用于差异基因表达分析、功能基因挖掘、等位基因特异性表达、RNA剪接和融合基因转录子等相关研究中[12-13]。RNA-Seq对于真核生物的基因表达调控、癌症治疗和遗传育种等方面的研究具有不可估量的潜力。随着转录组技术的迅猛发展,已经得到人类和许多动植物的转录组信息,这为进一步研究生物的功能基因组学奠定了基础。
目前关于山羊肉品质的研究还不像猪肉和牛肉等那样广泛且深入,利用转录组学技术研究山羊肉品质的报道更是少之又少。因此,本研究基于RNA-Seq技术在基因水平上对山羊背最长肌基因表达进行比较研究,以期筛选出与山羊肉品质相关的候选基因,从而为山羊肉品质的改善以及功能基因组学的研究提供理论依据。
1 材料与方法
1.1 材料
样品来自内蒙古白绒山羊种羊场。选取成年公羊、成年母羊、断奶公羔和断奶母羔的背最长肌为试验样品,采集后置于液氮中迅速冷冻,之后置于-80 ℃冰箱中保存备用。
1.2 背最长肌RNA提取、建库及测序
按照Trizol法提取绒山羊背最长肌的总RNA,然后用无RNA酶(RNase)的DNA酶(DNase-I)处理去除总RNA中可能存在的痕量基因组DNA,最后再通过琼脂糖凝胶电泳检测总RNA的完整性,用核酸测定仪测定RNA浓度。以1 mg总RNA为起始量,参照Illumina建库试剂盒进行cDNA文库构建,具体操作见Truseq mRNA sample prep kit v2说明书。转录组测序工作由本实验室完成。
1.3 转录组数据组装及候选基因分析
利用CLC Genomics Workbench 6.0软件对4个绒山羊背最长肌转录组的原始测序数据结果进行过滤和拼接组装,筛选样品间的差异表达基因,然后对各个差异表达基因进行注释和功能分类。以人类基因组为参考,通过DAVID软件对绒山羊肉品质的候选基因进行GO和KEGG功能富集分析。
2 结 果
2.1 绒山羊背最长肌转录组的组装
获得RNA-Seq的原始数据后去除其中低质量的数据,结果共获得52 415 590个reads片段,其中成年公羊、成年母羊、断奶公羔和断奶母羔背最长肌转录组的reads数分别为12 807 070、12 927 794、13 825 310和12 855 416个,平均读长为90 bp,共包含4 717 403 100个核苷酸序列信息,GC含量为49.4%。由此可以看出此次转录组测序的结果较好,可为后续的数据组装提供较好的原始数据。利用DeNovo方法对52 415 590个reads进行拼接共获得65 329个contigs,N50值为1 059 nt,其长度分布如图1所示。然后将clean reads映射到contigs上,结果见表1。
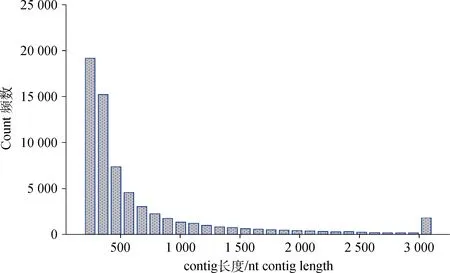
图1 绒山羊背最长肌转录组的contig长度分布Fig.1 Distribution of contig length for transcriptome of longissimus dorsi in cashmere goats
表1 绒山羊背最长肌转录组reads的Mapping统计结果
Table1 Reads mapping statistics of RNA-Seq oflongissimusdorsiin cashmere goats

样本名称Sample片段Reads比对上的Reads百分比/%PercentofReadsmapped核苷酸序列碱基数Nucleotides成年公羊(A)Adultrams(A)1280707091.011152636300成年母羊(B)Adultewes(B)1292779491.401163501460断奶公羔(C)Malelambsweaned(C)1382531091.361244277900断奶母羔(D)Femalelambsweaned(D)1285541690.331156987440合计Total524155904717403100
2.2 候选基因的筛选
首先筛选出绒山羊背最长肌4个转录组的差异表达基因,将所有差异表达基因取并集作为可能影响山羊肉品质性状的候选基因。基因表达量的计算使用RPKM(Reads Per Kb per Million Reads)法,其计算公式:
其中,RPKM为特定生物样品中某一基因的表达水平;R为匹配到该基因上的原始reads数目;N为该样品测序得到的reads总数;L为该基因的长度(bp)。本研究利用CLCGenomicsWorkbench6.0软件共找到474个成年公羊与成年母羊,成年公羊与断奶公羔,成年母羊与断奶母羔及断奶公羔与断奶母羔背最长肌间的差异表达基因(P<0.05,FDR<0.001 和FoldChange≥2),其中成年公羊与成年母羊背最长肌间共201个,成年公羊与断奶公羔背最长肌间共120个,成年母羊与断奶母羔背最长肌间共100个,断奶公羔与断奶母羔背最长肌间共53个。取并集去重后共筛选到263个绒山羊肉品质候选基因,其中将成年公羊与另外3种羊基因表达量的比值大于2的基因定义为高表达有害基因,共计140个;表达量比值小于0.5的基因定义为高表达有利基因,共计123个,结果见表2。
表2 绒山羊肉品质候选基因
Table2 Candidate genes of meat quality in cashmere goats
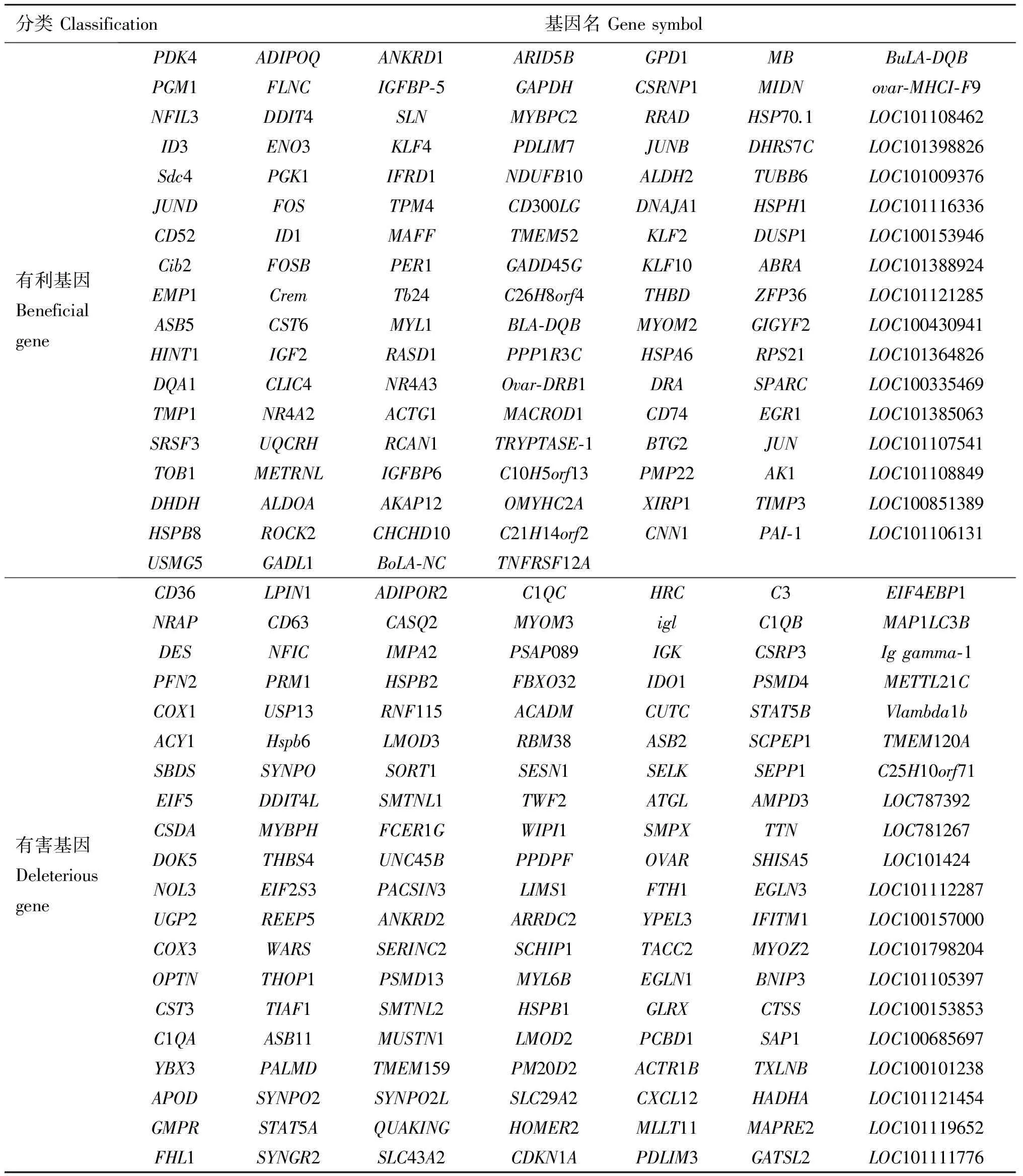
分类Classification基因名Genesymbol有利基因BeneficialgenePDK4ADIPOQANKRD1ARID5BGPD1MBBuLA⁃DQBPGM1FLNCIGFBP⁃5GAPDHCSRNP1MIDNovar⁃MHCI⁃F9NFIL3DDIT4SLNMYBPC2RRADHSP70.1LOC101108462ID3ENO3KLF4PDLIM7JUNBDHRS7CLOC101398826Sdc4PGK1IFRD1NDUFB10ALDH2TUBB6LOC101009376JUNDFOSTPM4CD300LGDNAJA1HSPH1LOC101116336CD52ID1MAFFTMEM52KLF2DUSP1LOC100153946Cib2FOSBPER1GADD45GKLF10ABRALOC101388924EMP1CremTb24C26H8orf4THBDZFP36LOC101121285ASB5CST6MYL1BLA⁃DQBMYOM2GIGYF2LOC100430941HINT1IGF2RASD1PPP1R3CHSPA6RPS21LOC101364826DQA1CLIC4NR4A3Ovar⁃DRB1DRASPARCLOC100335469TMP1NR4A2ACTG1MACROD1CD74EGR1LOC101385063SRSF3UQCRHRCAN1TRYPTASE⁃1BTG2JUNLOC101107541TOB1METRNLIGFBP6C10H5orf13PMP22AK1LOC101108849DHDHALDOAAKAP12OMYHC2AXIRP1TIMP3LOC100851389HSPB8ROCK2CHCHD10C21H14orf2CNN1PAI⁃1LOC101106131USMG5GADL1BoLA⁃NCTNFRSF12A有害基因DeleteriousgeneCD36LPIN1ADIPOR2C1QCHRCC3EIF4EBP1NRAPCD63CASQ2MYOM3iglC1QBMAP1LC3BDESNFICIMPA2PSAP089IGKCSRP3Iggamma⁃1PFN2PRM1HSPB2FBXO32IDO1PSMD4METTL21CCOX1USP13RNF115ACADMCUTCSTAT5BVlambda1bACY1Hspb6LMOD3RBM38ASB2SCPEP1TMEM120ASBDSSYNPOSORT1SESN1SELKSEPP1C25H10orf71EIF5DDIT4LSMTNL1TWF2ATGLAMPD3LOC787392CSDAMYBPHFCER1GWIPI1SMPXTTNLOC781267DOK5THBS4UNC45BPPDPFOVARSHISA5LOC101424NOL3EIF2S3PACSIN3LIMS1FTH1EGLN3LOC101112287UGP2REEP5ANKRD2ARRDC2YPEL3IFITM1LOC100157000COX3WARSSERINC2SCHIP1TACC2MYOZ2LOC101798204OPTNTHOP1PSMD13MYL6BEGLN1BNIP3LOC101105397CST3TIAF1SMTNL2HSPB1GLRXCTSSLOC100153853C1QAASB11MUSTN1LMOD2PCBD1SAP1LOC100685697YBX3PALMDTMEM159PM20D2ACTR1BTXLNBLOC100101238APODSYNPO2SYNPO2LSLC29A2CXCL12HADHALOC101121454GMPRSTAT5AQUAKINGHOMER2MLLT11MAPRE2LOC101119652FHL1SYNGR2SLC43A2CDKN1APDLIM3GATSL2LOC101111776
2.3 候选基因的GO功能分类
GO(Gene Ontology)是一个国际标准化的基因功能分类体系,将基因按照其参与的生物学过程、细胞组分和分子功能3个角度进行分类,进而对基因进行限定和描述。本研究利用David软件中的“GO Functional Annotation Chart”模块分别对高表达有利基因和高表达有害基因进行GO功能分类,筛选P<0.05的通路并统计每一类基因的数量,结果如图2所示。在生物学过程中,高表达有利基因主要与发育相关,主要参与骨骼肌的生长发育过程。已有研究显示,ADIPOQ(脂联素)能够加快畜禽肌肉组织中葡萄糖的转运、游离脂肪酸的β氧化和改善胰岛素抗性等生物学作用,其主要是通过活化AMP激活的蛋白激酶(AMPK)和丝裂原活化蛋白激酶(MAPK)途径激活β氧化和氧化磷酸化过程中相关基因的表达来实现的[14-16]。另外,脂联素受体能够通过调控CD36的表达影响脂肪酸的跨膜转运。高表达有害基因主要与调控和脂质代谢相关。在细胞组成分中,高表达有利基因主要参与细胞器的形成;高表达有害基因主要与细胞骨架相关。在分子功能中,高表达有利基因和高表达有害基因主要与结合功能相关。

a.高表达有利基因;b.高表达有害基因a.Highly expressed beneficial genes; b.Highly expressed deleterious genes图2 高表达有利和有害基因GO功能分类Fig.2 Gene Ontology of highly expressed beneficial and deleterious genes
2.4 候选基因的KEGG代谢通路富集分析
在生物体内,不同基因相互协调行使其生物学功能,根据KEGG的分析有助于进一步分析差异表达基因中存在的显著性富集的代谢通路注释。本研究使用David软件中的“KEGG Functional Annotation Chart”模块分别对高表达有利基因和高表达有害基因进行KEGG通路富集分析,结果共得到10条通路,其中显著富集的通路有7条,主要参与到糖酵解/糖异生、丝裂原活化蛋白激酶、凝血-补体级联反应、朊病毒病、ErbB受体、色氨酸代谢和系统性红斑狼疮等通路中(表3)。糖酵解/糖异生过程对于维持动物机体的能量代谢平衡和骨骼肌的发育有重要的影响,其中PDK4(丙酮酸脱氢酶激酶4)在这一过程中起着重要的作用。有研究表明,PDK4对于脂肪沉积有促进作用,其主要是通过抑制自身的活性激活PDC(丙酮酸脱氢酶复合体)进而增加葡萄糖向脂肪酸转化来实现。
3 讨 论
本研究通过RNA-Seq方法共筛选到263个对绒山羊肉品质有影响的候选基因,其中包含123个高表达有利基因和140个高表达有害基因。其中高表达有利基因PDK4(丙酮酸脱氢酶激酶4)是PDK/BCKDK蛋白激酶家族成员之一,在调节骨骼肌糖代谢与脂肪酸转换的过程中发挥重要的调控作用,与动物骨骼肌的生长发育密切相关。N.De Jager[17]对牛骨骼肌的基因表达进行研究,发现西澳大利亚牛骨骼肌中的PDK4表达量远高于新南威尔士牛,并且西澳大利亚牛骨骼肌的大理石纹等级优于新南威尔士牛,这表明PDK4表达量越高,肌内脂肪沉积越多,肉品质越好。本研究发现,随着年龄的增长,母羊骨骼肌中的PDK4表达量随之升高,而公羊骨骼肌的PDK4表达量随之降低,结果会导致母羊骨骼肌中沉积的脂肪含量高于公羊,这与王梦霖等[5]研究结果一致。因此,PDK4可作为影响绒山羊肉品质的一个重要候选基因,但需要进一步深入研究。
表3 高表达有利基因和有害基因KEGG代谢途径分类
Table3 KEGG classification of highly expressed beneficial and deleterious genes
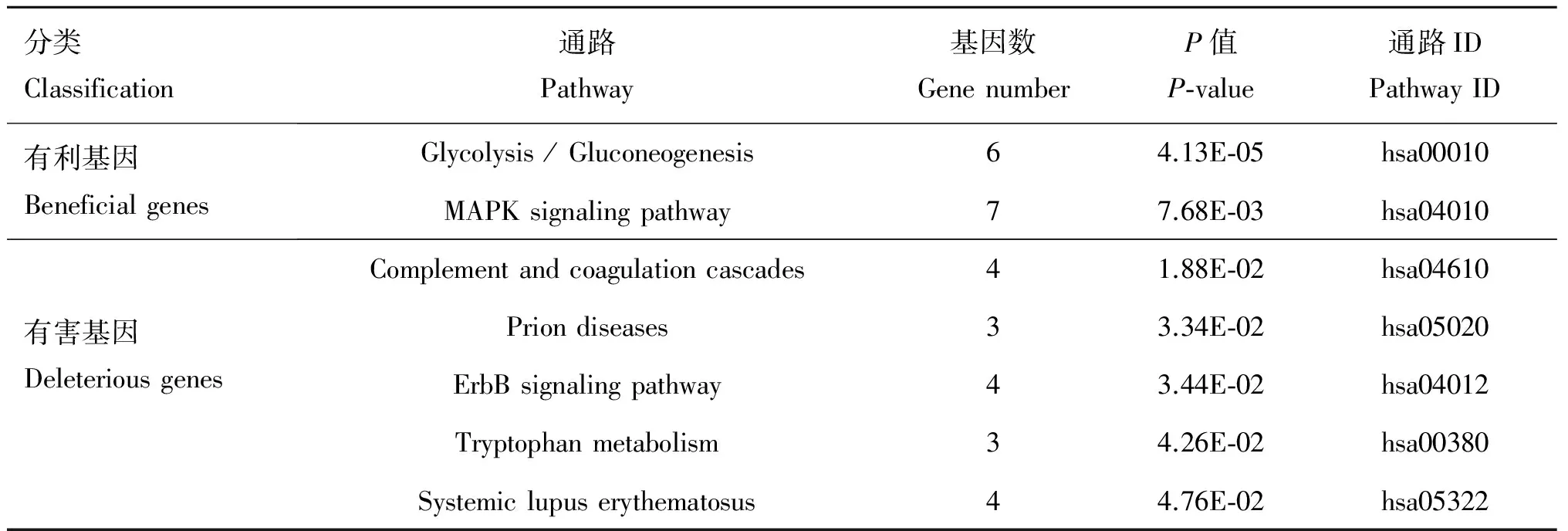
分类Classification通路Pathway基因数GenenumberP值P⁃value通路IDPathwayID有利基因BeneficialgenesGlycolysis/Gluconeogenesis64.13E⁃05hsa00010MAPKsignalingpathway77.68E⁃03hsa04010有害基因DeleteriousgenesComplementandcoagulationcascades41.88E⁃02hsa04610Priondiseases33.34E⁃02hsa05020ErbBsignalingpathway43.44E⁃02hsa04012Tryptophanmetabolism34.26E⁃02hsa00380Systemiclupuserythematosus44.76E⁃02hsa05322
ADIPOQ是脂肪细胞特异性分泌的一种细胞因子,在骨骼肌和脂肪组织中调控生物体的糖代谢、脂肪酸代谢和能量平衡,是迄今为止所发现的惟一与肥胖呈负相关的脂肪细胞特异性蛋白,属于2型糖尿病保护因子,具有增加胰岛素敏感性、抗糖尿病和抗动脉粥样硬化等作用。目前人们对小鼠、人、猪、鸡、牛和山羊的ADIPOQ基因都有研究,但主要集中在猪、家禽和牛等动物的基因和其受体的克隆以及基因多态性分析等方面[18]。戴丽荷等[19]对大白猪、长白猪和梅山猪脂联素基因内含子进行突变检测,发现内含子2中985位的A/G发生突变,在其F2资源家系群体中进行性状关联分析表明,A等位基因有利于增加眼肌面积和瘦肉率,减少背膘厚,同时降低了肌内脂肪含量,肌肉口感变差,最终影响了肉品质。值得注意的是,脂联素是通过调控受体AdipoR1和AdipoR2发挥其重要的生理作用。AdipoR1主要在骨骼肌中表达并介导激活AMPK信号通路;而AdipoR2主要在肝和脂肪组织中表达并介导激活PPARα信号通路,通过诱导FATP(脂肪酸转运蛋白)和CD36(脂肪酸转位酶)的表达进而促进脂肪酸的跨膜转运[20-21]。由此可见,脂联素及其受体对畜禽肉品质具有重要影响。
CD36是参与脂肪酸跨膜转运和脂肪沉积的重要载体蛋白,在脂肪细胞和骨骼肌细胞中参与脂肪酸的运输[22]。束刚等[23]对黄羽肉鸡进行CD36重组融合蛋白免疫,发现首次免疫15 d后便产生较高的抗体效价,而且特异性地抑制公鸡腹脂的沉积水平,说明体内抗CD36抗体能够有效地中和内源性脂肪细胞膜CD36,通过部分阻断转运脂肪酸的功能,从而降低肌内脂肪的沉积。L.Love-Gregory等[24]研究表明,CD36可以促进血浆中游离脂肪酸的吸收,在脂肪组织中参与脂肪酸的贮存。但血浆中高浓度的脂肪酸会产生炎症性反应而影响胰岛素信号使机体产生胰岛素抗性,进而导致机体糖代谢减少,脂肪代谢增加,最终导致脂肪沉积减少。因此,CD36可以作为肉品质研究的一个重要候选基因。
在生物体内,各生物学功能的完成都是基于各个基因间系统地相互协调而进行的,通过对基因进行KEGG通路富集分析,可以更深入地了解该基因的生物学功能以及与其他基因间的相互作用。KEGG通路数据库储存了基因功能的相关信息,通过图形来表示细胞内的生物学过程,例如代谢、膜运输、信号转导和细胞的生长周期等[25]。本研究中高表达有利基因主要参与到糖酵解/糖异生和丝裂原活化蛋白激酶信号通路中,其中糖酵解/糖异生过程不仅与骨骼肌的生长发育和动物机体能量代谢平衡的维持相关,而且与肌内脂肪沉积相关,这一结果可以为肉品质的研究提供一种全新的视角和理论依据。
4 结 论
本研究利用Illumina Miseq高通量测序平台对绒山羊背最长肌的4个转录组进行测序后,结果共获得52 415 590个reads片段,包含了4 717 403 100个核苷酸序列信息,利用DeNovo方法对reads片段进行拼接,共得到65 329个contigs,N50值为1 059 nt。利用CLC Genomics Workbench 6.0软件共筛选到263个与山羊肉品质相关的候选基因,其中包含123个高表达有利基因和140个高表达有害基因。通过David软件分别对高表达有利基因和有害基因进行GO功能注释和KEGG富集分析发现,糖酵解/糖异生过程对于维持动物机体的能量代谢平衡和骨骼肌的生长发育有重要的影响,并且与肌内脂肪沉积相关。结合其他家畜基因组学研究,ADIPOQ、PDK4和CD36可能作为参与肉品质重要的候选基因。高通量RNA-Seq提供了更为全面的山羊背最长肌全转录组信息,为山羊肉品质的改善及功能基因组研究提供了基础数据和参考。
[1] 李洋静,谢恺舟,李拥军,等.海门山羊肉品质特性的研究[J].上海畜牧兽医通讯,2009(6):10-12. LI Y J,XIE K Z,LI Y J,et al.Research of meat quality characteristics in Haimen goat[J].ShanghaiJournalofAnimalHusbandryandVeterinaryMedicine,2009(6):10-12.(in Chinese)
[2] 陈 胜,程广龙,朱德建,等.能量水平及去势对杂交公山羊日增重和胴体组成的影响[J].当代畜牧,2009(10):21-24. CHEN S,CHENG G L,ZHU D J,et al.Effect of energy levels and castrated on daily gain and carcass composition of male goat hybrid[J].ContemporaryAnimalHusbandry,2009(10):21-24.(in Chinese)
[3] 袁亚利,李蛟龙,张卫辉,等.免疫去势和手术去势方法对猪肉中氨基酸肌苷酸和脂肪酸含量的影响[J].肉类研究,2011(6):5-8. YUAN Y L,LI J L,ZHANG W H,et al.A comparison of the effects of two different castration methods on the contents of amino acids,inosine monophosphate and fatty acids in pork[J].MeatReserch,2011(6):5-8.(in Chinese)
[4] 郑中朝,张耀强,张 力,等.波杂肉羊屠宰性能及肉品质研究[J].中国草食动物,2007,27(5):21-24. ZHENG Z C,ZHANG Y Q,ZHANG L,et al.Studies on the slaughter performance and meat quality of Boer crossbred goats[J].ChinaHerbivores,2007,27(5):21-24.(in Chinese)
[5] 王梦霖,雒秋江,杨开伦,等.年龄和性别对陶赛特×小尾寒羊F1代羔羊屠宰性能与肉品质的影响[J].中国畜牧兽医,2009(2):152-155. WANG M L,LUO Q J,YANG K L,et al.Effects of age and sex on slaughter characteristics and meat quality of Poll Dorset × Small Tail Han sheep F1 lamb[J].ChinaAnimalHusbandry&VeterinaryMedicine,2009(2):152-155.(in Chinese)
[6] COSTA V,ANGELINI C,DE F I,et al.Uncovering the complexity of transcriptomes with RNA-Seq[J].JBiomedBiotechnol,2010,2010:1-19.
[7] WANG Z,GERSTEIN M,SNYDER M.RNA-Seq:a revolutionary tool for transcriptomics[J].NatRevGenet,2009,10(1):57-63.
[8] MORTAZAVI A,WILLIAMS B A,MCCUE K,et al.Mapping and quantifying mammalian transcriptomes by RNA-Seq[J].NatMethods,2008,5(7):621-628.
[9] 祁云霞,刘永斌,荣威恒.转录组研究新技术:RNA-Seq及其应用[J].遗传,2011,33(11):1191-1202. QI Y X,LIU Y B,RONG W H.RNA-Seq and its applications:a new technology for transcriptomics[J].Hereditas,2011,33(11):1191-1202.(in Chinese)
[10] 兰道亮,熊显荣,林宝山,等.基于微量RNA高通量测序技术的牦牛MII期卵母细胞转录组研究[J].畜牧兽医学报,2014,45(5):722-732. LAN D L,XIONG X Z,LIN B S,et al.Transcriptome analysis of yak metaphase II (MII) Oocytes by a micro-transcriptome sequencing method[J].ActaVeterinariaetZootechnicaSinica,2014,45(5):722-732.(in Chinese)
[11] ANSORGE W J.Next-generation DNA sequencing techniques[J].NBiotechnol,2009,25(4):195-203.
[12] LIPSON D,RAZ T,KIEU A,et al.Quantification of the yeast transcriptome by single-molecule sequencing[J].NatBiotechnol,2009,27(7):652-658.
[13] 周 华,张 新,刘腾云,等.高通量转录组测序的数据分析与基因发掘[J].江西科学,2012,30(5):607-611. ZHOU H,ZHANG X,LIU T Y,et al.Data processing and gene discovery of high-throughput transcriptome sequencing[J].JiangxiScience,2012,30(5):607-611.(in Chinese)
[14] KADOWAKI T,YAMAUCHI T.Adiponectin receptor signaling:a new layer to the current model[J].CellMetab,2011,13(2):123-124.
[15] BERMUDEZ V J,ROJAS E,TOLEDO A,et al.Single-nucleotide polymorphisms in adiponectin,AdipoR1,and AdipoR2 genes:insulin resistance and type 2 diabetes mellitus candidate genes[J].AmJTherap,2013,20(4):414-421.
[16] FERGUSON J F,PHILLIPS C M,TIERNEY A C,et al.Gene-nutrient interactions in the metabolic syndrome:single nucleotide polymorphisms in ADIPOQ and ADIPOR1 interact with plasma saturated fatty acids to modulate insulin resistance[J].AmJClinNutr,2010,91(3):794-801.
[17] DE JAGER N.gene expression studies in bovine skeletal muscle:investigations into the effects of hormone growth promotant treatment,environment and tenderness genotype associated with tenderness and marbling[D].Queensland:School of Chemistry & Molecular Biosciences,The University of Queensland,2012.
[18] 陈小玲,黄志清.脂联素基因功能的研究进展及其应用[J].湖北农业科学,2012,50(23):4777-4779. CHEN X L,HUANG Z Q.Research advance in function of adiponectin gene and its application[J].HubeiAgriculturalSciences,2012,50(23):4777-4779.(in Chinese)
[19] 戴丽荷,焦青贞,熊远著.猪脂联素基因内含子2的A/G突变检测及关联分析[C].第十次全国畜禽遗传标记研讨会,2006. DAI L H,JIAO Q Z,XIONG Y Z.Detection of A/G polymorphism in porcine adiponectin gene and association analysis with traits[C].Tenth National Symposium on Animal Genetic Markers,2006.(in Chinese)
[20] VAN B A M,GARNIER A,BECKERS P,et al.Functional adiponectin resistance at the level of the skeletal muscle in mild to moderate chronic heart failure[J].Circulation:HeartFailure,2010,3(2):185-194.
[21] YAMAUCHI T,NIO Y,MAKI T,et al.Targeted disruption of AdipoR1 and AdipoR2 causes abrogation of adiponectin binding and metabolic actions[J].NatMed,2007,13(3):332-339.
[22] YU K,SHU G.Fatty acid and transcriptome profiling of longissimus dorsi muscles between pig breeds differing in meat quality[J].IntJBiolSci,2013,9(1):108.
[23] 束 刚,冯嘉颖,余凯凡,等.FAT/CD36融合蛋白的表达及其对鸡腹脂沉积的特异性调控[J].中国农业科学,2009,42(2):650-656. SHU G,FENG J Y,YU K F,et al.Prokaryotic expression of FAT/CD36 fusion protein and the specific effects on the deposition of visceral fat in cockerel chicks[J].ScientiaAgriculturaSinica,2009,42(2):650-656.(in Chinese)
[24] LOVE-GREGORY L,ABUMRAD N A.CD36 genetics and the metabolic complications of obesity[J].CurrOpinClinNutrMetabCare,2011,14(6):527-534.[25] 杜 琛,付绍印,高鸿雁,等.绒山羊肌内脂肪细胞成熟前后比较转录组分析[J].畜牧兽医学报,2014,45(5):714-721. DU C,FU S Y,GAO H Y,et al.Transcriptome analysis of intramuscular preadipocytes and matureadipocyte in cashmere goats[J].ActaVeterinariaetZootechnicaSinica,2014,45(5):714-721.(in Chinese)
(编辑 郭云雁)
RNA-Seq Approach for Identifying Candidate Genes of Meat Quality in Goats
MENG Xian-ran1#,DU Chen2#,WANG Jing1,FU Shao-yin1,ZHENG Zhu-qing1, ZHANG Wen-guang1*,LI Jin-quan1*
(1.KeyLaboratoryofAnimalGenetics,BreedingandReproductionofInnerMongoliaAutonomousRegion,CollegeofAnimalScience,InnerMongoliaAgriculturalUniversity,Hohhot010018,China;2.DepartmentofObstetricsandGynecology,AffiliatedHospitalofInnerMongoliaMedicalUniversity,Hohhot010050,China)
To screen candidate genes which effect on meat quality of cashmere goats,we explored differentially expressed genes oflongissimusdorsiin cashmere goats with different ages and genders.The high-throughput sequencing for transcriptome oflongissimusdorsiin cashmere goats was performed by RNA-Seq.Differentially expressed genes were selected as candidates genes and enriched based on GO and KEGG database after quality control of RNA-Seq.The 263 candidate genes including 123 beneficial and 140 deleterious genes were selected by CLC Genomics Workbench 6.0 software.The results of GO enrichment showed that the highly expressed beneficial genes were primarily related to growth and development of skeletal muscle,organelle formation and protein binding.The highly expressed deleterious genes were primarily related to lipid metabolic process,cytoskeleton and binding.According to the KEGG database,these genes were mainly involved in glycolysis/gluconeogenesis’mitogen-activated protein kinase,complement and coagulation cascades and tryptophan metabolism.As example,ADIPOQ,PDK4 andCD36 might be important candidate genes involved in meat quality,when combining with other livestock genomics study.These results provided theoretical basis for improving meat quality and studying candidate genes in cashmere goats.
cashmere goat;longissimusdorsi;meat quality; RNA-Seq;candidate gene
10.11843/j.issn.0366-6964.2015.08.004
2014-11-10
国家自然科学基金(30960246);内蒙古自然科学基金(2010Zd11);“内蒙古自治区草原英才”与“内蒙古自治区高等学校创新团队发展计划”(NMGIRT1106);国家绒毛用羊现代农业产业技术体系(CARS-40-05)
孟宪然(1988-),男,河北承德人,硕士生,主要从事动物遗传育种与繁殖研究,E-mail:mxr1103@126.com;杜 琛(1986-),女,博士, E-mail:duchen198607@126.com。 孟宪然和杜琛同为第一作者
*通信作者:张文广,E-mail:actgnmbi@aliyun.com.cn;李金泉,E-mail:lijinquan_nd@126.com
S827.2
A
0366-6964(2015)08-1300-08

