禽类干扰素受体介导的抗病毒免疫机制研究进展
周 浩,陈 舜,2,3*,汪铭书,2,3,程安春,2,3
(1.四川农业大学动物医学院预防兽医研究所,成都 611130;2.四川农业大学动物医学院禽病防治与研究中心,雅安 625014;3.四川农业大学动物医学院四川省动物疾病与人类健康研究重点实验室,成都 611130)
禽类干扰素受体介导的抗病毒免疫机制研究进展
周 浩1,陈 舜1,2,3*,汪铭书1,2,3,程安春1,2,3
(1.四川农业大学动物医学院预防兽医研究所,成都 611130;2.四川农业大学动物医学院禽病防治与研究中心,雅安 625014;3.四川农业大学动物医学院四川省动物疾病与人类健康研究重点实验室,成都 611130)
干扰素受体作为一种“分子开关”,参与调控宿主抗病毒免疫状态和细胞免疫因子的表达水平。作为抗病毒信号传导中的重要枢纽,干扰素受体表达水平的高低直接影响着机体抗病毒免疫反应状态。干扰素受体通过介导宿主抵抗外来病原体的信号级联放大效应来增强机体的抗病毒免疫状态。该正反馈调控机制是抗病毒感染中最重要的免疫扩大反应,也是宿主抵御病毒入侵和增殖的核心反应。禽类干扰素受体研究尚处于起步阶段,本文就干扰素受体的结构和分类,抗病毒效应蛋白质,以及禽类干扰素受体介导的抗病毒免疫机制的最新研究进展作一综述。
禽类;干扰素受体;抗病毒免疫;正反馈调节
干扰素(interferon,IFN)是一种广谱抗病毒细胞因子,并不直接杀伤或抑制病毒,要发挥其生物学活性必须先与相应的干扰素受体(interferon receptor,IFNR)发生特异性结合,继而活化细胞内下游的一系列分子信号,通过激活干扰素刺激反应元件从而启动细胞核内特定基因的转录,产生具有抗病毒、抗细菌、抗肿瘤、抗寄生虫等功能的相关免疫蛋白[1]。因此,作为分子开关的干扰素受体在宿主抗病毒免疫反应中发挥着决定性的作用[2]。
相比干扰素的研究,干扰素受体的研究起步较晚,主要原因是干扰素受体结构和功能的复杂性,干扰素受体结合干扰素的后续抗病毒免疫信号通路也尤其复杂。病毒入侵宿主后,机体识别病原并释放抗病毒的效应分子(IFNs),当宿主细胞分泌的IFN不足以抵御新生代病原体的入侵时,早期分泌的IFN经过与其受体识别、结合并激活下游信号,经过旁分泌和自分泌的方式引发进一步释放IFN,该正反馈调节机制增强免疫能力,这也是机体最主要的抗病毒免疫扩大反应。值得注意的是,该正反馈扩大机制正是依赖于细胞膜上干扰素受体的活化。此外,在抗病毒免疫效应的终端阶段中抗病毒效应蛋白(PKR、Mx、OAS)的转录激活也基于干扰素受体偶联的蛋白酪氨酸活化途径。可见,干扰素受体在宿主抗病毒免疫调控中处于重要核心地位。禽类的许多病原(如禽流感病毒)不仅危及禽类养殖业,也对人类健康构成巨大的威胁。研究显示,某些病毒(如传染性法氏囊病毒)感染会引起干扰素受体的激活和上调,提示禽类干扰素受体参与机体的抗病毒免疫反应。迄今,对禽类的基础免疫研究不够系统,且所获得的信息较零散,某些关键因子的功能解析将成为禽类免疫调控机制研究新的切入点。干扰素受体在宿主抗病毒免疫调节中扮演着关键的“角色”。本文对干扰素受体的结构和分类,其参与的信号通路,其介导的正反馈效应机制,以及发挥抗病毒效应的主要抗病毒蛋白(PKR、Mx、OAS)进行归纳与总结,展示禽类干扰素受体的最新研究结果,对进一步理解禽类干扰素与其受体的相互作用及其介导的抗病毒免疫反应,研发更高效的疫苗及疫苗佐剂,研制新型抗病毒制剂等具有重要的实践和理论意义。
1 干扰素受体的结构与分类
干扰素受体(IFNRs)属于Ⅱ型细胞因子受体家族(helical cytokine receptor,class Ⅱ CRF2,也称为Ⅱ型螺旋型细胞因子受体)[3],IFNRs属于细胞表面单跨膜糖蛋白,由信号肽、胞外域、跨膜区和胞内域组成。胞外域是与干扰素相结合的部分,该结构域是一个由200个左右氨基酸组成的保守区域(D200区),每个D200区包含linker相连的两个SD100区。胞内域可以与JAK酶(Janus kinase)发生相互作用并诱导JAK酶的活化,JAK酶会进一步促进STAT家族(signal transducers and activators of transcription)的活化,最终启动细胞核内反应元件,诱导抗病毒蛋白的转录和表达。研究表明,鸟类干扰素受体也有着和哺乳动物相似的结构和功能,禽类干扰素受体蛋白具有相似的结构域,包括低复杂度区域、纤维连接蛋白区域和单个跨膜区域[4]。目前,鸡的干扰素受体不同亚基已被分析和鉴定[5-7],随着鸭的全基因组序列的公布,鸭干扰素受体预测序列也在公共数据库得到了一些注释。
1.1 Ⅰ型干扰素受体
Ⅰ型干扰素受体(IFNAR)由α和β两个亚基组成,分别表示为IFNAR1、IFNAR2[8],在信号传导路径中,蛋白酪氨酸激酶中的TYK2和JAK1分别与之相互作用,并且相关研究表明 IFNAR2对干扰素的亲和力较高[9]。Ⅰ型干扰素受体在单核细胞、T细胞、B细胞、血小板、巨噬细胞、上皮细胞以及内皮细胞等都有分布[10-12]。值得一提的是,人IFNAR2具有跨膜和可溶两种形式[8,13],还包括三种不同的可选择剪接形式[14-16]:一种是长度为515氨基酸残基的长型跨膜受体;另一种是含有311个氨基酸的短型跨膜受体,其特点表现为截短的细胞内结构域;第三种是可溶性受体。鸡的IFNAR1和IFNAR2的编码基因登录号分别为AF082664、AF082665。生物信息数据库里还存在多种其他鸟类的预测序列,例如鸽、白领姬鹟、斑胸草雀、虎皮鹦鹉等,还存在一些鸟类的不完整编码序列,例如鸭。目前还没有报道揭示禽类IFNAR是否也存在不同剪切形式。
1.2 Ⅱ型干扰素受体
Ⅱ型干扰素受体(IFN-γR)可分为配体吸附链和附属链,分别表示为IFNGR1、IFNGR2[12],Ⅱ型干扰素绑定到相应受体后,即可激活蛋白酪氨酸激酶JAK1、JAK2,进而引起信号传导[16]。鸡的IFNGR1的序列号为EU057149,Northern blot分析发现,鸡的IFNGR1主要高表达于脾、胸腺、外周血淋巴细胞、肺、扁桃体、肝等组织[7]。鸡IFNGR2序列号为AY957508,圆二色谱法显示鸡IFNGR2胞外区的二级结构包括α-螺旋(19.8%)、β-折叠(29.6%)、β-转角(19.7%)、无规则卷曲(30.9%)[6]。鸡IFNGR2与IFNGR1表达规律有所相似,在脾、胸腺、扁桃体等免疫相关组织也呈现高表达的现象[6]。另外,公共数据库也有麻雀、斑胸草雀、鸽、游隼等鸟类Ⅱ型干扰素受体的预测序列,这些鸟类实际序列的克隆和其功能值得进一步研究。
1.3 Ⅲ型干扰素受体
Ⅲ型干扰素受体分为两个亚基IFNLR1(也称IL-28Rα)和IL-10R2(也称IL-10Rβ)[17],两个亚基分别与JAK1和TYK2相互作用进行信号传递,从而激活下游细胞因子。Ⅲ型干扰素受体是一种异源二聚体,IFNLR1最长的一种剪接形式具有520个氨基酸[18-19],该受体可能决定与配体结合的专一性,因此,在细胞外信号分子的募集过程中具有重要作用。IL-10R2蛋白较为保守,其主要配体包括IFN-λ、IL-10、IL-22、IL-26等细胞因子[12,20]。比较基因组方法分析结果显示,IL-10 受体基因(IL-10R2)与IFNAR1、IFNAR2、IFNGR2基因在鸡的1号染色体上一致串联排布[5]。这几种受体蛋白是否会互相影响值得进一步研究。
2 干扰素受体介导的细胞信号传导
鸟类作为多种病毒的携带者与中间传播媒介,在许多病原的传播、演变与进化中都起着重要作用,所以鸟类干扰素受体参与的抗病毒免疫机制值得探讨。干扰素信号通路尤为复杂,其中干扰素受体在信号传导过程中起着中间枢纽以及分子开关的作用。首先,各型干扰素在细胞表面有相应的受体亚基与其特异性识别与结合[21];此外,不同亚型的干扰素都使用JAK-STAT信号传导系统活化下游的信号分子[22]。干扰素与其受体的相互作用引起JAKs磷酸化作用,活化的JAKs会磷酸化STAT蛋白羧基端的酪氨酸残基。最后,STATs会形成同源二聚体或异源二聚体移位到细胞核内,启动干扰素基因的转录和表达[23]。
2.1 Ⅰ型IFNR
IFNR的胞外域与Ⅰ型IFN结合后启动细胞内酪氨酸激酶(JAK1和TYK2)的磷酸化,并导致STAT1和STAT2的酪氨酸磷酸化,磷酸化的STATs形成异源二聚体或同源二聚体,然后STATs与IRF9形成三聚体复合物,该复合物会移位至细胞核内,与干扰素刺激应答元件区域相结合,进而激活效应蛋白的转录[24]。另一方面,STAT1同源二聚体也可以激活处于调控区域的特殊IFNγ反应元件(gamma activation sequence,GAS),调控基因的转录。研究表明,禽类的JAK-STAT系统在细胞传导过程中是非常保守和活跃的[25-27]。但是,禽类中是否具有特异的关键分子,以及分子之间如何相互作用需要进一步研究。
2.2 Ⅱ型IFNR
首先IFNGR1先形成同源二聚体,INF-γ再与高亲和力的INFGR1二聚体结合形成有活性的异源二聚体,最后与亚基INFGR2相互作用形成稳定的三元复合体,从而启动信号转导[28]。受体相关的蛋白酪氨酸激酶JAK1和JAK2会活化STAT1,STAT1以同源二聚体形式结合到IFNγ反应序列元件并激活GAS使其转录[28]。IFN-γ受体复合体的形成对于解析其他Ⅱ型细胞因子受体的信号转导提供了模型参考。虽然鸡Ⅱ型干扰素受体(IFNGR1和IFNGR2)的部分结构已经被阐述,但是鸡Ⅱ型干扰素受体与其他分子作用机制还没有得到进一步阐释,其介导抗病毒信号通路的关键分子也还没有确定。
2.3 Ⅲ型IFNR
Ⅲ型干扰素也是通过结合IFNLR1和IL-10R2实现信号通路的激活[29],进而活化JAK1和TYK2,使得STAT1和STAT2磷酸化[30]。但是,此过程可能会涉及其他类型的STATs的参与,如STAT3、STAT4、STAT5等信号转录与激活因子[31]。禽类Ⅲ型干扰素及其受体研究进展缓慢,所以对该型的干扰素受体参与介导的信号关键分子及其抗病毒机制有待进一步的研究与阐述。
3 干扰素受体介导的抗病毒正反馈放大效应
当宿主细胞分泌的IFN不足以抵御病原体的入侵时,机体分泌的IFN-α/β经过与IFNAR1和IFNAR2受体识别、结合并激活下游信号,经过旁分泌和自分泌的方式引发IFN的正反馈调节机制,进一步增强Ⅰ型IFN的释放[32](图1)。同时,病毒感染诱导宿主产生的IFN-α/β将与其受体结合,进一步将诱导上百种的ISGs(IFN-stimulated genes)表达(如PKR、Mx、OAS等)(图1),这些抗病毒蛋白质以不同方式来干扰病毒增殖与感染(抑制病毒核酸复制,抑制病毒蛋白质合成等),从而增强机体的抗病毒免疫状态。细胞表面干扰素受体水平将直接影响干扰素反应的强度和持久度,所以干扰素受体在宿主抗病毒免疫正反馈调控机制中发挥着关键的“开关”作用。虽然该正反馈机制尚未在禽类细胞免疫系统中证实,但有研究表明,鸡胚成纤维细胞感染H5N1高致病性禽流感病毒后,IFN-α和IFN-γ有显著性上调,并且信号通路的下游PKR、OAS、Mx蛋白均明显上调,表现出与干扰素一致上调的规律[33]。同时,研究显示鸡胚细胞在感染传染性法氏囊病毒后,干扰素受体IFNAR1和抗病毒效应蛋白OAS转录水平都有明显上调[34],可能预示着禽类抗病毒免疫放大机制。此外,不同亚型的Ⅰ型干扰素处理鸡胚成纤维细胞后,诱导产生了更多的干扰素,且IFN-β激发和诱导干扰素再生的效应强于IFN-α[35],这就进一步说明禽类可借助自身的正反馈调节机制,利用初始的低水平干扰素即可激活诱导更高水平的干扰素。
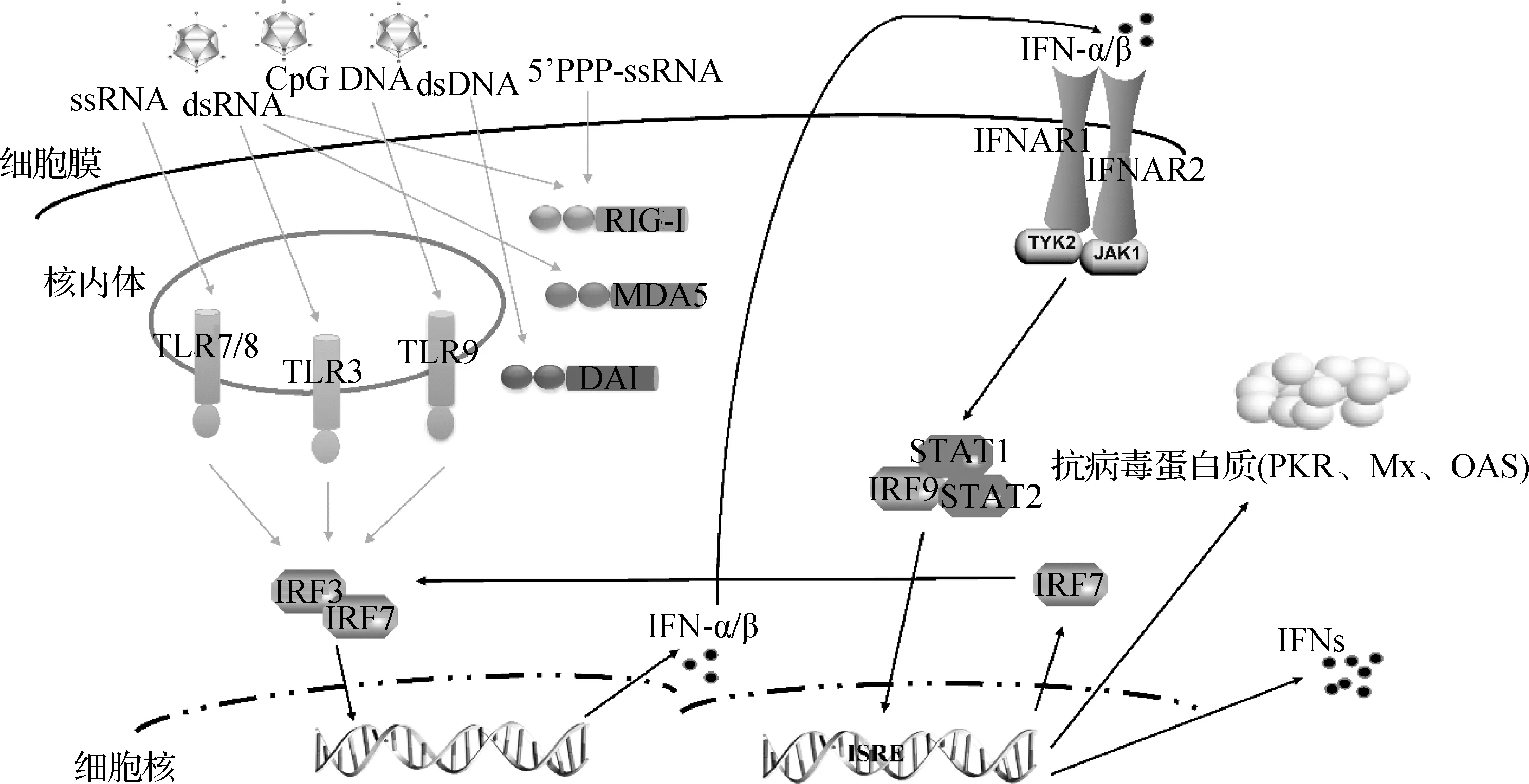
图1 干扰素受体介导的抗病毒正反馈放大效应机制模式Fig.1 The signal modle of interferon receptor mediated antiviral positive feedback mechanism
4 干扰素受体介导的抗病毒蛋白质
IFN发挥胞内活性主要是通过与细胞表面IFNR结合,启动一系列信号传导的级联反应,从而诱导ISGs的表达[36-37]。不同的AVPs (antiviral proteins)通过限制病毒感染宿主的不同阶段来抵御病毒的攻击,多种不同的抗病毒效应可联合作用进而加强对病毒的抑制与清除。正反馈机制中的抗病毒相关蛋白的激活和产生都离不开干扰素受体的参与和调节。一些ISGs编码具有高效抗病毒活性潜能的蛋白质[38],目前研究较为深入的蛋白质有蛋白激酶R(protein kinase protein,PKR)、Mx蛋白(myxovirus resistance)、2′,5′寡腺苷酸合成酶(2′,5′-oligoadenylate synthetase,OAS)等[39-42]。
4.1 PKR
PKR是IFN-IFNR通路诱导的依赖于dsRNA的蛋白激酶。PKR属于蛋白激酶的一个小家族,可以调节蛋白质合成[43]。PKR蛋白有两个不同功能的结构域,分别是N端的调节结构域(结合dsRNA)和C端的催化结构域(含有激酶亚结构域)。正常生理条件下,PKR组成性表达于所有组织,该蛋白质会在干扰素的表达下被激活。此蛋白激酶一旦被活化,即可进一步磷酸化真核翻译起始因子2A(translation initiation factor 2-α,eIF2-α)。eIF2-α的磷酸化将通过抑制病毒信使RNA的翻译[44],进而发挥抗病毒感染免疫效应。PKR对病毒蛋白质的抑制作用使得其可以参与抵御多种DNA和RNA病毒的防御反应[45]。禽类PKR与哺乳类PKR序列相似度不高,却有类似的抗病毒功能。研究发现,鸡PKR蛋白与人PKR氨基酸序列相似性为35%,但是经免疫刺激剂polyI:C激活诱导的鸡PKR同样能抑制水泡口炎病毒(vesicular stomatitis virus,VSV)的感染[46]。同时,PKR对同一类病毒的不同毒株的抗病毒效力也有所差异。研究表明,鸡PKR不能有效地抵御高致病性病毒的攻击(如H5N1禽流感病毒)[47]。而当鸡感染低致病性病毒(如H9N2禽流感病毒)时,作为宿主抗病毒免疫反应蛋白的PKR显著上调[48],可以起到一定的保护作用。此外,PKR还参与代谢活动、细胞分化、细胞凋亡、细胞扩散等各种细胞调控进程[42,49-50]。由于禽类PKR蛋白报道研究较少,禽类PKR蛋白抗病毒功能的分子机制亟待进一步解析。
4.2 Mx蛋白
Mx蛋白包含N端GTP酶结构域、中心相互作用结构域和C端亮氨酸链结构域[51]。Mx蛋白的主要病毒识别靶点可能是病毒的核壳体样结构。同时,Mx蛋白可以监视胞外分泌过程,介导囊泡的转运而捕获病毒必需成分,从而阻断病毒的早期复制。研究发现,人的Mx蛋白具有两个亚型MxA和MxB,部分报道显示只有MxA蛋白具有抗病毒活性[52-53]。然而,鸡Mx蛋白在少数的研究报道中却是不具有生物学活性的[54-55]。也有研究表明,鸡的Mx蛋白存在单核苷酸多态性,其中第631位多态性位点决定了鸡Mx抗病毒活性[56]。鸡和鸭的该蛋白质在抵御流感病毒效应上具有明显差异,提示可能该蛋白质具有物种特异性。通过对鸡Mx蛋白的研究发现,鸡Mx蛋白具有一定程度的抑制流感病毒和水泡性口炎病毒的作用[57]。然而,鸭Mx蛋白却不能发挥抑制流感病毒的作用[58]。所以,对于同一种类型的流感病毒,鸡和鸭表现出了明显的差异,一些抗病毒蛋白质具有种属差异性,这也许是很多水禽(例如鹅)可以携带很多人兽共患病病原的原因。目前,由于不同的报道显示该蛋白质的抗病毒效应有所争议,推测的原因可能是不同品系的家禽在病毒感染时会产生特异的Mx蛋白,其抗病毒活性表现出一定的差异,因而对不同病毒的抑制效应也可能有所差异。
4.3 OAS
2′-5′寡聚腺苷合成酶(OAS)活化后可合成2′-5′连接的磷酸二酯键,这种独特的寡聚体特异性激活非活化形式的内核糖核酸酶(RNaseL),然后降解细胞和病毒RNA,进而抑制蛋白质合成和病毒复制[59]。细胞中的OAS蛋白可作为一类新的模式识别受体来监测细胞质中病毒双链RNA,同时被RNaseL降解的RNA还能够激活细胞质中的RIG-1和MDA5[60],从而可以进一步增强宿主的抗病毒免疫反应[61]。鸡OAS基因存在两个等位基因:OAS-A(58 ku)和OAS-B(54 ku)[62-64],它们都具有合成2′-5′寡聚腺苷酸的活性[62]。鸡的OAS的羧基端具有泛素样结构域,该结构域对OAS蛋白结构的稳定性具有重要作用[65]。研究发现,鸡OAS蛋白可以抑制西尼罗河病毒的复制[66]。鹅的OAS蛋白可能参与其抗流感病毒免疫分子机制。当鹅感染流感病毒之后,其肺部组织OAS和PKR的转录水平都明显上调[67]。同时,鹅在抵御流感病毒入侵时,OAS和PKR可能会发挥一种协同作用,共同增强宿主的抗病毒效应。研究发现,不同亚型的干扰素诱导的OAS蛋白水平也具有差异,鸡IFN-β和鸡IFN-α虽然使用相同的Ⅰ型干扰素受体(IFNAR1、IFNAR2),但鸡IFN-α诱导OAS的能力明显强于IFN-β[35]。所以,同一类抗病毒蛋白质的产生依然会依赖于不同亚型的IFN,最终产生抗病毒效应的差异可能是由于干扰素受体亚基的不同,也可能是干扰素受体亚基诱导的接头蛋白类型和水平存在差异。
5 结 语
干扰素作为一种重要免疫调控因子,具有抗病毒、抗细菌、抗肿瘤、抗寄生虫等免疫功能。如果宿主缺少相应的不同亚型的干扰素受体,干扰素几乎无法启动宿主抗病毒效应。禽类各亚型干扰素受体的结构具有一定保守性,具有相似的单个跨膜区域、纤维连结蛋白区域等。哺乳动物已发现IFNAR2亚型受体具有不同的剪切拼接形式,但是禽类该受体甚至其他亚型是否也存在不同形式的剪切拼接体并未揭晓。此外,各亚型干扰素受体介导的信号传递通路也具有一定的交叉性,各类型的干扰素都是依赖于细胞膜上特异受体的绑定并激活偶联激酶从而产生强大的抗病毒效应,禽类的JAK-STAT信号传导系统在免疫反应过程中是非常保守和活跃的。宿主抗病毒放大效应依赖于干扰素受体这一重要“开关”。因此,干扰素受体的表达水平可能会影响机体的抗病毒效应。禽类作为携带多种病毒的中间宿主,其干扰素受体调控的抗病毒正反馈免疫效应机制也未并证实。禽类抗病毒蛋白质(例如PKR蛋白)对不同病毒(禽流感病毒和水泡性口炎病毒)的抗病毒效应也有所差异,且对于同一种类型的流感病毒,不同宿主(鸡和鸭)表现出了明显的差异,这也许解释了水禽(例如鸭与鹅)作为许多病原的储存与携带者的原因,为人兽共患病的防治提供了新的参考依据。值得关注的是,功能显著的效应蛋白质也有望被开发成可运用到生产实际中的抗病毒生物制剂。虽然,禽类干扰素与其受体互作机制仍有不少空白,但关于禽类干扰素受体的基础研究将促进干扰素受体介导的抗病毒免疫分子机制研究的发展,也将为禽病毒病的防治提供科学依据。
[1] SAMUEL C E.Antiviral actions of interferons[J].ClinMicrobiolRev,2001,14(4):778-809.
[2] DE WEERD N A,NGUYEN T.The interferons and their receptors-distribution and regulation[J].ImmunolCellBiol,2012,90(5):483-491.
[3] KRAUSE C D,PESTKA S.Evolution of the Class 2 cytokines and receptors,and discovery of new friends and relatives[J].PharmacolTher,2005,106(3):299-346.
[4] ZHOU H,CHEN S,WANG M,et al.Interferons and their receptors in birds:a comparison of gene structure,phylogenetic analysis,and cross modulation[J].IntJMolSci,2014,15(11):21045-21068.
[5] REBOUL J,GARDINER K,MONNERON D,et al.Comparative genomic analysis of the interferon/interleukin-10 receptor gene cluster[J].GenomeRes,1999,9(3):242-250.
[6] HAN C L,ZHANG W,DONG H T,et al.A novel gene of beta chain of the IFN-gamma receptor of Huiyang chicken:cloning,distribution,and CD assay[J].JInterferonCytokineRes,2006,26(7):441-448.
[7] HAN X,CHEN T,WANG M.Molecular cloning and characterization of chicken interferon-gamma receptor alpha-chain[J].JInterferonCytokineRes,2008,28(7):445-454.
[8] DE WEERD N A,SAMARAJIWA S A,HERTZOG P J.Type I interferon receptors:biochemistry and biological functions[J].JBiolChem,2007,282(28):20053-20057.
[9] LAMKEN P,LATA S,GAVUTIS M,et al.Ligand-induced assembling of the type I interferon receptor on supported lipid bilayers[J].JMolBiol,2004,341(1):303-318.
[10] NOVICK D,COHEN B,RUBINSTEIN M.Soluble interferon-alpha receptor molecules are present in body fluids[J].FEBSLett,1992,314(3):445-448.
[11] HARDY M P,OWCZAREK C M,TRAJANOVSKA S,et al.The soluble murine type I interferon receptor Ifnar-2 is present in serum,is independently regulated,and has both agonistic and antagonistic properties[J].Blood,2001,97(2):473-482.
[12] LANGER J A,CUTRONE E C,KOTENKO S.The Class II cytokine receptor (CRF2) family:overview and patterns of receptor-ligand interactions[J].CytokineGrowthFactorRev,2004,15(1):33-48.
[13] PREJEAN C,COLAMONICI O R.Role of the cytoplasmic domains of the type I interferon receptor subunits in signaling[J].SeminCancerBiol,2000,10(2):83-92.
[14] DOMANSKI P,COLAMONICI O R.The type-I interferon receptor.The long and short of it[J].CytokineGrowthFactorRev,1996,7(2):143-151.
[15] KOTENKO S V,IZOTOVA L S,MIROCHNITCHENKO O V,et al.The intracellular domain of interferon-alpha receptor 2c (IFN-alphaR2c) chain is responsible for Stat activation[J].ProcNatlAcadSciUSA,1999,96(9):5007-5012.
[16] ORITANI K,KINCADE P W,ZHANG C,et al.Type I interferons and limitin:a comparison of structures,receptors,and functions[J].CytokineGrowthFactorRev,2001,12(4):337-348.
[17] YANG L,LUO Y,WEI J,et al.Integrative genomic analyses on IL28RA,the common receptor of interferon-lambda1,-lambda2 and -lambda3[J].IntJMolMed,2010,25(5):807-812.
[18] KOTENKO S V,GALLAGHER G,BAURIN V V,et al.IFN-lambdas mediate antiviral protection through a distinct class II cytokine receptor complex[J].NatImmunol,2003,4(1):69-77.
[19] SHEPPARD P,KINDSVOGEL W,XU W,et al.IL-28,IL-29 and their class II cytokine receptor IL-28R[J].NatImmunol,2003,4(1):63-68.
[20] DONNELLY R P,SHEIKH F,KOTENKO S V,et al.The expanded family of class II cytokines that share the IL-10 receptor-2 (IL-10R2) chain[J].JLeukocBiol,2004,76(2):314-321.
[21] GOOSSENS K E,WARD A C,LOWENTHAL J W,et al.Chicken interferons,their receptors and interferon-stimulated genes[J].DevCompImmunol,2013,41(3):370-376.
[22] SHUAI K,LIU B.Regulation of JAK-STAT signalling in the immune system[J].NatRevImmunol,2003,3(11):900-911.
[23] STARK G R,DARNELL J E Jr.The JAK-STAT pathway at twenty[J].Immunity,2012,36(4):503-514.
[24] PLATANIAS L C.Mechanisms of type-I- and type-II-interferon-mediated signalling[J].NatRevImmunol,2005,5(5):375-386.
[25] JUNGWIRTH C,REBBERT M,OZATO K,et al.Chicken interferon consensus sequence-binding protein (ICSBP) and interferon regulatory factor (IRF) 1 genes reveal evolutionary conservation in the IRF gene family[J].ProcNatlAcadSciUSA,1995,92(8):3105-3109.
[26] SOFER L,KAMPA D,BURNSIDE J.Molecular cloning of a chicken JAK homolog from activated T cells[J].Gene,1998,215(1):29-36.
[27] ADACHI H,TAKEMOTO Y,BUNGO T,et al.Chicken leptin receptor is functional in activating JAK-STATpathwayinvitro[J].JEndocrinol,2008,197(2):335-342.
[28] BACH E A,AGUET M,SCHREIBER R D.The IFN gamma receptor:a paradigm for cytokine receptor signaling[J].AnnuRevImmunol,1997,15:563-591.
[29] UZÉ G,MONNERON D.IL-28 and IL-29:newcomers to the interferon family[J].Biochimie,2007,89(6-7):729-734.
[30] WITTE K,WITTE E,SABAT R,et al.IL-28A,IL-28B,and IL-29:promising cytokines with type I interferon-like properties[J].CytokineGrowthFactorRev,2010,21(4):237-251.
[31] HORVATH C M.STAT proteins and transcriptional responses to extracellular signals[J].TrendsBiochemSci,2000,25(10):496-502.
[32] HONDA K,TAKAOKA A,TANIGUCHI T.Type I interferon gene induction by the interferon regulatory factor family of transcription factors[J].Immunity,2006,25(3):349-360.
[33] WEI L,CUI J,SONG Y,et al.Duck MDA5 functions in innate immunity against H5N1 highly pathogenic avian influenza virus infections[J].VetRes,2014,45:66.
[34] LI Y P,HANDBERG K J,JUUL-MADSEN H R,et al.Transcriptional profiles of chicken embryo cell cultures following infection with infectious bursal disease virus[J].ArchVirol,2007,152(3):463-478.
[35] QU H,YANG L,MENG S,et al.The differential antiviral activities of chicken interferon α (ChIFN-α) and ChIFN-β are related to distinct interferon-stimulated gene expression[J].PLoSOne,2013,8(3):e59307.
[36] SEN G C,SARKAR S N.The interferon-stimulated genes:targets of direct signaling by interferons,double-stranded RNA,and viruses[J].CurrTopMicrobiolImmunol,2007,316:233-250.
[37] SCHOGGINS J W,WILSON S J,PANIS M,et al.A diverse range of gene products are effectors of the type I interferon antiviral response[J].Nature,2011,472(7344):481-485.
[38] BORDEN E C,WILLIAMS B R.Interferon-stimulated genes and their protein products:what and how?[J].JInterferonCytokineRes,2011,31(1):1-4.
[40] HALLER O,STAEHELI P,KOCHS G.Interferon-induced Mx proteins in antiviral host defense[J].Biochimie,2007,89(6-7):812-818.
[41] HALLER O,STERTZ S,KOCHS G.The Mx GTPase family of interferon-induced antiviral proteins[J].MicrobesInfect,2007,9(14-15):1636-1643.
[42] SADLER A J,WILLIAMS B R.Structure and function of the protein kinase R[J].CurrTopMicrobiolImmunol,2007,316:253-292.
[43] PINDEL A,SADLER A.The role of protein kinase R in the interferon response[J].JInterferonCytokineRes,2011,31(1):59-70.
[44] WILLIAMS B R.PKR;a sentinel kinase for cellular stress[J].Oncogene,1999,18(45):6112-6120.
[45] BALACHANDRAN S,ROBERTS P C,BROWN L E,et al.Essential role for the dsRNA-dependent protein kinase PKR in innate immunity to viral infection[J].Immunity,2000,13(1):129-141.
[46] KO J H,ASANO A,KON Y,et al.Characterization of the chicken PKR:polymorphism of the gene and antiviral activity against vesicular stomatitis virus[J].JpnJVetRes,2004,51(3-4):123-133.
[47] DAVIET S,VAN BORM S,HABYARIMANA A,et al.Induction of Mx and PKR failed to protect chickens from H5N1 infection[J].ViralImmunol,2009,22(6):467-472.
[48] REEMERS S S,VAN HAARLEM D A,GROOT KOERKAMP M J,et al.Differential gene-expression and host-response profiles against avian influenza virus within the chicken lung due to anatomy and airflow[J].JGenVirol,2009,90(Pt 9):2134-2146.
[49] NAKAMURA T,FURUHASHI M,LI P,et al.Double-stranded RNA-dependent protein kinase links pathogen sensing with stress and metabolic homeostasis[J].Cell,2010,140(3):338-348.
[50] NALLAGATLA S R,TORONEY R,BEVILACQUA P C.Regulation of innate immunity through RNA structure and the protein kinase PKR[J].CurrOpinStructBiol,2011,21(1):119-127.
[51] HALLER O,KOCHS G.Human MxA protein:an interferon-induced dynamin-like GTPase with broad antiviral activity[J].JInterferonCytokineRes,2011,31(1):79-87.
[53] PAVLOVIC J,ZÜRCHER T,HALLER O,et al.Resistance to influenza virus and vesicular stomatitis virus conferred by expression of human MxA protein[J].JVirol,1990,64(7):3370-3375.
[54] BERNASCONI D,SCHULTZ U,STAEHELI P.The interferon-induced Mx protein of chickens lacks antiviral activity[J].JInterferonCytokineRes,1995,15(1):47-53.
[55] ZIMMERMANN P,MNZ B,HALLER O,et al.The viral nucleoprotein determines Mx sensitivity of influenza A viruses[J].JVirol,2011,85(16):8133-8140.
[56] BENFIELD C T,LYALL J W,KOCHS G,et al.Asparagine 631 variants of the chicken Mx protein do not inhibit influenza virus replication in primary chicken embryo fibroblasts orinvitrosurrogate assays[J].JVirol,2008,82(15):7533-7539.
[57] KO J H,JIN H K,ASANO A,et al.Polymorphisms and the differential antiviral activity of the chicken Mx gene[J].GenomeRes,2002,12(4):595-601.
[58] BAZZIGHER L,SCHWARZ A,STAEHELI P.No enhanced influenza virus resistance of murine and avian cells expressing cloned duck Mx protein[J].Virology,1993,195(1):100-112.
[59] SILVERMAN R H.Viral encounters with 2′,5′-oligoadenylate synthetase and RNase L during the interferon antiviral response[J].JVirol,2007,81(23):12720-12729.
[60] KAWAI T,TAKAHASHI K,SATO S,et al.IPS-1,an adaptor triggering RIG-I- and Mda5-mediated type I interferon induction[J].NatImmunol,2005,6(10):981-988.
[61] MALATHI K,DONG B,GALE M Jr,et al.Small self-RNA generated by RNase L amplifies antiviral innate immunity[J].Nature,2007,448(7155):816-819.
[62] YAMAMOTO A,IWATA A,KOH Y,et al.Two types of chicken 2′,5′-oligoadenylate synthetase mRNA derived from alleles at a single locus[J].BiochimBiophysActa,1998,1395(2):181-191.
[63] TATSUMI R,HAMADA K,SEKIYA S,et al.2′,5′-oligoadenylate synthetase gene in chicken:gene structure,distribution of alleles and their expression[J].BiochimBiophysActa,2000,1494(3):263-268.
[64] PERELYGIN A A,ZHARKIKH A A,SCHERBIK S V,et al.The mammalian 2′-5′ oligoadenylate synthetase gene family:evidence for concerted evolution of paralogous Oas1 genes in Rodentia and Artiodactyla[J].JMolEvol,2006,63(4):562-576.
[65] TATSUMI R,SEKIYA S,NAKANISHI R,et al.Function of ubiquitin-like domain of chicken 2′-5′-oligoadenylate synthetase in conformational stability[J].JInterferonCytokineRes,2003,23(11):667-676.
[66] TAG-EL-DIN-HASSAN H T,SASAKI N,MORITOH K,et al.The chicken 2′-5′ oligoadenylate synthetase A inhibits the replication of West Nile virus[J].JpnJVetRes,2012,60(2-3):95-103.
[67] WEI L,JIAO P,YUAN R,et al.Goose Toll-like receptor 7 (TLR7),myeloid differentiation factor 88 (MyD88) and antiviral molecules involved in anti-H5N1 highly pathogenic avian influenza virus response[J].VetImmunolImmunopathol,2013,153(1-2):99-106.
(编辑 白永平)
The Research Progress of Interferon Receptors Mediated Antiviral Immune Mechanism in Avian
ZHOU Hao1,CHEN Shun1,2,3*,WANG Ming-shu1,2,3,CHENG An-chun1,2,3
(1.InstituteofPreventiveVeterinaryMedicine,SichuanAgriculturalUniversity,Chengdu611130,China; 2.AvianDiseaseResearchCenter,CollegeofVeterinaryMedicineofSichuanAgriculturalUniversity,Ya’an625014,China;3.KeyLaboratoryofAnimalDiseaseandHumanHealthofSichuanProvince,SichuanAgriculturalUniversity,Chengdu611130,China)
Interferon receptor is a key molecular switch in regulation of host antiviral immune state and expression level of cellular immune cytokines.As an important hub in antiviral signal transduction,the expression level of interferon receptor directly affects the antiviral immune response system in host.To enhance the antiviral immune response of host against the foreign pathogens,the effect of interferon antiviral signaling cascade will be magnified through interferon receptor upon infection.This positive feedback mechanism is the most important immune amplification effect during antiviral immune response,which is also the core response of host to defend viral invasion and proliferation.Research of avian interferon receptors has still been in its infancy,in this paper,a summary has been conducted on the latest research advance in structure and classification of interferon receptor,downstream antiviral proteins,as well as avian interferon receptor-mediated antiviral immune mechanisms.
avian;interferon receptors;antiviral immune;positive-feedback regulation
10.11843/j.issn.0366-6964.2015.08.001
2014-10-30
国家自然科学基金(31201891);四川省科技厅青年基金(2012JQ0040);四川省教育厅重点项目(12ZA107);教育部高等学校博士学科点专项科研基金(20125103120012);水禽疫病防控四川省青年科技创新研究团队(2013TD0015)
周 浩(1991-),男,四川新都人,硕士,主要从事分子免疫学研究,E-mail:1913720425@qq.com
*通信作者:陈 舜,女,博士,副研究员,主要从事禽类分子免疫学研究,E-mail:sophia_cs@163.com
S852.4
A
0366-6964(2015)08-1273-08

