地构叶和广东地构叶基因组大小测定
张雪娟 周知里 朱仁斌 巨苗苗 何承忠 田 斌,3
(1.西南林业大学国家林业局西南生物多样性保育重点实验室,云南 昆明 650224;2.西北农林科技大学资源环境学院,陕西 杨凌 712100;3.中国科学院昆明植物研究所,云南 昆明 650201)
地构叶和广东地构叶基因组大小测定
张雪娟1周知里1朱仁斌2巨苗苗1何承忠1田 斌1,3
(1.西南林业大学国家林业局西南生物多样性保育重点实验室,云南 昆明 650224;2.西北农林科技大学资源环境学院,陕西 杨凌 712100;3.中国科学院昆明植物研究所,云南 昆明 650201)
以水稻为外标,采用流式细胞仪测定2种地构叶属植物地构叶和广东地构叶的基因组大小。结果表明:地构叶的基因组大小(2C DNA含量)平均为(0.81±0.02)pg,广东地构叶的基因组大小(2C DNA含量)平均为(0.85±0.02) pg。
地构叶属;地构叶;广东地构叶;基因组大小;流式细胞仪
地构叶属(Speranskia)隶属于大戟科铁苋菜亚科,为我国特有属,仅包含2个植物种。其中地构叶(S.tuberculata),又名瘤果地构叶、珍珠透骨草等,广泛分布于我国的北方地区,如东北、华北和西北地区东部。广东地构叶(S.cantonensis)又名华南地构叶、蛋不老等,广泛分布于秦岭淮河以南,南岭以北的亚热带地区,如安徽、四川、江西、湖南等省[1]。该属植物被应用在多种中药配方中,是一种重要的民间药用植物,主治风湿痹痛、疔疮肿痛、跌打损伤。
作为重要的药用资源植物,目前对地构叶属的研究主要集中在植物化学成分的提取与天然产物以及药理活性的研究等方面。范云柏等[2]首次从地构叶的地上部分提取出软脂酸、香草酸和阿魏酸等化学物质;李艳梅等[3]从地构叶中提取出了地构苷、香叶素以及多种黄酮类化合物;高海翔等[4]对地构叶的挥发油成分进行了进一步的分析。王璇等[5]比较了5种中药名为“透骨草”植物的抗炎和镇痛活性,并进行了急性毒性实验,其中尤以地构叶和角蒿最安全。然而,涉及地构叶属植物基本生物学特性尤其是遗传背景的研究甚少。
基因组大小(C值)是指单倍体细胞核中所含的DNA总量,也是生物基因组多样性非常重要的基本参数[6]。确定物种基因组大小是物种今后的基因组资源利用以及遗传改良的基础。一般以质量计算,其单位为皮克(pg)或是以核苷酸碱基对数目表示(Mb),1 pg等于978 Mb。植物的C值目前被广泛应用于植物系统分类学、植物生理学和植物进化生物学等领域,C值与植物的性状特征、生理特性以及基因组进化等相关问题,已引起了众多科研工作者的广泛关注[7-8]。然而,地构叶属植物作为传统中药和药用活性成分提取的材料,其C值还未被测定,有关C值在药用植物的系统演化和进化等方面的研究,还没有引起重视。
近年已经发展起来的测定基因组大小的方法主要有孚耳根微显影、基因组测序法和流式细胞术(Flow cytometry, FCM)3种。对比这一系列不同的方法,我们会发现孚耳根微显影的操作过程相对繁杂,而基因组测序法花费比较大,显然流式细胞术操作十分简单、分析非常快速、相对比较准确,而且广泛应用于不同物种基因组大小测定的研究[8-10]。Bennett统计结果显示,近30年中有84.5%的植物C值是采用FCM法测定[11]。本研究拟应用流式细胞仪对大戟科地构叶属植物地构叶及广东地构叶的基因组大小进行测定并加以分析,以期为地构叶属植物资源的充分利用奠定基础。
1 材料与方法
1.1 试验材料
试验材料为地构叶和广东地构叶野外采集种子播种后长成的健康植株,每个植物种收集分别来自2个不同种群的3个叶片作为重复,样品信息见表1。用作外标的水稻品种日本晴(Oryzasativasubsp.japonicaKato cv. Nipponbare)取自中国科学院昆明植物研究所。
1.2 仪器与试剂
仪器:流式细胞仪( CyFlow Space )。
试剂:碘化丙啶( propidiumiodide, PI )染液,其他均为常规分析纯试剂。
1.3 试验方法
1.3.1 提取液的选择 不同提取液的解离效果不同,本试验对制备细胞核悬液过程中所需要的提取液进行尝试,比如常见的LB01[12]、GPB[13]、WPB[13]、Tris·MgCl2[14]、Galbraith[15],以获得适合地构叶及广东地构叶的最佳提取液。适合的解离液能促进植物细胞破碎充分,细胞器分散彻底,从而解离出细胞核。由于植物材料不同,所以不同解离液的解离效果相差甚大[16-17]。
1.3.2 细胞核悬液的制备 分别取地构叶和广东地构叶的新鲜幼嫩叶片约1.5 g,用蒸馏水快速冲洗,之后用滤纸吸干水分,放于培养皿中置于冰上预冷,后加入预冷的解离液(约1.5 mL),用锋利的刀片垂直快速切碎叶片。充分混匀后用滤膜过滤并用移液枪吸取至2 mL离心管,然后置于4 ℃冰箱中孵育5 min再取出,置于离心机1 000 r/min 4 ℃离心5 min。小心弃上清,向沉淀中加预冷的解离液150 μL,混匀置于冰上备用。采用相同方法获得水稻叶片的细胞核悬液,置于冰上备用。操作时应注意刀片要锋利,材料要完全浸入提取液,垂直快速切碎;每个样品至少重复3次。
1.3.3 DNA特异性染色 将制备好的地构叶、广东地构叶以及水稻的细胞核悬液放在冰上,分别往3种不同的细胞核悬液中加入预冷的碘化丙啶(PI)染料200 μL,再置于4 ℃冰箱中避光染色,8 min即可。
1.3.4 样品测定及基因组大小计算 在样品上机检测前,将染过色的样品轻轻振动6 s,然后移至上样管,采用流式细胞仪测定。每个样品收集8 000~15 000个细胞(核),包括碎片。在测定过程中采用500 nm的蓝光激发,后收集FL2通道的荧光并检测PI发射的荧光强度。样品核DNA含量的计算方法如下:
2 结果与分析
2.1 提取液的选择
在制备细胞核悬液的过程中,对常用的解离液进行尝试。最后发现,裂解液WPB对地构叶及广东地构叶的细胞核解离效果最佳,所得的峰形图杂峰较少或没有杂峰。WPB配方为:200 mmol Tris·HCl ,4 mmol MgCl2·6H2O,2 mmol EDTA·Na2·2H2O,86 mmol NaCl,10 mmol 焦亚硫酸钠,1.0 %PVP-10,1.0 % (v/v) Triton X-100,pH 7.5,4 ℃下保存。
2.2 基因组大小的测定
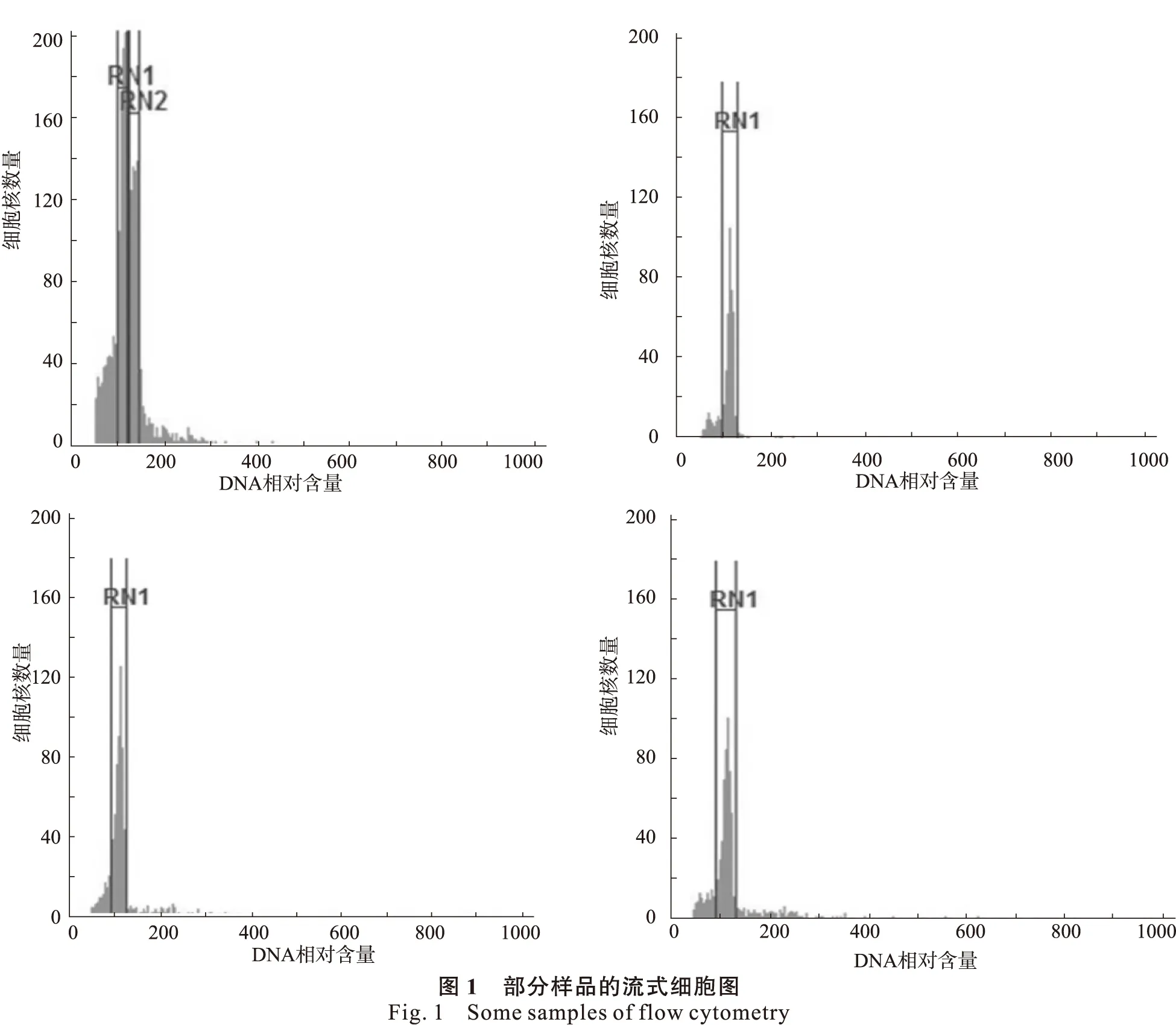
由于采用内标法难以对地构叶属植物的离子团准确区分(图1-A)。因此,本试验采用水稻品种日本晴作为外标(图1-B),应用流式细胞仪测试6份水稻样品计算G0/G1峰荧光均值为106.18,随后又分别测定来自地构叶和广东地构叶共12组样品,每个样品测3次重复。部分样品的流式细胞图谱见图1-C和图1-D。地构叶、广东地构叶的二倍体DNA含量统计结果见表1。

表1 地构叶和广东地构叶2C DNA含量测定结果Tab.1 2C DNA content measurement of Speranskia tuberculata and Speranskia cantonensis
由于水稻日本晴2C DNA含量为0.795 pg[18],再以所测样品的PI发射荧光强度为根据可计算出基因组的大小(2C DNA含量),地构叶的基因组大小平均为(0.81±0.02) pg,变异系数为2.55%;广东地构叶的基因组大小平均为(0.85±0.02) pg,变异系数为2.35 %。由此可知,地构叶和广东地构叶的基因组大小很接近。
3 结论与讨论
通常情况下利用流式细胞仪测定植物基因组大小采用内标方法,内标的选择应该符合以下几个条件[19]:相比于待测物种,要有相近的基因组大小,且较易区分;有稳定的遗传性;有可靠的基因组大小数据;能获得大量样品。由于地构叶和广东地构叶与普遍使用的内标如水稻和毛果杨(Populustrichocarpa)等基因组大小类似,且难以区分离子团(图1),又与玉米(Zeamays)等基因组大小相差较远,计算误差较大,难以得到准确的数据。因此,选用水稻作为外标的试验方法测定地构叶属的基因组大小。多次重复试验表明,该手段同样能得到较为准确的数据。
所测得的不同地构叶样品和广东地构叶样品的变异系数分别为2.55%和2.35%,说明同一物种的不同植株和不同材料的基因组大小存在一定差异。目前普遍认为,变异系数在低于3 %时,被认为实验结果是准确的,变异系数低于5%也是可以接受的范围[19]。地构叶和广东地构叶基因组大小的变异系数均小于3%,因此,认为此差异对于应用流式细胞仪来测定植物基因组大小并没有造成实质性的影响,测出的基因组大小数据很可靠。
杨德奎等[20]对地构叶的核型分析表明,地构叶为二倍体植物(2n=14),我们本次测得的地构叶和广东地构叶的DNA含量接近(表1),因此,可以推断广东地构叶和地构叶一样,也应该是一个二倍体植物,并且染色体条数有可能一致,均为14条。广东地构叶基因组(0.85±0.02)pg稍大于地构叶(0.81±0.02)pg,很可能是在进化过程中某些染色体或者基因片段发生了重复的结果。根据邱园的植物 DNA C-值数据库(http: //data. kew. org / cvalues / homepage. html)中的数据,大戟科的植物基因组大小差异很大,范围在0.30~14.35,平均值为3.59,我们的结果表明:地构叶属在大戟科中属于DNA含量较小的基因组,和巴豆亚科的木薯属(Manihot)、以及同为铁苋菜亚科的蓖麻属(Ricinus)的基因组大小类似,表明基因组大小不能反映大戟科植物的系统演化关系,这与自然界普遍存在的“C值悖论”[21]吻合。
本研究以日本晴作为外标,测定了地构叶属植物地构叶和广东地构叶的基因组大小,这些数据将有利于地构叶属植物遗传学和基因组学研究方案的制定以及数据的分析,也为可测定其他药用植物C值提供参考和借鉴。
[1] 中国植物志编辑委员会. 中国植物志(第44卷第64-65分册)[M].北京:科学出版社,2005.
[2] 范云柏, 赵玉英, 李艳梅,等.地构叶化学成分研究[J]. 天然产物研究与开发,1996,8(4):21-24.
[3] 李艳梅, 王璇. 地构叶黄酮类化合物的分离鉴定[J].中国药学,1997,6(2):70-74.
[4] 高海翔,鲁润华, 魏小宁,等.透骨草挥发油成分分析[J].中草药,2000,31(8):16-17.
[5] 王璇, 崔景荣, 肖志平,等.透骨草类药材抗炎镇痛作用的比较[J].北京医科大学学报,1998,30(2):145.
[6] Swift H.The constancy of desoxyribose nucleic acid in plant nucleic[J].Proceedings of the National Academy of Sciences,1950,36(11):643-654.
[7] Bennett M D,leitch I J.Nuclear DNA amounts in angiosperms progress, problems and prospects [J]. Annals of Botany, 2005, 95(1): 45-90
[8] 周知里, 熊智, 田斌,等. 两种木棉科植物基因组大小测定[J]. 西部林业科学, 2014, 43(2): 97-101.
[9] 邓果特, 刘清波, 蒋建雄,等. 五节芒基因组大小测定[J]. 植物遗传资源学报, 2013, 14(2): 339-341.
[10] 李秋实, 徐江, 朱英杰,等. 基于流式细胞技术的灵芝基因组大小估测[J]. 菌物学报, 2013, 32(5): 899-906.
[11] Dolezel J, Bartos J. Plant DNA flow cytometry and estimation of nuclear genome size [J]. Annals of Botany, 2005, 95(1): 99-110.
[12] Dolezel J, Binarova P, Lucretti S. Analysis of nuclear DNA content in plant cells by flow cytometry [J]. Biologia Plantarum, 1989, 31(2): 113-120.
[13] Loureiro J, Rodriguez E, Dolezel J, et al. Two new nuclear isolation buffers for plant DNA flow cytometry: A test with 37 species [J]. Annals of Botany, 2007, 100(4): 875-888.
[14] Pfosser M, Amon A, Lelley T, et al. Evaluation of sensitivity of flow cytometry in detecting aneuploidy in wheat using disomic and ditelosomic wheat-rye addition lines [J]. Cytometry, 1995, 21(4): 387-393.
[15] Galbraith D W,Harkins K R,Maddox JM,et al.Rapid flow cytometric analysis of the cell cycle in intact plant tissues[J].Science,1983,220(4601):1049-1051.
[16] 张靖靖. 紫草基因组大小的测定研究[D]. 南京: 南京大学, 2013: 21-29.
[17] 张琳琳, 曹 博, 白成科,等. 应用流式细胞术测定药用植物黄芩基因组大小[J]. 中国农学通报, 2013, 29(25): 130-135.
[18] Kawahara Y,De I B M,Hamilton J P,et al.Improvement of theOryzasativaNipponbare reference genome using
next generation sequence and optical map data [J].Rice,2013,6(1):4.
[19] Bennetzen JL,Ma J,Devos KM.Mechanisms of recent genome size variation in flowering plants [J].Annals of Botany,2005,95(1):127-132.
[20] 杨德奎,周俊英.山东10种植物的核型分析[J].广西植物,1999,19(4):349-354.
[21] Thomas CA Jr.The genetic organization of chromosomes[J].Annual Review of Genetics,1971,5:237-256.
(责任编辑 赵粉侠)
Estimation of Genome Sizes ofSperanskiatuberculataandSperanskiacantonensis
ZHANG Xue-juan1,ZHOU Zhi-li1,ZHU Ren-bin2,JU Miao-miao1,HE Cheng-zhong1,TIAN Bin1,3
(1.Key Laboratory of Biodiversity Conservation in Southwest China,State Forestry Administration, Southwest Forestry University,Kunming Yunnan 650224,China;2.College of Resource and Environment,North West Agriculture and Forestry University,Yangling Shaanxi 712100, China;3.Kunming Institute of Botany,Chinese Academy of Sciences,Kunming Yunnan 650201,China)
Using rice (Oryzasativ) as an external standard,the genome sizes ofSperanskiatuberculataandSperanskiacantonensiswere determined by flow cytometry.As a result, the average genome sizes (the content of 2C DNA) ofSperanskiatuberculataandSperanskiacantonensiswere about (0.80±0.02) pg and (0.85±0.02)pg, respectively.
Speranskia;Speranskiatuberculata;Speranskiacantonensis; the genome sizes;flow cytometry
2014-12-30
国家自然科学基金项目(NSFC 31260050)资助。
田斌(1983—),男,博士,讲师。研究方向:植物遗传育种及群体遗传学。Email:tianbinlzu@gmail.com。
10.11929/j.issn.2095-1914.2015.04.015
S718.46
A
2095-1914(2015)04-0086-05
第1作者:张雪娟(1988—),女,硕士生。研究方向:植物遗传育种及群体遗传学。Email:juanzi888168@126.com。

