2个日本晚樱品种组织培养和快繁技术研究
张灵灵 蒋细旺
(江汉大学生命科学学院,湖北 武汉430056)
2个日本晚樱品种组织培养和快繁技术研究
张灵灵 蒋细旺
(江汉大学生命科学学院,湖北 武汉430056)
以日本晚樱‘杨贵妃’和日本晚樱‘醉红’带芽茎段为试验材料,探究植物生长调节剂组合和培养基对晚樱启动培养、增殖培养、生根培养的影响。结果表明:MS+6-BA 1.0 mg/L+ NAA 0.1 mg/L最适合2个品种的启动培养,‘杨贵妃’的腋芽萌发率为73%,‘醉红’的腋芽萌发率为80%。WPM+KT 1.0 mg/L+IBA 0.1 mg/L适于2个品种的增殖培养。芽先在含生长素的生根培养基1/2 WPM+IBA 1.0 mg/L+NAA 0.5 mg/L中培养4 d后,再将其转接到无生长调节剂培养基的1/2生长调节剂WPM中培养24 d,生根率达93.3%(‘醉红’)和90.0%(‘杨贵妃’)。生根苗移栽至V(蛭石)∶V(珍珠岩)∶V(泥炭土)=1∶1∶1的基质中培养,炼苗30 d后,成活率达80%以上。
日本晚樱;组织培养;快速繁殖;植物生长调节剂
日本晚樱‘杨贵妃’(Cerasusserrulatavar.lannesiana‘Mollis’)与‘醉红’(Cerasusserrulatavar.lannesiana‘Zuihong’)隶属于蔷薇科(Rosaceae)李亚科(Prunoidea)樱属(Cerasus),是著名的樱花品种[1]。‘杨贵妃’花大、半重瓣,花初开粉白色,近谢时颜色变深;花姿优雅,花态丰满;其神韵颇似我国古代四大美女之一杨贵妃。‘醉红’花单瓣,花初开时白色,随着花的开放会慢慢变红,盛开时繁花满树,白花中点缀着一些红花,烂漫可爱。其二者均具有非常高的观赏价值和广阔的园林应用前景[2-3]。目前,每当春天樱花盛开之季,各地樱花公园的游人如织,形成了独特的“赏樱游”并催生了“樱花经济”,据湖北省统计局报道,湖北省2013年首尝“花经济”硕果达400亿元人民币,仅樱花一项就占全年旅游收入的20%,可见樱花在国内园林绿化中的地位十分重要[2,4],为了顺应“樱花经济”的发展,迫切需要探讨樱花的快速繁殖技术,推动我国樱花产业化发展。
日本晚樱‘杨贵妃’和‘醉红’均为园艺变种,不易结实,传统上采用嫁接的方法繁殖[5],但是此种方法因难以找到合适的砧木而不适用于大规模的生产。组织培养快繁技术不仅能快速获得大量的幼苗,而且有利于保持亲本的优良性状,提高苗木抗病菌的能力。目前,关于樱属植物的组培快繁,已经有许多的研究,但是主要集中在野生樱花[6-10]、樱桃[11-16]及樱砧木[17-18]上,而关于观赏价值较高的园艺栽培品种的组培快繁研究较少。本试验以日本晚樱‘杨贵妃’和‘醉红’带腋芽的茎段为试验材料,旨在建立这两个品种的组培快繁体系,为大规模樱花繁殖奠定基础。
1 材料与方法
1.1 供试材料
日本晚樱‘杨贵妃’取自湖北省武汉市磨山樱园,日本晚樱‘醉红’取自江汉大学校园内。于2014年4月采集这两种母树上生长健壮、无病虫害的1年生嫩枝。
1.2 试验方法
1.2.1 启动培养 实验室内用清水将材料洗净,将嫩枝剪成6~10 cm的茎段,流水冲洗2 h,在超净台上用70%的乙醇浸泡40 s,用无菌水冲洗4次后用0.1%的升汞浸泡10 min,无菌水冲洗5次。用滤纸吸干,将材料切成2~3 cm带1个腋芽的茎段,将茎段接种于启动培养基Q0~Q8上(表1),以MS为基本培养基,研究植物生长调节剂浓度和配比对2个樱花品种腋芽萌发的影响。研究6-BA 1.0 mg/L分别与NAA(0.1、0.2、0.4mg/L)、IBA(0.1、0.2、0.4mg/L)作用对腋芽萌发的影响,并研究NAA 0.1 mg/L分别与6-BA(0.5、1.0、2.0 mg/L)作用对腋芽萌发的影响。每种培养基接种30个外植体,重复3次。28 d后统计萌发率。
萌发率=萌发个数/无菌外植体个数×100%
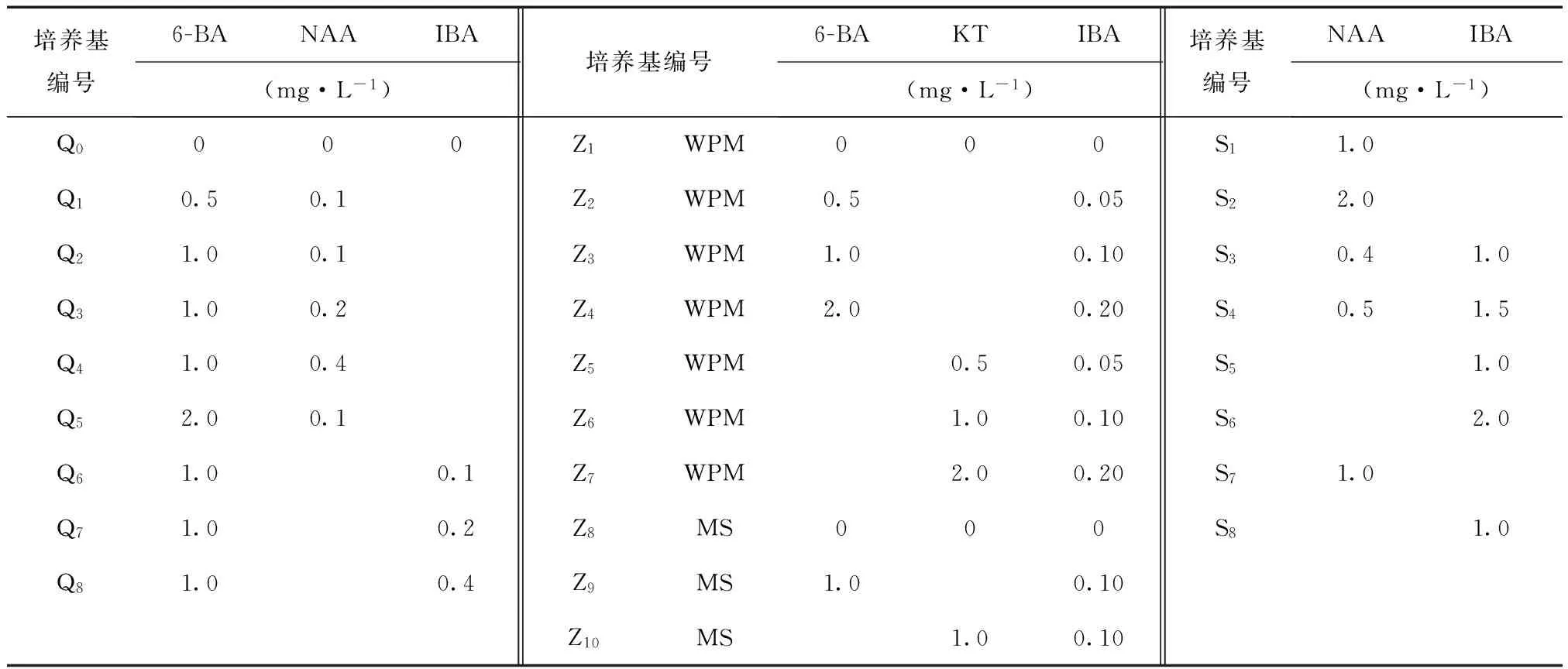
表1 启动培养、增殖培养及生根培养的培养基配方Tab.1 starting,proliferation and rooting medium formula
1.2.2 增殖培养 将萌发的芽接种到增殖培养基(Z1~Z10)中(表1),研究WPM、MS培养基和6-BA(0.0、0.5、1.0、2.0 mg/L)、KT(0.0、0.5、1.0、2.0 mg/L)对2个日本晚樱品种增殖培养的影响,将6-BA、KT与IBA的浓度按10∶1比例配比进行增殖培养。每个培养基接种10个,重复3次。28 d后统计每个处理的增殖系数。
增殖系数=增殖芽数/接种芽数
1.2.3 生根培养及炼苗 生根诱导主要采用2种方法。
1) 将增殖芽移接到含生长素的S1~S6培养基中(表1),培养4 d后再将其移至无生长调节剂的培养基中继续培养。
2) 将增殖芽移接到含生长素的(S7、S8)培养基中(表1),一直生根诱导培养。以‘醉红’为试验材料,比较2种方法生根情况。以 1/2WPM为基本培养基,研究NAA、IBA的浓度及配比对2个樱花品种生根状况的影响。
每个处理10个芽,重复3次,28 d后统计每个处理的生根率,平均根数及根的生长状态。生根培养45 d后,在培养室中将培养瓶的封口膜揭开,炼苗4~5 d后将其移栽到V(蛭石)∶V(珍珠岩)∶V(泥炭土)=1∶1∶1的基质中培养,每隔1 d用1/4 MS大量元素营养液喷洒叶面[16]。10 d后将其移到组培室外培养,30 d后记录移栽成活率。
生根率=生根苗数/培养的苗数×100%
平均根数=总根数/生根苗数
1.3 培养条件
培养室温度(25±2)℃,光照强度1 500~2 000 lx,光照周期16 h/d。腋芽萌发试验采用直径90 mm的圆形玻璃培养皿培养,每个培养皿约含30 mL培养基;增殖培养用400 mL的培养瓶培养,每个培养瓶约含80 mL培养基;生根诱导采用250 mL锥形瓶培养,每瓶约含75 mL培养基。启动培养基和增殖培养基中添加30 g/L的蔗糖和6 g/L的琼脂,生根培养基中添加25 g/L的蔗糖和6 g/L的琼脂,增殖培养基和生根培养基中添加0.5 g/L的活性炭颗粒,培养基的pH调节为5.6~5.8(用0.1 mol/L的HCl或NaOH调节)。将所有的培养基用蒸汽高压灭菌锅121 ℃灭菌20 min。
1.4 数据统计与处理
试验所有的数据均用Excel 2010和SPSS 19.0处理。
2 结果与分析
2.1 外植体启动培养
外植体接种7 d后成活的茎段基部开始膨大,在两侧长出薄层愈伤组织;14 d左右腋芽开始萌动,其中‘醉红’腋芽萌发时间较‘杨贵妃’早4 d左右。28 d后统计萌发率,结果见表2。
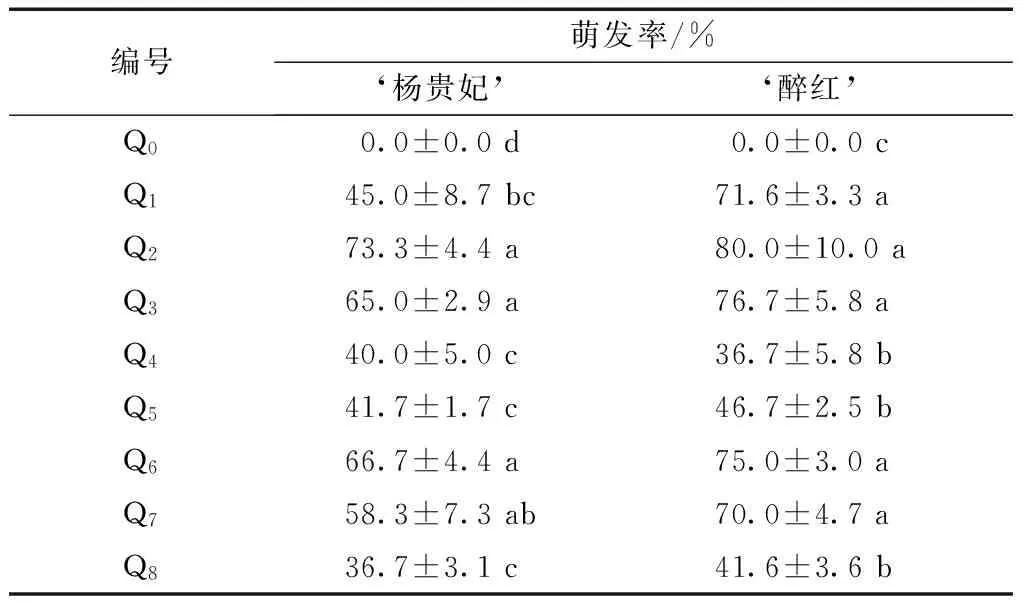
表2 ‘杨贵妃’、‘醉红’启动培养试验结果Tab.2 The result of starting of Cerasus serrulata var.lannesiana‘Mollis’and Cerasus serrulata var.lannesiana‘Zuihong’
注:表中同列数据后标注的小写英文字母,表示处理间差异显著(P<0.05)。
由表2可知,在无生长调节剂的Q0培养基中,腋芽萌发率为0.0,可见植物生长调节剂对腋芽萌发有着关键性的调控作用。在预备试验中发现,当6-BA的浓度<0.5 mg/L时外植体难以萌发,故<0.5 mg/L的6-BA浓度在正式试验设计中不予考虑。当6-BA的浓度为1.0 mg/L,随着NAA、IBA浓度的增加,2个品种萌发率随之降低,当NAA浓度为0.1 mg/L时,2个品种的萌发率最高,‘杨贵妃’为73.3%,‘醉红’为80.0%;当生长素浓度增至0.4 mg/L,2个品种的萌发率均明显降低;6-BA分别与NAA、IBA使用时,前者的效果稍优于后者,但是没有显著性的差异。当NAA浓度为0.1 mg/L时,改变6-BA的浓度,发现6-BA浓度为1.0 mg/L时,2个品种的萌发率最高。此外,试验中还发现腋芽的萌发率也与外植体基因型有一定的关系,‘醉红’的萌发率整体上高于‘杨贵妃’。
2.2 增殖培养
增殖培养约14 d后开始形成丛生芽,每丛2~9个芽。28 d后统计平均增殖系数,试验结果见表3。
表3显示,芽的增殖系数与培养基种类及生长调节剂浓度有很大的关系。在相同植物生长调节剂水平条件下,WPM培养基中芽的增殖系数明显高于MS培养基,在WPM培养基中,芽生长状态良好,叶片浓绿,在MS培养基中芽生长状态较差,叶片较薄并轻微反卷,出现轻微甚至严重的玻璃化现象。在相同的培养基条件下,植物生长调节剂对芽的增殖有着关键性的调控作用,在无植物生长调节剂的培养基中,外植体均褐化死亡。在WPM培养基条件下,6-BA、KT的浓度从0.5 mg/L增至1.0 mg/L,很大程度上提高了增殖系数,增殖芽也表现得更为健壮;从1.0 mg/L增至2.0 mg/L时,增殖系数未有明显变化,芽的生长状态反而变差。此外,增殖芽在含KT的培养基中表现更好,叶片浓绿,生长更为健壮,且总体增值系数也高于6-BA。因此,本试验条件下Z6培养基最适合2个晚樱品种的增殖培养,‘杨贵妃’的增殖系数为4.4,‘醉红’的增殖系数为6.1(图1)。
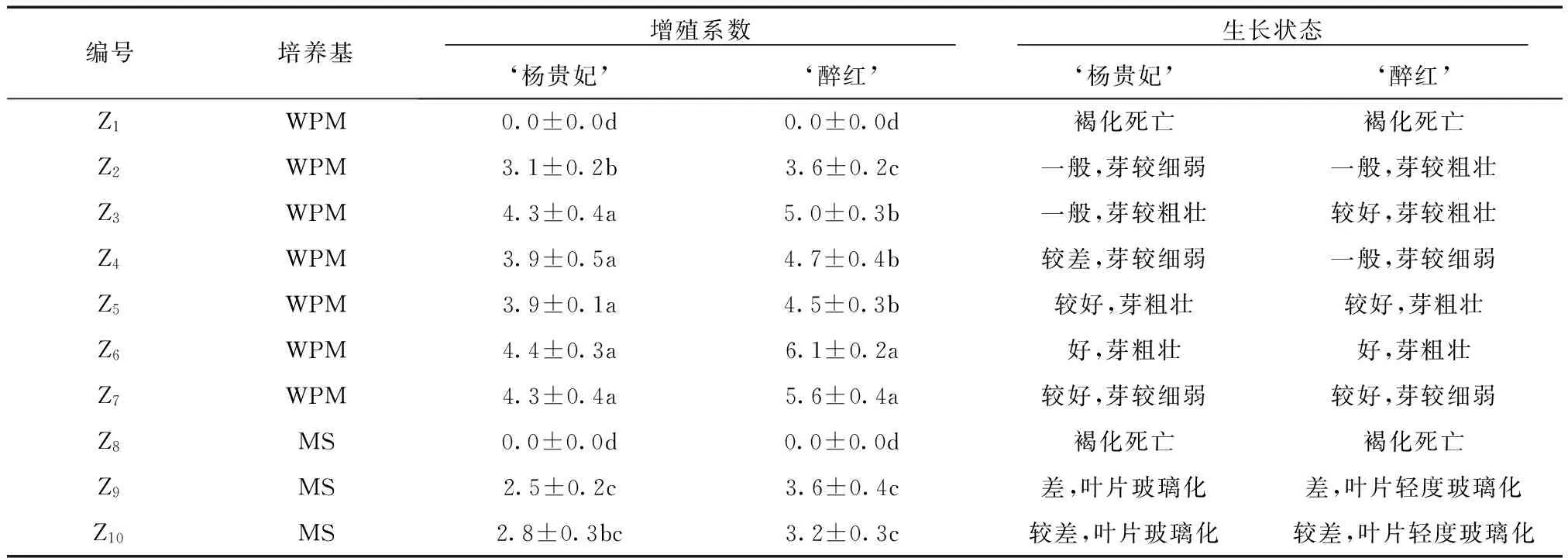
表3 ‘杨贵妃’、‘醉红’增值培养试验结果Tab.3 Shoot prolifertion of Cerasus serrulata var.lannesiana‘Mollis’and Cerasus serrulata var.lannesiana‘Zuihong’
注:表中同列数据后标注的小写英文字母,表示处理间差异显著(P<0.05)。
2.3 生根培养
晚樱2品种生根诱导试验结果见表4。
表4结果显示:在含生长素(S7和S8)的培养基中一直培养,植株的生根率较低,仅为26.7%和21.7%,且生根较晚,约培养16 d后出现根;而在含生长素(S1~S6)的培养基中培养4 d后,再将其移植到无生长调节剂的培养基中继续培养,‘醉红’生根率高达93.3%,约培养10 d后出现根。在只含NAA的培养基S1、S2中诱导生根,植株的根多而粗壮,但是没有根毛,而且部分植株的基部出现了大量的愈伤组织;在只含IBA的培养基S5、S6中诱导生根,植株的根少而细弱,有少许根毛;在含IBA和NAA的生根培养基S3和S4中诱导生根,植株的根系多而健壮,有大量的根毛,生根率也明显的提高。本试验中最适合2个品种生根的是先在1/2 WPM+IBA 1.5 mg/L+NAA 0.5 mg/L的培养基中培养4 d,再将其移至1/2 WPM培养基中培养24 d,生根率分别达90.0%(‘杨贵妃’)和93.3%(‘醉红’)(图1)。
2.4 炼 苗
生根培养45 d后,在培养室中将培养瓶的封口膜揭开,炼苗4~5 d后将其移栽到V(蛭石)∶V(珍珠岩)∶V(泥炭土)=1∶1∶1的基质中培养。每隔1 d用1/4 MS大量元素喷洒叶面,10 d后将其移植室外培养,30 d2个品种的成活率均达80%以上。
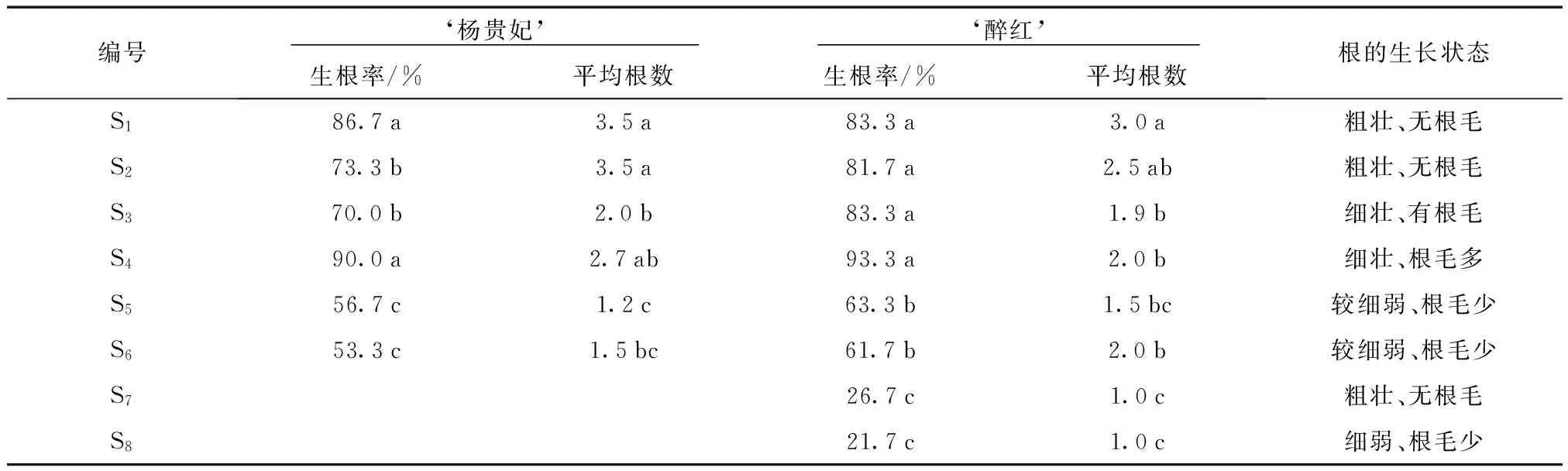
表4 ‘杨贵妃’、‘醉红’生根诱导试验结果Tab.4 Rooting induction test of Cerasus serrulata var. lannesiana ‘Mollis’ and Cerasus serrulata var. lannesiana ‘Zuihong’
注:表中同列数据后标注的小写英文字母,表示处理间差异显著(P<0.05)。

3 结论与讨论
培养基的种类对2个品种的组织培养有很大影响,MS培养基属于高盐类,易导致木本植物在组织培养中产生有毒物质而褐化死亡,而且过高浓度的NH+易诱发植株玻璃化现象[19],WPM培养基中的铵盐含量明显低于MS培养基,能够避免高浓度NH+对植株生长的有害影响。本试验发现,WPM培养基能够有效避免植株的玻璃化现象。此外,WPM也成功应用于欧洲甜樱桃(Prunusavium)[11-12]、黑樱桃(P.serotina)[13-14]、酸樱桃(P.cerasus)[15]、桃(P.persica)[20]的组织培养中。
植物生长调节剂的种类及浓度配比对樱属植物组织培养有着关键性的调控作用。荣冬青等[21]在垂枝早樱‘红枝垂’(C.subhirtellavar.pendula‘Rosea’)的组织培养试验中发现:当6-BA/NAA比例约为10时,更利于腋芽的分化。在本试验中6-BA的浓度为1.0 mg/L,NAA或IBA的浓度为0.1 mg/L时,腋芽的萌发率较高,而当NAA或IBA的浓度升高至0.4时,腋芽的萌发率明显降低。在增殖培养中,细胞分裂素起着重要的作用,Pruski等[16]在毛樱桃(P.tomentosa)的组织培养中发现,当6-BA的浓度在0~2.5 mg/L的范围内,增殖系数随着浓度的增加而增加。本试验条件下,6-BA的浓度为1.0 mg/L以下,增值系数最高。而且试验结果显示:KT更利于增殖芽的生长,这与Muna等[17]在矮樱桃(P.avium)的组织培养中显示的结果一致。
在生根诱导试验中,先将增殖芽接种到含生长素的培养基中培养4 d后,再将其移栽到无生长素的培养基中培养3周后,取得了较好的生根效果,这与Kalinina等[22]在观赏樱花的组培生根研究中得到的结论一致。而让植株一直在含IBA 1.0 mg/L或者NAA 1.0 mg/L的培养基中生根诱导,生根率仅为21.7%和26.7%,而且推迟生根5~8 d,这说明高浓度的生长素将不利于晚樱的生根,而短时间的高浓度生长素处理后,再将其移接到无植物生长调节剂的培养基中生根,能够有效避免高浓度生长素对生根的抑制作用。试验中只有在同时使用IBA和NAA的培养基中,植株的根系才表现健康,这与荣冬青等[21]在垂枝早樱‘红枝垂’的生根培养中显示的结果一致。
在增殖培养基和生根培养基中添加0.5 g/L的活性炭颗粒,较好解决了外植体的褐化问题,而且有利于组培苗的健壮生长,使叶片更加浓绿,根系更加健壮,这与韩文璞等[23]的研究结果一致。Koubouris等[24]在杏树(P.armeniaea)的组培生根试验中添加25 mg/L的活性炭,也取得了较好的效果。
[1] 俞德俊,李朝鸾.中国植物志·38卷[M].北京:科学出版社,1986.
[2] 王贤荣.中国樱花品种图志[M].北京:科技出版社,2014.
[3] 张琼.樱属观赏品种资源调查及部分种与品种SSR分析[D].南京:南京林业大学,2013.
[4] 蒋细旺.武汉樱花栽培历史和特点[J].江汉大学学报,2014,42(5):74-79.
[5] 蒋细旺.樱花的嫁接繁殖技术研究[C]//胡永红,费富根. 樱花研究与应用.上海:上海交通大学出版社,2014:55-60.
[6] 陈志伟,汪小飞,伊贤贵,等.微毛樱离体快繁初步研究[J].福建林学院学报,2011, 31(4):349-353.
[7] 邹娜,陈璋,林思祖,等.福建山樱花愈伤组织的诱导及植株再生[J].核农学报,2013,27(10):1417-1423.
[8] 王光萍,黄敏仁.福建山樱花的组织培养及植株再生[J].南京林业大学学报(自然科学版),2002, 26(2):73-76.
[9] 吕月良,陈璋,施季森,等.福建山樱花不定芽诱导和植株再生规模化繁殖试验[J].南京林业大学学报(自然科学版),2006,30(3):105-108.
[10] 王贤荣,荣冬青.钟花樱组织培养中多因子正交实验研究[J].安徽农业大学学报,2008,35(2):169-173.
[11] Feeney M, Bhagwat B, Mitchell J S, et al. Shoot regeneration from organogenic callus of sweet cherry(PrunusaviumL.)[J]. Plant Cell, Tissue and Organ Culture,2007,90:201-214.
[12] Matt A,Jehle J A.In vitro plant regeneration from leaves and internode sections of sweet cherry cultivars (PrunusaviumL.)[J].Plant Cell Rep,2005,24:468-476.
[13] Liu X M, Pijut P M. Agrobacterium-mediated transformation of maturePrunusserotina(black cherry) and regeneration of transgenic shoots[J].Plant Cell, Tissue and Organ Culture,2010,101:49-57.
[14] Liu X M,Pijut P M.Plant regeneration from in vitro leaves of mature black cherry(Prunusserotina)[J].Plant Cell,Tissue and Organ Culture,2008,94:113-123.
[15] Tang H, Ren Z, Reustle G, et al. Plant regeneration from leaves of sweet and sour cherry cultivars[J].Scientia Horticulturae, 2002, 93:235-244.
[16] Pruski K,Lewis T.Tissue culture propagation of Mongolian cherry(Prunusfruticosa)and Nanking cherry(Prunustomentosa)[J].Plant Cell,Tissue and Organ Culture,2005,82:207-211.
[17] Muna A L S,Ahmad A K,Mahmond K, et al. In vitro propagation of semi-dwarfing cherry rootstock[J].Plant Cell,Tissue and Organ Culture,1999,59:203-208.
[18] Sarropoulou V,Theriou K D,Therios I.Effects of exogenous L-arginine on in vitro rooting , chlorophyll, carbohydrate, and proline concentrations in the sweet cherry rootstock M×M14(P.aviumL.×P.mahalebL.)[J].Plant Biotechnology Reports, 2013,7:457-465.
[19] 陈兵先,黄宝灵,吕成群.植物组织培养试管苗玻璃化现象研究进展[J].林业科技开发,2011,25(1):1-5.
[20] Pérez-Jiménez M,López-Soto M B,Cos-Terrer J.In vitro callus induction from adult tissues of peach(PrunuspersicaL.Batsch)[J]. In Vitro Cellular & Developmental Biology-Plant, 2013(49):79-84.
[21] 荣冬青,王贤荣.垂枝早樱"红枝垂"组培快繁试验[J].林业技术开发,2008,22(5):72-75.
[22] Kalinina A, Brown D C W.Micropropagation of ornamentalPrunusspp.and GF305peach,aPrunusviral indicator[J].Plant Cell Rep,2007(26):927-935.
[23] 韩文璞,袁明莲.活性炭在甜樱桃组织培养中的应用[J].落叶果树,2001,33(3):7-8.
[24] Koubouris G,Vasilakakis M.Improvement of in vitro propagation of apricot cultivar‘Bebecou’[J].Plant Cell,Tissue and Organ Culture,2006,85:173-180.
(责任编辑 赵粉侠)
Study on Tissue Culture and Rapid Propagation of TwoCerasusserrulatavar.lannesianaCultivars
ZHANG Ling-ling,JIANG Xi-wang
(College of Life Science,Jianghan University,Wuhan Hubei 430056,China)
Various plant growth regulator combinations and culture medium types were examined to discussed their effects on startup,proliferation and rooting culture ofCerasusserrulatavar.lannesiana‘Mollis’andCerasusserrulatavar.lannesiana‘Zuihong’by using stem with bud as explants.The result showed that the medium of MS+1.0 mg/L 6-BA+0.1 mg/L NAA was the most effective for two cultivars to startup culture.In the medium,axillary bud germination rate of‘Mollis’and,‘Zuihong’was 73% and 80%,respectively.Optimal shoot proliferation was obtained in medium of WPM+1.0 mg/L KT+0.1 mg/L IBA. Buds were pretreatment in rooting medium of 1/2 WPM+1.0 mg/L IBA+0.5 mg/L NAA which was added hormone for 4 d,and then transfer to a hormone-free medium for 24 days,the rooting percentage of‘Zuihong’and‘Mollis’were 93% and 90%,respectively.The rooted plantlets were transplanted in mixed medium which was compose of perlite,peat and vermiculite,the survival rate was up to 80% after hardening for 30 d.
Cerasusserrulatavar.lannesiana;tissue culture;rapid propagation;phytohormone
2015-01-06
2014年湖北省科技支撑计划项目(公益性科技研究类)(2014BBB009)资助;武汉花卉(菊花)工程技术研究中心项目(2013021005010466)资助。
蒋细旺(1964—),男,博士,教授。研究方向:园林植物与观赏园艺。Email: xiwangjiang@163.com。
10.11929/j.issn.2095-1914.2015.04.005
S723.1
A
2095-1914(2015)04-0027-06
第1作者:张灵灵(1991—),女,硕士生。研究方向:园林植物与观赏园艺。Email:youzhu0205@163.com。

