HPLC法测定菊花及其炮制品中主要成分的含量
付美霞,胡伶俐
(武汉市第五医院,湖北 武汉 430050)
HPLC法测定菊花及其炮制品中主要成分的含量
付美霞,胡伶俐*
(武汉市第五医院,湖北 武汉 430050)
目的:建立检测菊花及其炮制品种主要成分的方法,并对三批菊花及其炮制品中的主要成分绿原酸(C16H18O9)、木犀草苷(C21H20O11)、异绿原酸A(C25H24O12)进行含量测定。方法:色谱柱Agilent XBD C18(4.6 mm×250 mm,5.0 μm),流动相乙腈/0.1%磷酸,流速1.0 mL/min,柱温25 ℃,检测波长348 nm。结果:三种化合物的分离度较好,理论塔板数较高,绿原酸:A=8.278 71C+4.935 05,R=0.999 9(n=7),浓度范围为8.656~86.56 μg/mL;木犀草苷:A=15.866 45C-2.036 02,R=0.999 9(n=7),浓度范围为4.16~41.60 μg/mL;异绿原酸A:A=8.514 90C+1.2142 8,R=1.0(n=7),浓度范围为18.92~189.20 μg/mL,三种化合物的峰面积和浓度有良好的线性关系。结论:本方法能够准确快速地对菊花及其炮制中,主要成分进行定量分析,具有简便、稳定、准确等特点。
HPLC;菊花;绿原酸;木犀草苷;异绿原酸A
菊花是我们生活中最常见药食两用的中药之一,来源于菊科植物菊(ChrysanthemummorifoliumRamat.)干燥的头状花序,具有散风清热、平肝明目、清热解毒,用于风热感冒,头痛眩晕,目赤肿痛,眼目昏花,疮痈等[1]。绿原酸、异绿原酸A和木犀草苷是菊花中的主要化学成分。绿原酸具有清除自由基、抗菌消炎、抗病毒、降糖、降血脂、保肝利胆等多种功效[2-4];异绿原酸A与绿原酸的药理活性相似,具有抗菌、抗病毒清除自由基、兴奋中枢神经系统等多种生物活性作用[3-7];木犀草苷具有清热解毒、抗炎、镇咳、祛痰等作用[8-10]。
目前,临床上常用的菊花炮制品有:炒菊花、菊花碳、酒蒸品等。炮制通过对中药材或饮片的加工,从而达到减毒、增效、转变药性、提高药效等目的,通过炮制这项独特的制药技术,保证了中医临床用药的安全性和有效性。因此,控制炮制品中有效化学成分相当重要,本实验为菊花及其炮制品的质量控制提供参考方法,探讨炮制机理提供科学依据。
1 材料与方法
1.1 实验材料
供试品菊花品种为杭白菊,炮制品是炒菊花和菊花炭采购于浙江中医药大学中药饮片厂、浙江百草中药饮片有限公司和杭州华东医药饮片有限公司,经胡伶俐鉴定。供试品粉碎过后,过一号筛,备用。
对照品绿原酸(批号:111782-201304)、木犀草苷(批号:110753-201414)、异绿原酸A(批号:111718-201406)购自中国药品生物制品检验所;乙腈(色谱纯,美国TEDIA),自制超纯水(美国Pall公司Cascade IX超纯水器),甲醇、乙醇、磷酸(分析纯,南京化学试剂厂)
1.2 实验仪器
HPLC-1260色谱仪(美国安捷伦公司);KQ-104型超声波清洗仪(昆山超声仪器有限公司);万分之一电子天平(ALT160-4B德国科恩分析天平)
1.3 实验方法与结果
1.3.1 色谱条件
色谱柱:Agilent ZORBA SB-C18(4.6 mm×150 mm ,5 μm);流动相:乙腈-0.1%磷酸(0~7 min10%→16%,7~18 min 16%→17%,18~24 min 17%→20%);流速:1.0 mL/min;柱温:25 ℃;检测波长:348 nm;进样量:5 μL;
1.3.2 标准曲线的绘制
精密称取10 mg绿原酸对照品,置于容量瓶中加70%的甲醇定容到50 mL,即为200 μg/mL绿原酸母液;精密称取10 mg木犀草苷对照品,置于容量瓶中加70%的甲醇定容到100 mL,即为100 μg/mL木犀草苷母液;精密称取20 mg异绿原酸A对照品,置于容量瓶中加70%的甲醇定容到50 mL,即为400 μg/mL异绿原酸A母液。
精密量取1.0,2.0,4.0,5.0,6.0,8.0,10.0 mL上述配置好母液置于25 mL的容量瓶中,用70%甲醇稀释到刻度,摇匀,过0.45 μm的滤膜,取续滤液5 μL进样进行分析。以峰面积A对浓度C进行线性回归,测定结果三条得到标准曲线:绿原酸:A=8.278 71C+4.935 05,R=0.999 9(n=7),浓度范围为8.656~86.56 μg/mL峰面积和浓度有良好的线性关系;木犀草苷:A=15.866 45C-2.036 02,R=0.999 9(n=7),浓度范围为4.16~41.60 μg/mL峰面积和浓度有良好的线性关系;异绿原酸:A=8.514 90C+1.214 28,R=1.0(n=7),浓度范围为18.92~189.20 μg/mL峰面积和浓度有良好的线性关系。
1.3.3 供试品的制备
精密称取药材粉末(过一号筛)0.25 g(每组3份平行),置于50 mL具塞三角瓶中,精密加入70%甲醇25 mL,密塞,称重,超声40 min,放冷,再次称重,用70%甲醇不足损失的重量,摇匀,过0.45 μm的滤膜,取续滤液,即得供试品溶液,进样量5 μL。

图1 三种对照品HPLC色谱图
1.3.4 菊花及其不同炮制品种主要化学成分含量测定结果
将上述1.3.3项制备的供试品,进入HPLC分析,根据峰面积计算出供试品中三种化合物的含量,结果如下表所示(表1)。
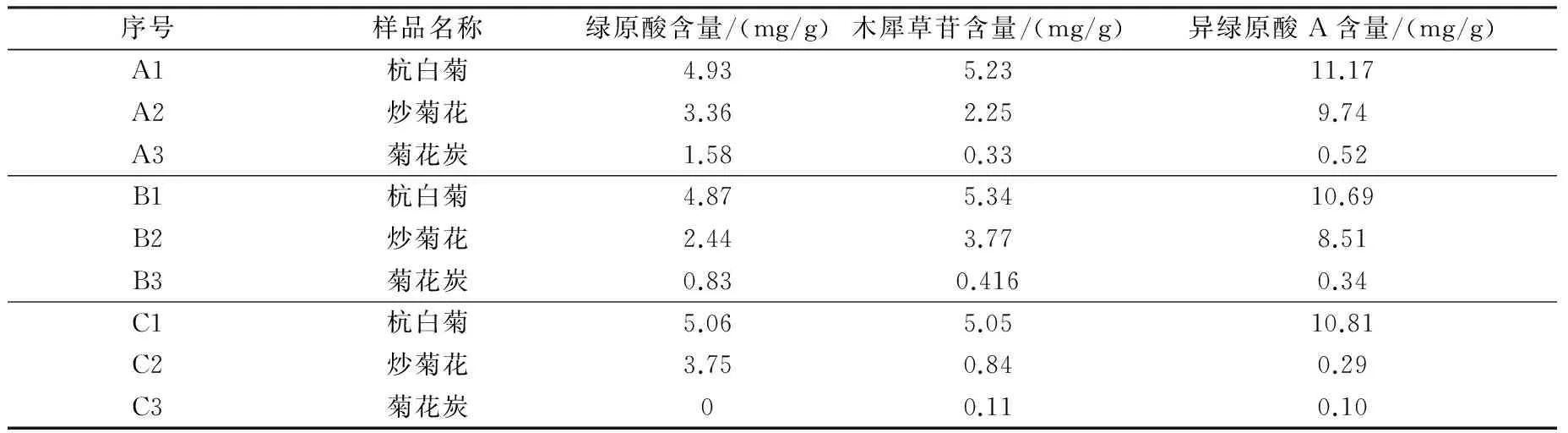
表1 菊花及其炮制品中三种化合物的含量
注:A为购于浙江中医药大学中药饮片有限公司;B为购于浙江百草中药饮片有限公司;C为购于杭州华东中药饮片有限公司。

图2 菊花及其炮制品HPLC色谱图
1.3.5 精密度
取1.3.3项下制备好的供试品溶液(生品),连续进样6次,进样量5 μL,测得三种化合物的峰面积,并计算RSD值,绿原酸(1.6%)、木犀草苷(1.1%)、异绿原酸A(1.0%),表明该方法精密度较好。
1.3.6 稳定性
取1.3.3项下制备好的供试品溶液(生品),分别于0,1,2,4,8,12和24 h后进样分析,进样量5 μL,测得三种化合物的峰面积,并计算RSD值,绿原酸(1.9%)、木犀草苷(1.5%)、异绿原酸A(1.4%),表明样品在24 h内稳定。
1.3.7 重复性
精密称取生品药材粉末6份,每份0.25 g,按1.3.3项下操作,测定并计算三种化合物的含量,6次测定值得RSD值,绿原酸(2.3%)、木犀草苷(1.4%)、异绿原酸A(1.1%),表明该方法重复性较好。
1.3.8 加样回收率
采用加样回收法,取已知含量的生品药材粉末6份,每份0.12 g精密称定,分别加入计算量的绿原酸、木犀草苷、异绿原酸A,按1.3.3项下操作,测定并计算三种化合物的回收率,结果绿原酸回收率为99.1%、木犀草苷回收率为99.4%、异绿原酸A回收率为99.2%,RSD绿原酸(2.6%)、木犀草苷(1.9%)、异绿原酸A(1.7%),在允许范围内表明该方法的准确度较好。
2 讨 论
(1)本实验考察了提取溶剂和提取方法的选择,绿原酸、异绿原酸A和木犀草苷三种化合物极性偏大,比较了甲醇和乙醇的提取效果,最终优化选择用70%的甲醇做提取溶剂,提取液中杂质较少,也能够提取完全。超声和加热回流相比,超声的效率更高,且杂质不易被提出。
(2)从实验结果中不难看出,经过炮制后三者组分的含量均减小,尤其是炒炭后,菊花炭中三种组分含量均急剧减低,这是由于高温使得化合物被破坏。炒炭后的菊花止血效果增加了,临床多用于月经过多而引起的头痛眩晕[11-12]。但是,和生品菊花相比抗菌、抗病毒、保肝利胆的功效消失了。
(3)从化学成分含量来看,炒菊花中三种化合物的含量与生品相比较均有不同程度的降低,这也能够科学地解释炒制过的菊花与生品和炒炭的不同,是因为炮制的温度和时间都不同,兼有两者的功效。
(4)中药必须经过炮制之后方能入药,中药炮制是根据中医理论,依照辨证施治用药的需要,以及中药自身性质和临床需要,所采取的一项传统制药技术。同一种药材,因生产和加工的环节不同,质量差异很大,直接影响疗效。当前用以控制饮片质量的标准是各省、市自治区制订的中药饮片炮制规范,而规范中的标准多数是依据形态、色泽、质地、气味等感官来判断饮片的真伪优劣,比较模糊,不易掌握,判断上也存在个体差异,不能保证质量。
因此,制订统一的炮制工艺及饮片的质量标准,通过科学客观的指标或参数,建立科学合理的质量标准,控制质量从而保证临床用药的安全有效。
[1] 国家药典委员会. 中国药典:一部[S]. 北京:化学工业出版社,2010:292.
[2] 陈绍华,王亚琴,罗立新. 天然产物绿原酸的研究进展[J]. 食品科技,2008,2:195-199.
[3] 王丽萍,郭栋,王果,等. 中药绿原酸的研究进展[J]. 时珍国医国药, 2011,22(4): 961-963.
[4] 盛卸晃,刘文谦,薛霞,等. 绿原酸体外抗单纯疱疹病毒作用[J]. 中国天然药物,2008, 6(3):233-234.
[5] 戚晓渊,史秀灵,高银辉,等. 绿原酸抗肝纤维化作用的研究[J]. 中国实验方剂学杂志, 2011,17(15) :139-143.
[6] Chao M M, Maureen K, Jehangir K K, et al. Synthesis of Chlorogenic acid derivatives with promising antifungal activity [J]. Bioorganic & Medicinal Chemistry, 2007, 21(15):6830-6833.
[7] Gui F W, Li P S, Yu D R, et al. Ant-hepatitis B virus activity of chlorogenic acid, quinicacid and caffeicacidinvivoandinvitro[J]. Antiviral Research, 2009, 83(2) : 186-190.
[8] 王婷婷,王少康,黄桂玲,等.菊花主要活性成分含量及其抗氧化活性测定[J]. 食品科学,2013,32(15):95-98.
[9] Wang T, Zhu B, Guo Q S, et al. Variation in major flavonoids glycosides and caffeoylquinic acids during florescence of three Chrysanthemum morifolium Ramat cv. “Hangju” genotypes[J]. Biochemical Systematics and Ecology, 2013, 47: 74-79.
[10] 杨柳,李俐,雷基祥,等. 不同品种菊花和贵州产野菊花中木犀草素的含量比较[J]. 中国野生植物资源,2009,28(1):67-69.
[11] 刘桂霞,李英霞,侯立静,等. 菊花炭中总黄酮含量研究[J]. 陕西中医,2103,34(1):81-83.
[12] 章昌怡. 炮制菊花炭的经验介绍[J]. 中草药,1988,7:47.
[13] 袁洪乔,梁泽华. 对菊花炮制方法的研究[J]. 求医问药,2012,10(11):847-848.
[14] 张健,李友宾,钱人玮,等. 菊花化学成分及药理作用研究进展[J]. 时珍国医国药, 2006,17(10): 1941-1942.
Determination of Chemical Constituents in Chrysanthemum and Processed Products by HPLC
Fu Meixia,Hu Lingli*
(The Fifth Hospital of Wuhan, Wuhan 430050,China)
Objective: To establish a methods for determination of chlorogenic acid, luteolin, isochlorogenic acid A in Chrysanthemum and processed products by HPLC. Methods: The separation was performed on Agilent XBD C18(4.6 mm× 250 mm, 5.0μm), the mobile phase consisted of acetonitrile/0.1% H3PO4at flow rate of 1.0 mL/min. The detection wavelength was set at 348nm and column temperature was 25 ℃. Result: Those chemical constituents have been separated, chlorogenic acid:A=8.278 71C+4.935 05,R=0.999 9 (n=7), The linear rang was 8.656-86.56 μg/mL; Luteoloside:A=15.866 45C-2.036 02,R=0.999 9 (n=7), The linear rang was 4.16-41.60 μg/mL; isochlorogenic acidA:A=8.514 90C+1.214 28,R=1.0(n=7), The linear rang was 18.92-189.20 μg/mL, the peak area and concentration of the three compounds have a good linear relationship. Conclusion: The method can accurately and quickly determination of chlorogenic acid, luteolin, isochlorogenic acid A inChrysanthemumand processed products.
HPLC; Chrysanthemum; chlorogenic acid; luteoloside; isochlorogenic acid A
10.3969/j.issn.1006-9690.2015.01.008
2014-08-16
付美霞(1963-),女,在职硕士研究生,从事药学工作。
*通讯作者:胡伶俐(1976-),女,从事中药管理和调剂相关研究工作。E-mail: 932587106@qq.com
R284.1
A
1006-9690(2015)01-0026-04

