EPHA2在人骨髓间充质干细胞成骨分化中的作用*
孙 博, 张 弢, 杨 龙, 李 靖, 任厚相, 孙 琦, 王建吉, 叶 川*
(1.贵阳医学院, 贵州 贵阳 550004;2.中国人民解放军第117医院 骨科, 浙江 杭州 311201)
·特约专论·
EPHA2在人骨髓间充质干细胞成骨分化中的作用*
孙 博1**, 张 弢2, 杨 龙1, 李 靖1, 任厚相1, 孙 琦1, 王建吉1, 叶 川1***
(1.贵阳医学院, 贵州 贵阳 550004;2.中国人民解放军第117医院 骨科, 浙江 杭州 311201)
目的: 研究EPHA2在人骨髓间充质干细胞(hBMSC)成骨分化过程中表达的动态变化及其在成骨分化中的作用。方法: hBMSC成骨分化诱导0、4、10和14 d后分别收集细胞提取RNA和蛋白, 采用Real-time PCR和Western blot方法检测EPHA2 mRNA及蛋白表达;使用EPHA2的si-RNA下调EPHA2表达后进行成骨分化诱导,检测下调EPHA2表达对早期成骨分化指标ALP活性及晚期成骨分化指标钙沉积、成骨分化标志物OSX 、OCN和成骨分化关键转录因子RUNX2表达的影响。结果: EPHA2在hBMSC成骨分化过程中表达逐渐上升,下调EPHA2表达能抑制ALP活性和钙沉积,抑制OSX、OCN及关键转录因子RUNX2的表达。结论: EPHA2在hBMSC成骨分化过程中表达逐渐上升,EPHA2可能通过增强RUNX2的表达从而促进hBMSC成骨分化。
EPHA2;人骨髓间充质干细胞;成骨分化;RUNX2
人骨髓间充质干细胞(human bone marrow mesenchymal stem cells,hBMSC)来源于发育早期的中胚层,是一种具有自我更新能力和多向分化潜能的成体干细胞[1]。由于hBMSC获取容易、易于体外培养和连续传代,冷冻保存后仍具有多向分化潜能,使其成为理想的种子细胞广泛用于再生医学研究[2]。骨缺损是临床上常见的骨骼系统疾病,严重危害患者的生活质量,以间充质干细胞为细胞源的骨再生工程为这些患者带来了新的希望。BMSC成骨分化受多种信号通路调控,最近的研究发现,ephrin-Eph信号通路在成骨分化中发挥着重要的作用[3]。在小鼠BMSC成骨分化过程中,ephrin-Eph信号通路配体ephrinA5/B1/B2和受体EPHA2/B2/B4/B6表达显著上升[4],该通路其它配体和受体在成骨分化特别是hBMSC成骨分化中的作用尚不清楚[5]。EPHA2是一个分子量为130 kDa的跨膜糖蛋白,能够通过AKT、FAK、MAPK等多条信号通路促进多种肿瘤的恶性进展[6]。研究发现EPHA2在小鼠成骨细胞中表达,且在小鼠BMSC成骨分化过程中表达上升,提示其在成骨分化中可能发挥重要的作用[7]。基于此,本研究以hBMSC为模型,研究EPHA2在hBMSC成骨分化中表达的动态变化及其在成骨分化中的作用。
1 材料方法
1.1 材料
α-MEM培养基购自Gibco公司,胎牛血清为杭州四季青公司产品,si-EPHA2、Lipofectamine 2000转染试剂和RNA提取试剂TRIzol购自Invitrogen公司,SYBR Premix ExTaq M定量PCR试剂为大连宝生物公司产品,EPHA2、RUNX2、OSX和OCN抗体购自CST公司,Tubulin抗体购自Santa Cruz公司,碱性磷酸酶(alkaline phosphatase,ALP)检测试剂盒购自南京建成生物研究所,茜素红S (Alizrin Red S)为Sigma公司产品。
1.2 人骨髓间充质干细胞的分离、培养和成骨诱导
经伦理委员会批准和本人签署知情同意书,hBMSC取自一位32岁健康男性志愿者,采用密度梯度离心法获取hBMSC,在加有双抗的含10%胎牛血清的α-MEM培养基中培养。本实验使用的hBMSC均为第4代。成骨分化诱导时,将hBMSC接种至6孔板中,待细胞密度长至60%左右时加入成骨诱导分化液(10%胎牛血清的α-MEM培养基中加入10 mmol/L β-磷酸甘油钠、50 mg/L维生素C和0.1 μmol/L地塞米松),3 d换液1次。
1.3 Real-time PCR
在成骨分化的第0、4、10和14 天收集细胞,按TRIzol试剂盒说明书提取细胞RNA,反转录后进行Real-time PCR。Real-time PCR按照SYBR Premix Ex Taq试剂盒说明书进行,反应体系如下:SYBR Premix Ex Taq 10 μL、cDNA 1 μL、上游引物 1 μL、下游引物 1 μL,加H2O 7 μL补至20 μL,反应在Applied Biosystems公司的7900HT Fast Real-time PCR system上进行,每一样品均设3个重复孔,以GAPDH作为内参。EPHA2引物序列:Forward GGGACCTGATGCAGAACATC, Reverse AGTTGGTGCGGAGCCAGT。RUNX2引物序列:Forward TCTTAGAACAAATTCTGCCCTTT, Reverse TGCTTT
GGTCTTGAAATCACA。OSX引物序列:Forward CCTCCTCAGCTCACCTTCTC,Reverse GTTGGGAGCCCAAATAGAAA。OCN引物序列:Forward AGCAAAGGTGCAGCCTTTGT,Reverse GCGCCTGGGTCTCTTCACT。GAPDH引物序列:Forward GAAGGTGAAGGTCGGAGTC,Reverse GAGATGGTGATGGGATTTC。
1.4 Western blot 分析
在成骨分化的第0、4、10和14 天收集细胞,提取蛋白,蛋白定量后加入5×SDS沸水浴5 min,进行SDS-PAGE 电泳、转膜,然后使用5%的脱脂奶粉进行封闭,1 h后加入相应一抗4 ℃孵育过夜,TBST 洗膜3 次后加入辣根过氧化物酶偶联的二抗,孵育2 h后用TBST 洗膜3 次,加入ECL发光剂显色3 min后压片显影。
1.5 siRNA转染
转染前1天接种细胞,使第2天细胞密度达到50%左右为宜。转染前1 h更换不含血清和抗生素的培养基,转染时将稀释的Lipofectamine 2000和siRNA(50 nmol/L)充分混匀室温静置20 min后加入培养皿中,培养12 h后更换正常培养基,24 h后进行成骨诱导分化。
1.6 ALP活性检测
hBMSC成骨分化第4天,吸除培养板中的培养液,PBS洗2遍后,按ALP试剂盒说明书进行ALP活性检测,用酶标仪测出各孔吸光度值,同时采用BCA法检测细胞内总的蛋白量,用以校正ALP活性。每组样品重复3次。
1.7 钙盐沉积实验
hBMSC成骨分化第14天,弃去培养基后使用PBS洗2遍,戊二醛固定后使用ddH20清洗3次后加入0.4%茜素红S,光镜下观察,待出现红色物质堆积时后弃去染液,使用ddH20终止反应和洗涤,显微镜下拍照。为了定量检测钙盐沉积,染色后加入冰乙酸在摇床上孵育30 min,刮下后于85℃水浴10 min,冰上5 min,高速离心后15 min,取400 加入10%NH4OH,将pH调到4.5后,用酶标仪于405 nm处测吸光度值,每组样品重复3次。
1.8 统计学分析
所有数据均使用SPSS统计软件进行统计学分析,数据以均值±标准差表示,组间比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 EPHA2在hBMSC成骨分化过程中的表达
Real-time PCR及Western blot检测结果显示,在hBMSC成骨分化过程中,EPHA2的mRNA及蛋白表达水平逐渐上升,见图1。
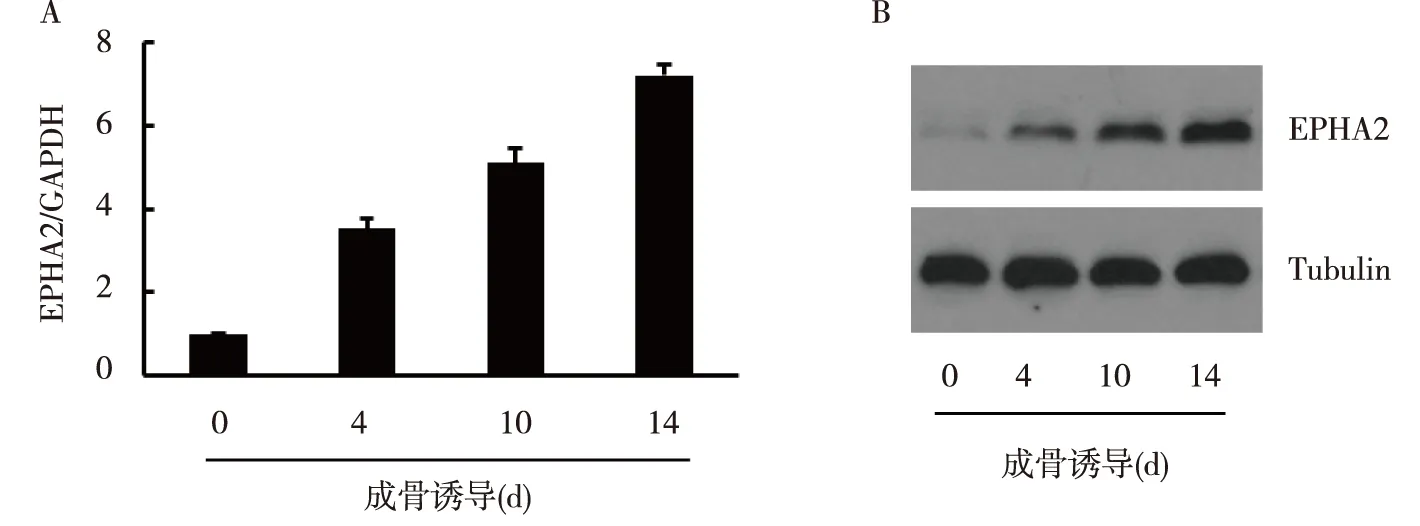
注:A为Real-time PCR检测结果,B为Western blot检测结果
2.2 si-RNA下调hBMSC中EPHA2的表达
用EPHA2的si-RNA转染hBMSC 48 h后收集细胞,EPHA2的 RNA和蛋白水平明显下调,见图2。
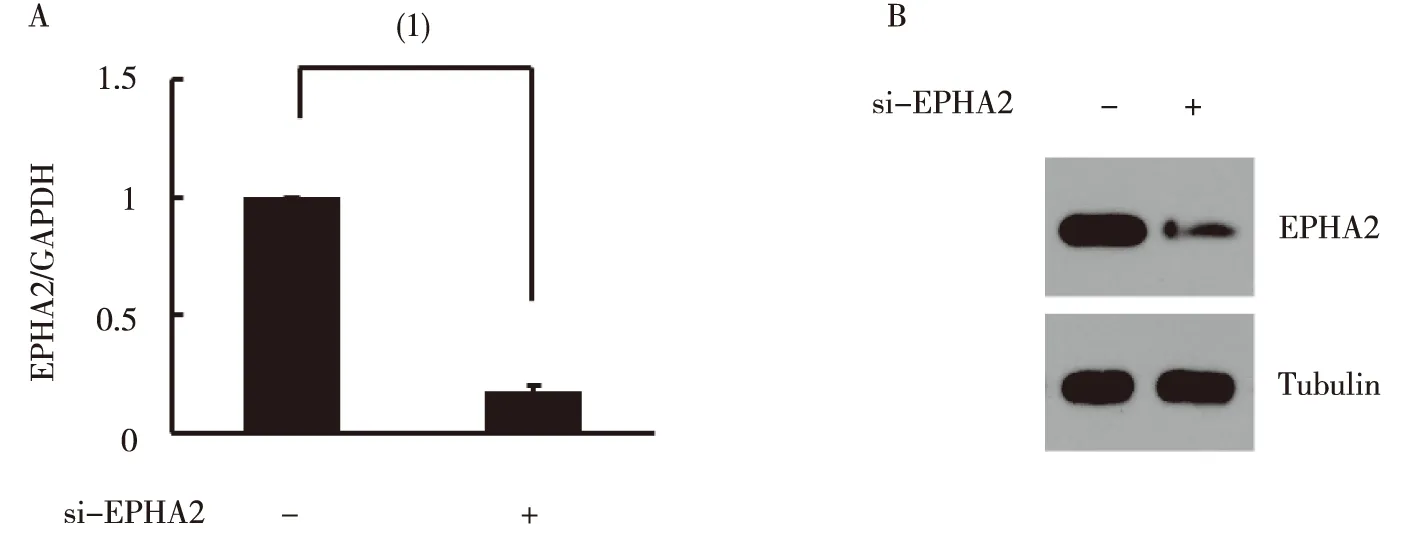
注:A为Real-time PCR检测结果,B为 Western blot检测结果;(1)两组比较,P<0.05
2.3 EPHA2表达下调对hBMSC成骨分化的影响
在hBMSC成骨分化的第4天下调EPHA2表达显著抑制了ALP活性,随后在hBMSC成骨分化的第14天下调 EPHA2表达显著抑制了钙沉积,见图3。下调EPHA2的水平显著抑制了成骨分化的标志物OSX和OCN mRNA及蛋白的表达,见图4。下调EPHA2的水平显著抑制了成骨分化关键转录因子RUNX2 mRNA及蛋白的表达,见图4。
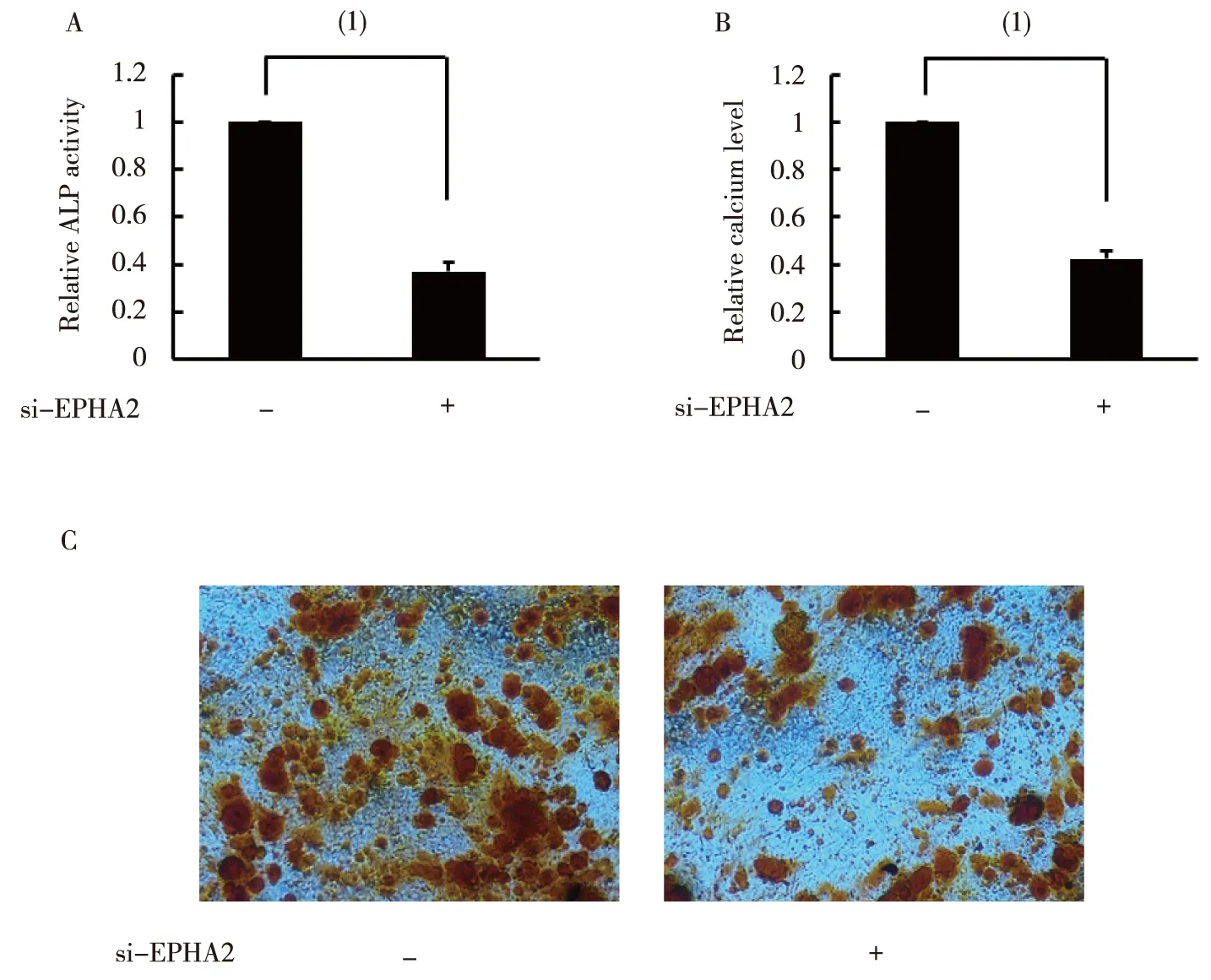
注:A为ALP活性,B为钙盐沉积的定量,C为显微镜下钙盐沉积;(1)两组比较,P<0.05
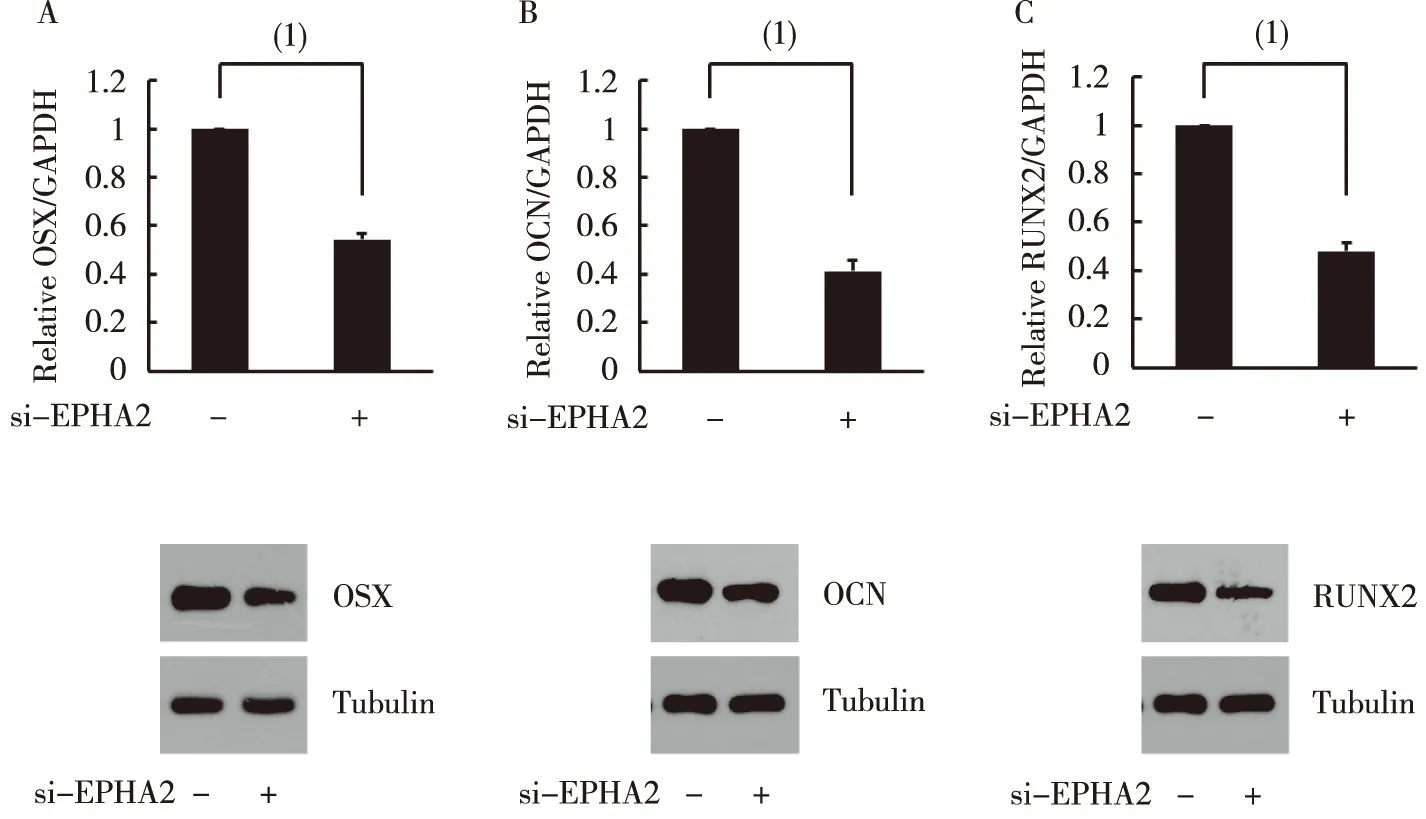
(1)两组比较,P<0.05
3 讨论
Ephrin-Eph信号通路由配体Ephrin和受体Eph组成, 配体Ephrin表达在细胞膜,包含一个保守的胞外受体结合区,在人体中已经发现5种EphrinA配体(EphrinA1- EphfinA5)和3种EphrinB配体(EphrinB1-EphrinB3);受体Eph连接酪氨酸激酶,由胞外区、跨膜区及胞内区组成,在人体中已经发现9种EphA受体(EphA1-EphA8和EphA10)及5种EphB受体(EphB1-EphB4和EphB6)[8]。由于配体Ephrin和受体Eph均位于细胞膜表面,因此细胞与细胞之间的相互作用是启动Ephrin-Eph信号通路的主要途径。研究发现,Ephrin-Eph信号通路在神经系统发育、内皮细胞发生和肿瘤发生过程中均发挥着重要的作用,最近越来越多的研究也表明Ephrin-Eph信号通路在骨发生和稳态中也发挥着重要的作用[9]。研究表明,EphrinB2在破骨细胞中表达,而EphB4在成骨细胞中表达,成骨细胞中EphB4通过与破骨细胞中EphrinB2相互作用激活破骨细胞中的反式Ephrin-Eph信号通路从而抑制破骨细胞祖细胞分化为破骨细胞,而破骨细胞中EphrinB2通过与成骨细胞中EphB4相互作用激活成骨细胞中的顺式Ephrin-Eph信号通路从而促进成骨分化[10]。体外研究也发现,过表达EphrinB2能够促进成骨分化[11]。然而目前的研究主要集中在EphrinB配体和EphB受体在成骨分化中的作用,对于EphrinA配体和EphA受体在BMSC成骨分化中的作用研究很少,因此本实验研究了EPHA2在hBMSC成骨分化中表达的动态变化及其在成骨分化中的作用。
本研究发现,在hBMSC成骨分化过程中,EPHA2的表达逐渐上升,提示其可能在hBMSC成骨分化过程中发挥重要作用。为了研究EPHA2在成骨分化中的作用,用si-RNA下调hBMSC中EPHA2的表达后进行成骨分化诱导,在成骨分化第4天, EPHA2的表达下调显著抑制了早期成骨分化指标ALP活性;在在成骨分化第14天,下调EPHA2的表达显著抑制了晚期成骨分化指标钙沉积;进一步在分子水平上发现下调EPHA2的水平能够抑制成骨分化标志物OSX和OCN及成骨分化关键转录因子RUNX2的表达,初步揭示了EPHA2调控hBMSC成骨分化的机制。本研究首次探索了EPHA2在hBMSC成骨分化中的作用,丰富了Ephrin-Eph信号通路在成骨分化中的作用研究,为hBMSC体外高效成骨分化提供了理论基础。
[1] 王承云,石磊,夏春,等.人骨髓间充质干细胞分离培养方法的改进[J].中国组织工程研究与临床康复, 2011(32):5896-5900.
[2] 李萍华,刘钰瑜,崔燎.骨髓间充质干细胞成脂和成骨分化过程中Wnt信号通路的调控效应[J].中国组织工程研究与临床康复, 2010(10):1749-1754.
[3] 张新昌,张西正.骨髓间充质干细胞成骨分化相关通路的研究进展[J].医学综述, 2013(21):3853-3856.
[4] Fagotto F,Winklbauer R,Rohani N.Ephrin-Eph signaling in embryonic tissue separation[J].Cell Adh Migr, 2014(4):308-326.
[5] Sims NA.EPHs and ephrins:many pathways to regulate osteoblasts and osteoclasts[J].IBMS BoneKEy, 2010(9):304-313.
[6] 郑俊青,安聪娟,方艳伟.EphA2/ephrinA1与人脑胶质瘤发生的关系及靶向治疗潜能探讨[J].中国肿瘤临床, 2013(8):486-488.
[7] Posthumadeboer J,Piersma SR,Pham TV,et al.Surface proteomic analysis of osteosarcoma identifies EPHA2 as receptor for targeted drug delivery[J].Br J Cancer, 2013(8): 2142-2154.
[8] 袁长永,朱绍跃,王鹏来,等.EphB4-EphrinB2通路的研究进展及应用[J].口腔医学, 2014(6):467-469.
[9] Klein R,Kania A.Ephrin signalling in the developing nervous system[J].Current opinion in neurobiology, 2014(27):16-24.
[10]Jin S,Yan Z,Tieyi Y,et al.Eph-ephrin bidirectional signalling:A promising approach for osteoporosis treatment[J].Journal of Medical Hypotheses and Ideas, 2013(2):40-42.
[11]Li Cl,Shi Cl,Kim J,et al.Erythropoietin promotes bone formation through EphrinB2/EphB4 signaling[J].J Dent Res, 2015(5):455-463.
(2015-03-09收稿,2015-04-25修回)
中文编辑: 周 凌;英文编辑: 周 凌
The Role of EPHA2 in Osteogenic Differentiation of Human Bone Marrow Mesenchymal Stem Cells
SUN Bo1, ZHANG Tao2, YANG Long1, LI Jing1, REN Houxiang1, SUN Qi1, WANG Jianji1, YE Chuan1
(1.GuiyangMedicalCollege,Guiyang550004,Guizhou,China; 2.DepartmentofOrthopedics,the117thHospitalofPLA,Hangzhou311201,Zhejiang,China)
Objective: To investigate the dynamic changes of EPHA2 expression in the osteogenic differentiation of human bone marrow mesenehymal stem cells(hBMSC) and the role of EPHA2 in the osteogenic differentiation. Methods: Cells were harvested on day 0, day 4, day 10 and day 14 during induction of osteogenic differentiation, RNA and protein was extracted and detected with Real-time PCR and Western blot analysis. siRNA for EPHA2 was used to silence the expression of EPHA2. Alkaline phosphatase (ALP) activity, calcium deposition, and the levels of OSX , OCN, RUNX2 were detected to observe the effect of EPHA2 on the osteogenic differentiation of hBMSC. Results: The expression of EPHA2 increased gradually in hBMSC osteogenic differentiation process. Down-regulation of EPHA2 inhibited ALP activity, calcium deposition and the expression of OSX, OCN and RUNX2 in hBMSC. Conclusions: The level of EPHA2 increases gradually in hBMSC osteogenic differentiation process, and EPHA2 can promote hBMSC osteogenic differentiation process through enhancing the expression of RUNX2.
EPHA2;human bone marrow mesenchymal stem cells;osteogenic differentiation;RUNX2
国家自然科学基金资助项目(81360232); 贵州省卫生厅资助项目(gzwkj2010-1-042); 贵州省国际科技合作项目(黔科合外G字2010-7); 贵州省科技厅社发联合基金项目(黔科合20103166)
时间:2015-05-21
http://www.cnki.net/kcms/detail/52.5012.R.20150521.1227.005.html
R318.17
A
1000-2707(2015)05-0433-05
**贵阳医学院2012级硕士研究生
***通信作者 E-mail:yechuanchina@hotmail.com

