山羊Lcn 5的表达特点及其在繁殖器官中定位
任有蛇,郭丽娜,张春香,张国林,夏龙钢,乔利英,靳 黎,刘文忠
(山西农业大学动物科技学院,太谷 030801)
山羊Lcn 5的表达特点及其在繁殖器官中定位
任有蛇#,郭丽娜#,张春香*,张国林,夏龙钢,乔利英,靳 黎,刘文忠
(山西农业大学动物科技学院,太谷 030801)
为探明附睾视黄酸结合蛋白5(Lcn 5)mRNA在公山羊体组织及不同月龄附睾中的表达特性,及其在睾丸、附睾和精子中的定位。采用实时荧光定量PCR方法检测18种组织和不同月龄附睾Lcn5 mRNA表达规律;利用蛋白印迹技术对成年公羊睾丸和附睾Lcn 5蛋白表达进行定量分析;利用免疫组化技术对5月龄公羊睾丸和附睾Lcn 5进行定位,利用免疫荧光技术对精子Lcn 5进行定位。Lcn5 mRNA在不同组织中均有表达,其中在性腺中的表达量最高,附睾头>附睾尾>附睾体>睾丸;在5月龄前附睾的Lcn5 mRNA表达量随月龄逐渐升高,5月龄时达到最高,随后又逐渐降低。Western blotting 结果显示,Lcn 5蛋白表达量:附睾头>附睾尾>附睾体>睾丸,支持了Lcn5 mRNA定量的结果。免疫组化结果显示,5月龄山羊在附睾管壁的柱状细胞、纤毛细胞检测到较强Lcn 5蛋白表达的阳性信号,附睾尾管腔检测到较强的阳性信号。在睾丸各级生精细胞中也检测到了微弱阳性信号。Lcn 5蛋白包裹在精子头部顶体帽上。Lcn5在山羊附睾中高度表达,其表达具有时空特异性,推测其在精子成熟和维持正常生理功能方面发挥重要作用,其生物学功能需要进一步深入研究。
Lcn5;表达特性;定位;睾丸;附睾;公山羊
Lipocalin蛋白家族是由一些分泌型小分子蛋白质(160~180个氨基酸残基)组成,其成员遍布于细菌、植物、脊椎动物和无脊椎动物体中[1]。不同物种之间该家族成员序列相似性低,但却具有相似的高度对称的疏水性β-桶型结构[2],能与疏水性小分子配体结合[3],也能与可溶性高分子形成复合物,还可与相应的膜受体结合[4]。因此,Lipocalins在体内参与维生素A转运、前列腺素免疫应答、细胞生长与代谢调控等多种生理活动[5-8],还可能与精子的成熟及贮存有关[9]。啮齿动物附睾分泌的Lipocalin 5(Lcn 5)可结合类维生素A,可能在附睾中通过转运视黄酸(VA前体)来维持附睾上皮细胞完整性,是雄性生殖生理重要调节因子[10],同时有部分抗炎症功能[7]。小鼠Lcn5 mRNA最初仅在附睾头中/远端的主细胞中检测到[11],后又在附睾上皮细胞、附睾体和尾管腔中检测到[12],由体部到尾部逐渐增加,最后在附睾尾中集聚[13]。B.Guyonnet等[14]用基因芯片和琼脂糖电泳检测到在成年公猪附睾头、体和尾部均有Lcn5 mRNA表达。张春香等[15]研究结果显示,山羊附睾头中表达有8种Lipocalins,其中检测附睾头中Lcn5表达量最高,然而目前还未见有关于山羊Lcn5表达特点及其蛋白定位研究的报道。本研究采用qRT-PCR技术分析了公山羊18种组织中及不同月龄附睾Lcn5表达特性,用Western blotting、免疫组织化学、细胞免疫荧光等方法对睾丸与附睾中Lcn 5进行蛋白表达量分析及其定位,为探讨其对精子成熟的生物学作用提供依据。
1 材料与方法
1.1 试验材料和主要试剂
1.1.1 试验动物及样品制备 选用体重相近健康的晋岚绒山羊公羊,由山西农业大学动物科技试验站提供。分别对7日龄、2、3、4、5、6、9月龄各4只公山羊实施阉割手术,从每只羊的睾丸、附睾头、附睾体和附睾尾的相同部位采集样品;4只成年公羊采集精液2次后,采用颈静脉放血致死,分别采集生殖器官:睾丸、附睾头、附睾体、附睾尾、前列腺;呼吸器官:气管、肺;消化器官:皱胃、十二指肠、胆囊;泌尿器官:肾、膀胱、输尿管;其他器官:脾、肾上腺、甲状腺、小脑、视网膜等相同部位的样品。放入DEPC处理过的冻存管中,投入液氮中,然后转移到-80 ℃冰箱中保存备用。取5月龄公羔附睾头、体、尾和睾丸,切成0.5 cm×0.5 cm×0.2 cm组织块,放入4.0%的多聚甲醛溶液中,处理24 h进行固定。用0.01 mol·L-1PBS(pH7.4)洗涤3次,然后用梯度酒精脱水,进行包埋,做连续切片,厚度5 μm,以备免疫组化分析。
1.1.2 主要试剂和仪器 总RNA提取(RNAiso Plus)、反转录(SYBR PrimeScript TM RT Reagent Kit)和荧光定量(SYBR Premix Ex TaqTM)试剂盒均购自宝生物工程(大连)有限公司。Rabbit Anti-Lcn 5一抗由北京天成新脉生物技术有限公司制备。即用型SABC免疫组织化学试剂盒、生物素标记的鼠抗兔二抗和黄色DAB显色试剂盒(武汉博士德生物工程有限公司)。Real-time PCR仪(Mx 3000)、智能生物包埋机(EG 1150 H,Leica)、电脑切片机(M 60,Leica)、展片机(HI 1210,Leica)、摊片机(HI 1220,Leica)、荧光显微镜(BX 53,Olympus)、核酸蛋白测定仪(NanoDrop-1000,北京)、半干转膜仪(Bio-RAD)。
1.2 试验方法
1.2.1 总RNA提取 按RNAiso Plus试剂盒说明书提供的步骤提取组织总RNA。用核酸蛋白测定仪测定总RNA的浓度和纯度,然后用琼脂糖凝胶电泳检测RNA完整度。检测合格的RNA-80 ℃保存。
1.2.2 cDNA合成 按照RT Reagent Kit的说明书建议的10 μL反转录体系:5×PrimeScript Master Mix(Perfect Real Time) 2 μL,Total RNA模板500 ng,随机引物0.5 μL,加RNase Free ddH2O至10 μL;反应条件:37 ℃ 15 min,85 ℃ 5 s;反转录产物用核酸蛋白测定仪测定浓度后,-20 ℃保存。
1.2.3 引物设计与合成 以18SrRNA作为Real-time PCR的内参基因,根据NCBI在线网站GenBank 数据库中山羊Lcn5(No.KJ508082)序列,利用Primer Premier 5.0 软件分别设计18S rRNA和Lcn 5两对特异性引物(表1),应用NCBI网站在线Primer-blast程序检测引物的特异性,送北京六合华大基因科技股份有限公司合成。
表1 引物序列
Table 1 Primer sequences

基因名称Genename引物序列(5'-3')Primersequence产物长度/bpProductslengthLcn5F:AGAACCAGGCAGTGAAGGG,R:TGACGGCGTAGGTCTTGTAG10718SrRNAF:CAGACAAATCACTCCACCAA,R:GAAGGGCACCACCAGGAGT117
1.2.4 常规RT-PCR检测 常规RT-PCR检测15 μL体系:dNTP Mixture 1.2 μL,10×PCR Buffer 1.5 μL,正反向引物各0.5 μL,TaqDNA聚合酶0.3 μL,山羊组织 cDNA模板1 μL,ddH2O 10 μL,反应条件:94 ℃3 min,94 ℃30 s,59 ℃30 s,72 ℃20 s,35个循环;72 ℃5 min,用3%琼脂糖凝胶电泳检测PCR产物。
1.2.5 荧光定量标准曲线的绘制和体组织mRNA定量分析 用20 μL反应体系:SYBR Premix Ex TaqTM10 μL,Rox Reference Dye Ⅱ 0.4 μL,正反向引物各0.8 μL,cDNA模板2.0 μL,ddH2O 6.0 μL。将附睾头cDNA稀释2倍,共8个梯度,阴性对照为无模板的空白管。扩增条件:95 ℃ 10 s,95 ℃ 5 s,60 ℃ 35 s,共40 个循环,软件自动绘制标准曲线。Lcn5 mRNA定量分析时,每个样本重复3 次,收集和导出Ct值。
1.2.6 免疫组化和精子免疫荧光分析 免疫组化的步骤参照文献[16]。在封闭后,滴加稀释倍数1∶50的Rabbit Anti-Lcn 5抗体(阳性),用PBS代替一抗(阴性对照),湿盒内4 ℃过夜;37 ℃复温40 min,PBS冲洗;再用生物素标记的鼠抗兔二抗37 ℃孵育(免疫组化),或加FITC标记二抗37 ℃孵育(精子免疫荧光),30 min后,PBS冲洗;滴加SABC后,37 ℃孵育30 min,然后用黄色DAB显色(免疫组化)或绿色荧光染色(精子免疫荧光);苏木精复染后,封片,观察拍照。
1.2.7 Westrn blotting分析 称取冰冻的睾丸、附睾头、附睾体和附睾尾各100 mg放入盛有液氮的研钵中磨碎,将粉末状组织转移至1.5 mL EP管中,按照说明书加入哺乳动物蛋白裂解液和PMSF,于室温用polytron匀浆机高速匀浆30 s,4 ℃过夜,
由表2可知,干预后全院及各临床科室日均领药次数和领药时间均较干预前大幅下降,差异均有统计学意义(P<0.05或P<0.01);其中,全院日均领药次数降幅为53.4%,全院日均领药时间降幅为74.5%。这说明干预措施能够有效改善领药过于频繁、领药耗时长的现象。由于妇科为新设立科室,故无干预前数据,但干预后其日均领药次数和领药时间数据表明优化后的流程可良好地适用于新增设科室。
3 000 r·min-1离心10 min,用BCA法测定蛋白的含量。SDS-PAGE制备:4.0%浓缩胶和10%分离胶在98 ℃变性10 min;蛋白上样量100 μg,浓缩胶稳压80 V 1 h,分离胶120 V 2 h,然后使用半干转膜仪转膜至NC膜,根据蛋白Marker条带将膜分为两片,分别用5%脱脂奶粉封闭1.5 h,再滴加1∶1 000稀释Rabbit Anti-Lcn 5 多克隆抗体和Mouse Antiβ-actin内参抗体孵育,4 ℃过夜。再加入辣根过氧化物酶偶联的驴抗兔(1∶5 000稀释)和Goat Anti-Mouse(1∶2 000稀释)二抗室温孵育2 h。用数码凝胶图像分析系统做条带密度扫描,并测定灰度值。1.2.8 统计分析 用EXCEL 7.0 整理数据,设定Lcn5在成年公羊附睾头中的相对表达量为1,用SPSS 17.0软件进行单因素方差分析及显著性检验。
2 结 果
2.1 总RNA质量鉴定和RT-PCR检测
经核酸蛋白测定仪测定山羊各组织总RNA的A260 nm/A280 nm值均为1.8~2.0,1.5%琼脂糖凝胶电泳检测总RNA结果见图1。图1显示28S、18S和5S条带清晰,说明RNA无降解,可以进行反转录。图2是18种组织的Lcn5基因PCR扩增产物的3%电泳检测结果,从图可以看出,附睾头、附睾尾和睾丸的条带较粗亮。其余组织的条带亮度较浅。
图1 总RNA电泳图Fig.1 Electrophoresis of total RNA
2.2 体组织Lcn5 mRNA定量分析结果
2.2.1 定量标准曲线的建立 图3 A是Lcn5和18SqRT-PCR的扩增动力学曲线,其重复性好,平行性较好,拐点清楚。图3 B为软件自动绘制的标准曲线,从图3B可看出,Lcn5和18SmRNA有良好的线性关系,回归系数分别为0.999和0.998,扩增效率100 %以上;图3 C为熔解曲线,从图3 C可看出基线平稳,呈单一峰值,没有引物二聚体和非特异性扩增产物。说明本研究的定量检测方法有效。
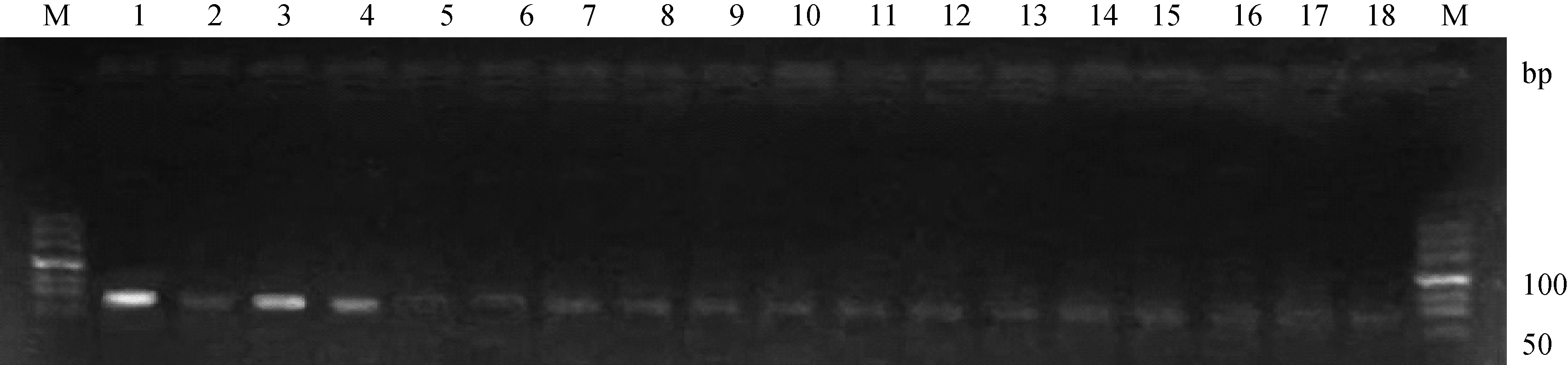
1~18.附睾头、附睾体、附睾尾、睾丸、输尿管、甲状腺、前列腺、脾、气管、肾、皱胃、十二指肠、肺、视网膜、膀胱、小脑、肾上腺和胆囊,下同。M.DNA相对分子质量标准DL5001-18.Epididymidis head,epididymidis body,epididymidis tail,testis,ureter,thyroid gland,prostate,spleen,trachea,kidney,abomasum,duodenum,lung,retina,urinary,cerebellum,adrenal gland,gall bladder,the same as Fig.4;M.DL500 marker图2 公山羊各组织Lcn5的PCR产物电泳Fig.2 PCR results of Lcn5 mRNA from different tissues in bucks
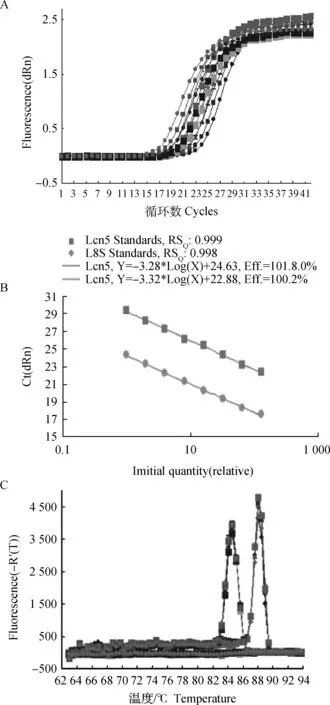
A.18S rRNA 和Lcn 5扩增动力学曲线;B.标准曲线; C.扩增产物熔解曲线A.PCR amplification plots for 18S rRNA and Lcn5;B.Their standard curves;C.Their dissociation curves图3 18S rRNA及 Lcn 5扩增的动力学曲线、标准曲线和熔解曲线Fig.3 PCR amplification plots,standard and dissociation curves for 18S rRNA and Lcn 5
2.2.2 公山羊不同组织Lcn5 mRNA的表达差异 用内参18SrRNA对公山羊不同组织中Lcn5 mRNA的表达量进行校正,其荧光定量分析结果见图4。从图4可看出,Lcn5 mRNA在公山羊附睾中的表达量显著高于睾丸中的表达量(P<0.05),极显著高于气管、消化道、腺体和小脑等其他组织中的Lcn5 mRNA表达量(P<0.01)。睾丸中Lcn5 mRNA表达量显著高于其他组织(P<0.05)。而其他各组织之间Lcn5 mRNA表达量差异不显著(P>0.05)。
2.2.3 不同月龄公山羊附睾中Lcn5 mRNA的表达差异 采用RT-PCR技术对不同月龄的公山羊睾丸和附睾中Lcn5 mRNA表达进行了定量分析,结果如图5所示。在5月龄前附睾头部、体部和尾部的Lcn5 mRNA表达量随月龄逐渐升高,5月龄时达到最高,随后又逐渐降低,5月龄附睾头部、体部和尾部的Lcn5 mRNA表达量显著高于7日龄和18月龄(P<0.05)。同时纵向比较发现在附睾中Lcn5 mRNA的表达量次序:附睾头>附睾尾>附睾体,除18月龄时附睾头与附睾体Lcn5 mRNA的表达量不显著(P>0.05),其余各年龄点附睾头Lcn5 mRNA表达量显著高于附睾体(P<0.05)。
2.3 睾丸和附睾中的Lcn 5蛋白表达差异
2.4 Lcn 5在睾丸、附睾和精子中的定位
2.4.1 Lcn 5在睾丸和附睾的表达定位 Lcn 5在睾丸及附睾头、体、尾部的免疫组化定位结果见图7。从图7 A可以看出山羊睾丸的各级生精细胞中均检测到弱阳性信号。从图7 C和图7 E看附睾头和附睾体假复层纤毛柱状上皮细胞中高柱状纤毛上皮细胞和游离缘的纤毛中均检测到强阳性信号,而且附睾体管腔中也检测到强阳性信号。从图7 G看附睾尾的柱状上皮细胞中Lcn 5蛋白信号很弱,而在游离缘的纤毛和管腔中信号非常强。这表明Lcn 5可能是分泌型蛋白,在附睾尾管腔中聚集。
2.4.2 Lcn 5在精子中的定位 Lcn 5蛋白在精子中的定位见图8。从图8可以看出,Lcn 5蛋白包裹在精子头部顶体上,尤其是顶体帽上Lcn 5蛋白信号较强。精子头部下段、精子体部、尾部的主段和末端均没有Lcn 5蛋白信号。
3 讨 论
附睾和精子中均富含视黄酸[17],Lcn 5是视黄酸转运载体,因此在维持附睾和精子的正常生理功能中发挥重要作用。与小鼠Lcn 5分布于同一染色体上的Lipocalin蛋白家族均表现出分布区域的特异性,例如,Lcn 8在附睾起始端和附睾头部远端表达[18];PTGDS蛋白主要在睾丸输出小管和头部远端表达[19]。另外,张春香等[15]对附睾头的转录组测序结果发现,在山羊附睾头中表达有7种Lipocalins,其中Lcn5 mRNA表达量最高。因此,进一步深入研究了Lcn5 表达特性及其定位情况。
3.1 公山羊体组织Lcn5 mRNA和蛋白表达特点
3.1.1 公山羊体组织Lcn5 mRNA表达特点 J.J.Lareyre等[12]研究结果显示,家鼠Lcn5 mRNA的表达具有附睾特异性,且仅在中/远端附睾头表达,由近远端附睾头分泌到管腔液中。而M.Silvbana等[11]研究结果表明,小鼠Lcn5 mRNA在附睾头部末端表达,尾部聚集。B.Guyonnet等[14]用基因芯片和琼脂糖电泳检测到在成年公猪附睾头、体和尾部均有Lcn5 mRNA表达,基因芯片检测结果显示附睾头部远端Lcn5 mRNA表达量最高;而琼脂糖检测结果显示,在附睾尾部表达量最高,睾丸中没有检测到Lcn5 mRNA表达。而本研究结果显示,在晋岚绒山羊公羊18种体组织中均有Lcn5 mRNA表达,且具有明显的组织差异性,其中在附睾中的表达量最高,其他组织仅有微弱表达,附睾头中Lcn5 mRNA表达量是皱胃等消化器官、膀胱等泌尿系统器官及甲状腺等腺体组织的20~30倍。而在成年公羊附睾中以附睾头Lcn5 mRNA表达量为最高。因此,进一步研究了不同年龄阶段公羊附睾中Lcn5 mRNA表达的特点。
3.1.2 不同发育阶段附睾中Lcn5 mRNA表达特点 附睾中表达的有些基因在生长发育过程中往往呈现出时空特异性表达模式。本研究结果显示,山羊附睾Lcn5 mRNA表达呈现时间特异性。在5月龄前,Lcn5 mRNA表达量随着羔羊月龄的增加而逐渐增加,到5月龄时表达量达到最高,5月龄后,随着月龄增加Lcn5 mRNA表达量又逐渐减少。山羊一般5月龄左右进入初情期,也就是在性活跃期Lcn5 mRNA表达量达到最高。迄今为止还未见关于附睾Lcn5 mRNA发育性表达的研究。然而有与精子成熟相关的Lcn6的发育性变化的研究,Lcn6 mRNA出生3周后的小鼠体内开始出现,并在性活跃期和成年期保持较高的水平,老年以后随时间增长而逐步下降[21]。从本研究结果和Lcn6的研究结果看,这两个基因有可能受雄激素调控,并且与精子的成熟有关。
3.1.3 公山羊体组织Lcn 5 蛋白表达特点 为进一步验证其表达特性,用Wester blotting技术对山羊睾丸和附睾中Lcn 5蛋白的表达进行定量分析,结果显示其蛋白表达量为附睾头>附睾尾>附睾体>睾丸,证实在山羊睾丸和附睾中Lcn 5蛋白表达的规律与Lcn5 mRNA表达规律基本一致。
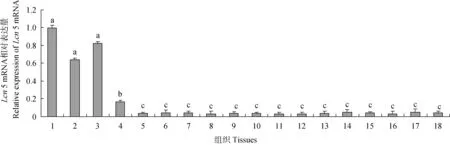
不同小写字母差异显著(P<0.05)。图6同The different small letters were significantly different.The same as Fig.6图4 公山羊不同组织中Lcn 5 mRNA的表达量Fig.4 Lcn 5 mRNA relative expression in different tissues of bucks
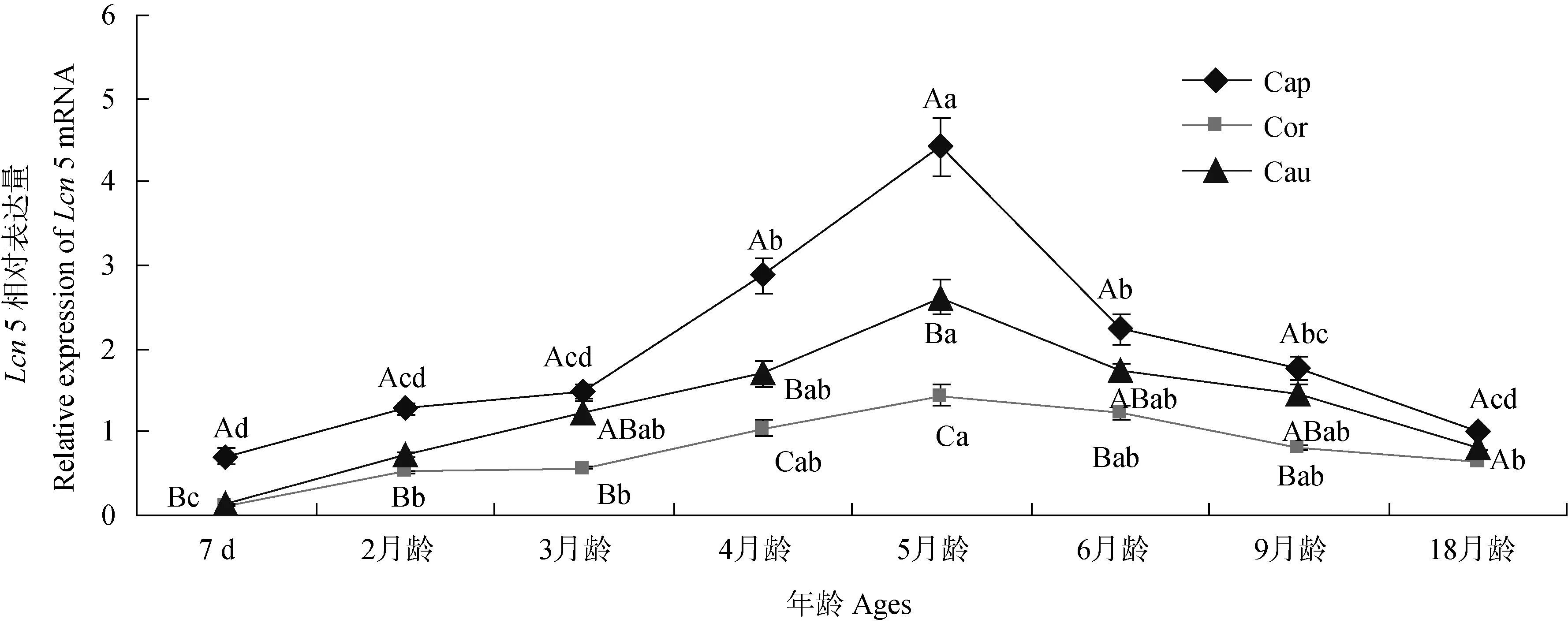
Cap.附睾头;Cor.附睾体;Cau.附睾尾。不同大写字母差异显著(P < 0.05);不同小写字母差异显著(P<0.05)Cap.Epididymidal caput;Cor.Epididymidal corpus;Cau.Epididymidal cauda.The different captical letters were significantly different in the same line;the different small letters were significantly different in the same row图5 不同年龄公山羊附睾中Lcn5相对表达量Fig.5 Lcn 5 mRNA relative expression levels in epididymidis of bucks at different ages
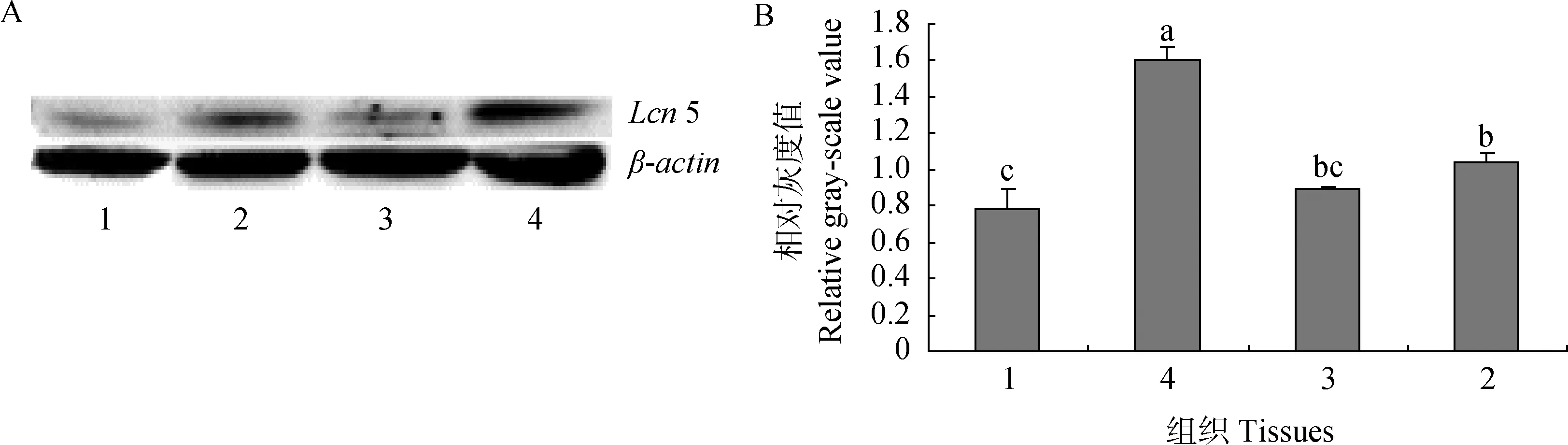
1.睾丸(T);2.附睾尾(Cau);3.附睾体(Cor);4.附睾头(Cap).A.Lcn 5蛋白和β-actin蛋白ECL显色结果;B.Lcn 5蛋白的相对灰度值1.Testes;2.Epididymal cauda;3.Epididymal corpus;4.Epididymal caput.A .Results of Lcn 5 protein and β-actin protein expression in testes and epididymidis of bucks,respectively;B.The relative gray-scale value of Lcn 5 protein图6 山羊睾丸和附睾Lcn 5蛋白的ECL显色结果Fig.6 Results of Lcn 5 protein colored with ECL in testes and epididymidis of bucks
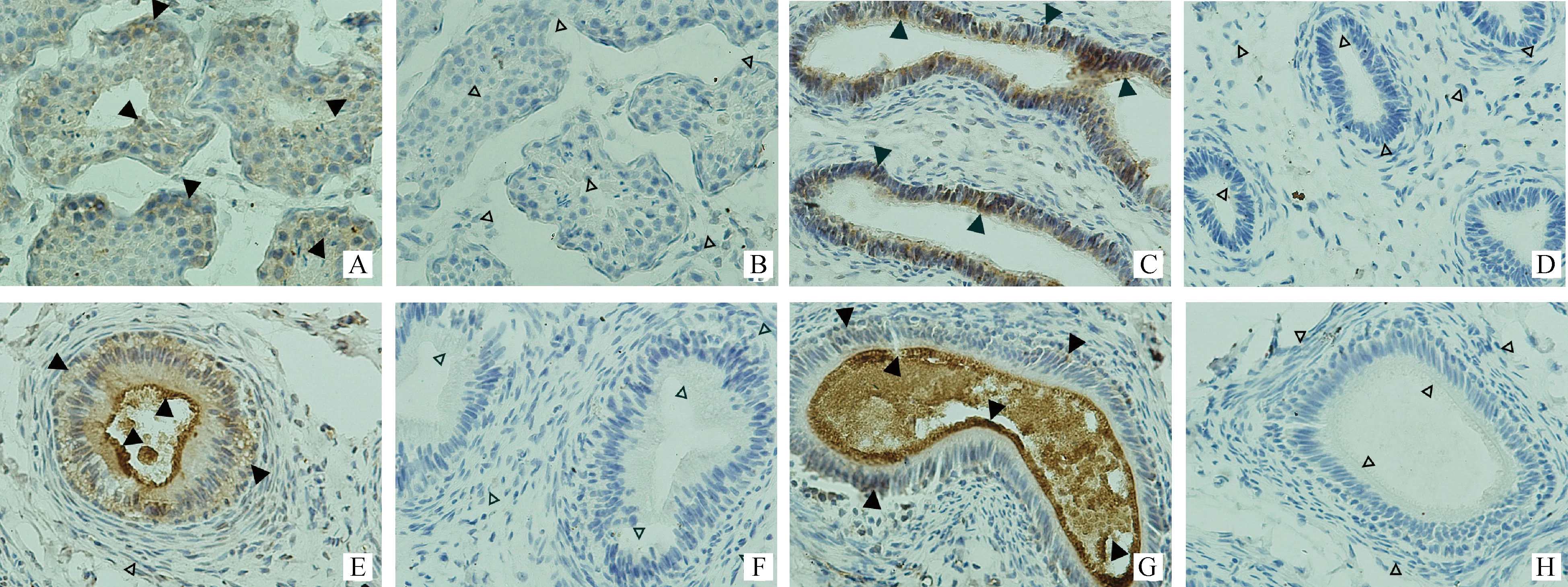
A~H.5月龄公山羊睾丸、附睾头、体和尾免疫组化结果,A、C、E和G为阳性(黄色DAB染色)结果,B、D、F和H为阴性对照。▲.阳性信号;△.无阳性信号A-H .The results of immunohistochemistry in epididymidis head,epididymidis body,epididymidis tail,testes of 5-month-old buck.A,C,E and G.Positive results(They were stained by yellow DAB ),B,D,F and H.Negative control results.▲.The positive signals;△.No positive signals图7 睾丸及附睾Lcn 5免疫组化 400×Fig.7 Immunohistochemistry of Lcn 5 in testes and epididymis 400×
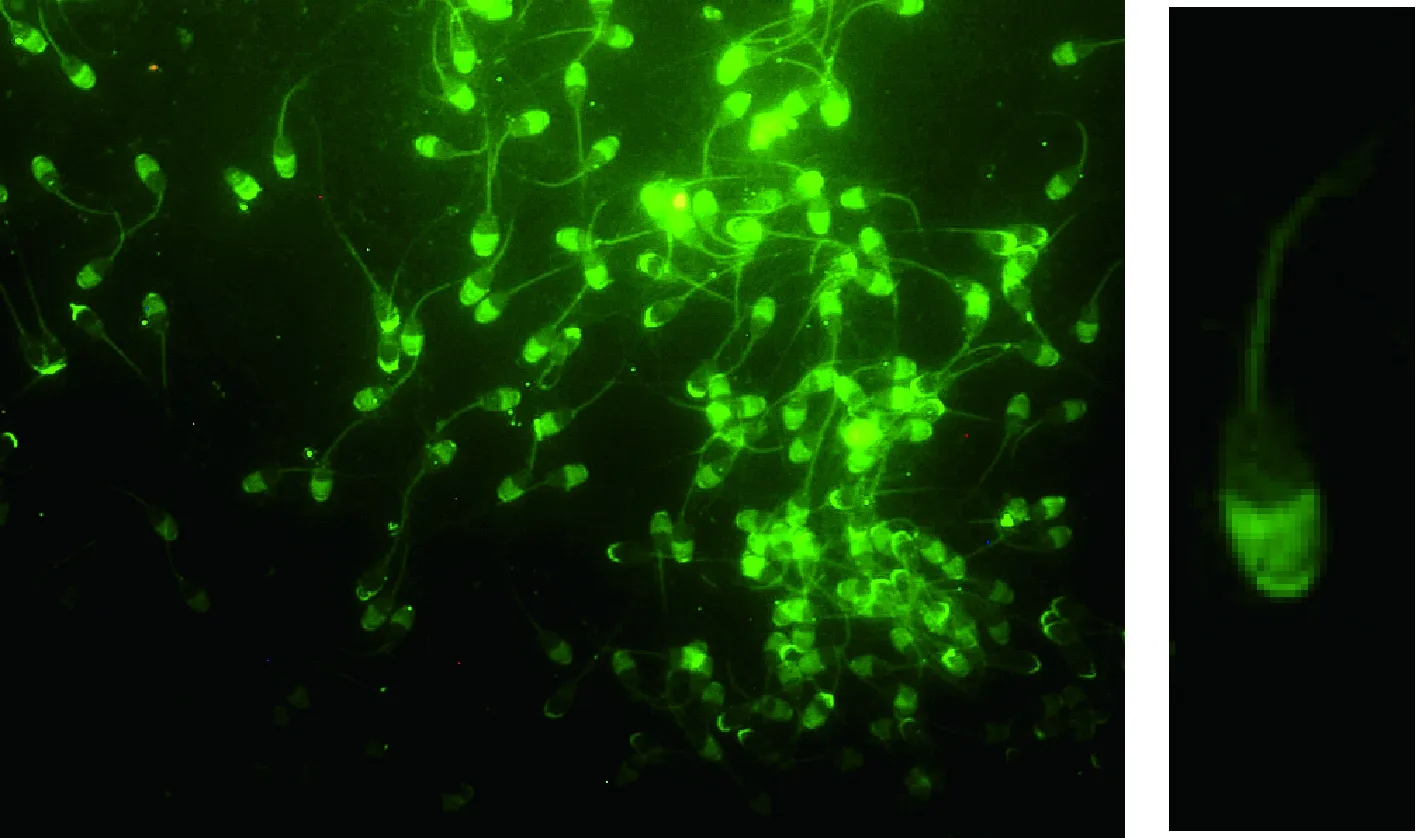
图8 精子Lcn 5蛋白免疫荧光 400×Fig.8 Immunofluorescence of Lcn 5 in sperm 400×
3.2 睾丸及附睾中 Lcn 5 表达定位分析
P.Chaurand等[13]利用质谱成像技术首先在附睾头中段发现鼠Lcn 5蛋白,从附睾头中段到附睾尾Lcn 5蛋白表达量逐步增加,最后在附睾尾中聚集。这一结果与J.J.Lareyre等[12]用原位杂交方法检测的结果和T.L.Rankin等[11]用免疫组化方法检测的结果基本一致。而S.L.Costa等研究表明Lcn 5蛋白在近端附睾头表达最高,在体部表达低,在尾部表达也较高[22]。在性成熟的大鼠中,附睾上皮细胞表达丰富的Lcn 5蛋白[23],由明细胞分泌[24]。本研究免疫组化定位结果显示,Lcn 5在附睾中主要表达于假复层纤毛柱状上皮细胞的柱状上皮细胞和游离缘的微绒毛细胞中,在附睾体和附睾尾部管腔中有聚集。该定位结果与其前人的基本一致。然而本研究还在睾丸生精细胞检测Lcn 5蛋白有微量表达。Lcn 5蛋白包裹在山羊精子头部顶体表面。也就是说,Lcn 5蛋白除了具有视黄酸运载功能外,还可能具有保护精子顶体的作用,需深入研究。
4 结 论
在所采集的公山羊体组织中,附睾头Lcn5 mRNA表达量最高,且其表达具有时间特异性。Lcn5 mRNA和蛋白表达具有空间特异性。Lcn 5蛋白定位在附睾假复层上皮细胞中,可分泌到管腔中,最终在附睾尾管腔中聚集。Lcn 5蛋白包裹在山羊精子头部顶体表面,推测其在精子成熟和维持其正常生理功能方面发挥着重要作用,其生物学功能需要进一步深入研究。
[1] FLOWER D R,NORTH A C,SANSON C E.The lipocalin protein family:structural and sequence overview[J].BiochimBiophysActa,2000,1482:9-24.
[2] GRAYB J,LATOWSKI D,STRZALKA K.Lipocalin- a family portrait[J].JPlantPhysiol,2006,163:895.
[3] FLOWER D R.The lipocalin protein family:Structure and function[J].Biochem,1996,318:1-14.
[4] JOANNA G,DARIUSZ L,KAZIMIERZ S.Lipocalins-a family portrait[J].JPlantPhysiol,2006,163:895-915.
[5] LEONE M G,HAQ H A,SASO L.Lipocalin-type prostaglandin D synthase:which role in male fertility[J].Contraception,2002,65(4):293.
[6] ZENG G,JIA C W,LIU J,et al.Lipocalin-2 test in distinguishing acute lung injury cases from septic mice without acute lung injury[J].ChinMedSciJ,2014,29(2):65-77.
[7] SUZUKI K,JEAN-JACQUES J,SNCHEZ D,et al.Molecular evolution of epididymal lipocalin genes localized on mouse chromosome2[J].Gene,2004,15(339):49-59.
[8] HAMIL K G,LIU Q,SIVASHANMUGAM P,et al.LCN6,a novel human epididymal lipocalin[J].ReprodBiolEndocrinol,2003,112(1):1-14.
[9] LAURENT M,ANNINE D.The LESP(lizard epididymal secretory protein) a new lipocalin protein potentially involved in sperm maturation[J],BiolCell,1992,76:226.
[10] SUZUKI K,YU X,CHAURAND P,et al.Epididymis-specific lipocalin promoters[J].AsianJAndrol,2007,9:515-521.
[11] RANKIN T L,TSURUTA K J,HOLLAND M K,et al.Isolation,immunolocalization,and sperm-association of three proteins of 18,25,and 29 kilodaltons secreted by the mouse epididymis[J].BiolReprod,1992,46(5):747-766.
[12] LARRYRE J J,ZHENG W L,ZHAO G Q,et al.Molecular cloning and hormonal regulation of a murine epididymal retinoic acid-binding protein mRNA[J].Endocrinology,1998,139(6):2971-2981.
[13] CHAURAND P,FOUCHECOURT S,DAGUE B B,et al.Profiling and imaging proteins in the mouse epididymis by imaging mass spectrometry[J].Proteomics,2003,3(11):2221-2239.
[14] GUYONNET B,MAROT G,DACHEU X,et al.The adult boar testicular and epididymal transcriptomes[J].BMCGenomics,2009,10(369):1-29.
[15] 张春香,张国林,郭丽娜,等.基于高通量转录组测序的山羊睾丸和附睾头差异表达基因分析[J].畜牧兽医学报,2014,44(3):391-401. ZHANG C X,ZHANG G L,GUO L N,et al.The analysis of differentially expressed genes between caprine testes and caput of epididymis based on transcriptomes with high-throughput RNA-seq technology[J].ActaVeterinariaetZootechnicaSinica,2014,44(3):391-401.(in Chinese)
[16] 李 振,张国林,郭丽娜,等.雄激素受体基因在绵羊公羔不同组织中的表达特性及性腺中的定位[J].畜牧兽医学报,2013,43(8):1251-1257. LI Z,ZHANG G L,GUO L N,et al.The expression of androgen receptor gene in different tissues and cellular localization in gonad of male sheep lambs[J].ActaVeterinariaetZootechnicaSinica,2013,43(8):1251-1257.(in Chinese)
[17] NEWCOMER M E.Structure of the epididymal retinoic acid binding protein at 2.1 angstrom resolution[J].Structure,1993,1:7-18.
[18] HUBER R,SCHNEIDER M,MAYR L,et al.Molecular structure of the bilin binding-protein( BBP) from Pieris brassicae after refinement at 20-A resolution[J].JMolBiol,1987,198:499.
[19] IRIKURA D,KUMASAKA T,YAMAMOTO M,et al.Cloning,expression,crystallization,and preliminary X-ray analysis of recombinant mouse lipocalin-type prostaglandin enzyme[J].JBiolChem,2003,133(1):29-32.
[20] SILVBANA M,PAOLO P.Liopcalins of boar salivary glands binding odours and pheromones[J].EurJBiochem,1998,252:563-568.
[21] 方 健.小鼠附睾特异性蛋白Lcn6的转录调控和多克隆抗体的制备[D].南京:南京农业大学,2006. FANG J.Transcriptional regulation of a novel epididymis-specific protein lcn6 in mice and its polyclonal antisera preparation[D].Nanjing:Nanjiang Agricultural University,2006.(in Chinese)
[22] COSTA S L,BOEKELHEIDE K,VANDERHYDEN B C,et al.Male infertility caused by epididymal dysfunction in transgenic mice expression a dominant negative mutation of retinoic acid receptor α[J].BiolReprod,1997,56:985-990.
[23] AKMAL K M,DUFOUR J M,KIM K H.Region-specific localization of retinoic acid receptor-αexpression in the rat epididymis[J].BiolReprod,1996,54:1111-1119.
[24] VIERULA M E,RANKIN T L,ORGEBIN-CRIST M C.Electron microscopic immunolocalization of the 18 and 29 kilodalton secretory proteins in the mouse epididymis:evidence for differential uptake by clear cells[J].MicroscResTech,1995,30:24-36.
(编辑 程金华)
Expression Characteristics of Lcn 5 and Its Localization in Reproduction Organ of Bucks
REN You-she#,GUO Li-na#,ZHANG Chun-xiang*,ZHANG Guo-lin,XIA Long-gang,QIAO Li-ying,JIN Li,LIU Wen-zhong
(CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity,Taigu030801,China)
This study was conducted to investigate the expression characteristics ofLcn5 mRNA and its protein localization in testes,epididymis in 5-month-old bucks and spermatozoa in adult bucks.Relative expressions ofLcn5 mRNA were detected by real-time fluorescent quantitative PCR in 18 different tissues and epididymis at different ages.The expression of Lcn 5 protein was detected by Western blotting.The localization of Lcn 5 protein in testis and epididymidis were examined by immunohistochemistry,and in spermatozoa by immunofluorescence assay.The results of qRT-PCR showed thatLcn5 mRNA was expressed in all tissues detected,which had higher levels in reproductive tissues than in other tissues.The order of expression levels in reproductive tissues:caput>cauda>corpus>testis.The expression ofLcn5 mRNA in epididymis was increased with the increase of age before 5 months old,which was the highest at age of 5 months and was decreased subsequently.The results of Western blotting analysis showed order of the protein of Lcn 5 caput >cauda>corpus> testis,which verified the results of qRT-PCR.Immunohistochemistry results showed that there were strong positive signal in columnar epithelium of epididymis,and weak positive signal in testis.Lcn 5 protein was located on the sperm acrosome surface.Lcn5 mRNA was highly expressed in epididymis,while was time-special and region-special expression.Lcn 5 was coated on sperm acrosome surface,which maybe play an important role in sperm maturation and capacitation process.Therefore,the functions need further research.
Lcn5;expression characteristics;localization;testis;epididymis;bucks
10.11843/j.issn.0366-6964.2015.05.005
2014-11-17
山西省科技攻关计划项目(20110311029;20130311025-2)
任有蛇(1970-),男,山西岢岚人,副教授,博士,主要从事动物繁殖调控研究,E-mail:rys925@126.com;郭丽娜(1987-),女,河南安阳人,硕士生,主要从事动物繁殖调控研究,E-mail:guolina5188@163.com。任有蛇和郭丽娜为共同第一作者
*通信作者:张春香,副教授,E-mail:zhchx66@126.com
S827.2
A
0366-6964(2015)05-0711-08

