北黄海海樽类的种类组成和分布特征❋
陈洪举, 刘光兴❋❋, 姜 强, 朱延忠,3
(1. 中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100;2. 中国海洋大学环境科学与工程学院,山东 青岛 266100;3. 中国环境科学研究院国家环境保护河口与海岸带环境重点实验室,北京100012)
北黄海海樽类的种类组成和分布特征❋
陈洪举1,2, 刘光兴1,2❋❋, 姜 强2, 朱延忠2,3
(1. 中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100;2. 中国海洋大学环境科学与工程学院,山东 青岛 266100;3. 中国环境科学研究院国家环境保护河口与海岸带环境重点实验室,北京100012)
为研究北黄海海樽类的群落特征,根据2006—2007年北黄海(36.95°N~39.66°N,120.95°E~124.02°E)海域4个季节的海洋调查资料,分析了北黄海海樽类的种类组成、数量变化、分布特征及其与环境的关系。结果显示:北黄海共记录到浮游海樽类4种,其中春季1种,夏季3种,秋季1种,冬季在北黄海未记录到海樽类。梭形纽鳃樽(Salpafusiformis)在春季和夏季两个季节都有出现,分布区主要位于黄海中部,且夏季大于春季,两季节的平均丰度分别为5.2和2.5 ind/m3。贝环纽鳃樽(Cyclosalpabakeri)仅在夏季出现,分布在黄海冷水团区,平均丰度仅为0.1 ind/m3。软拟海樽(Dolioettagegenbauri)仅在夏季1个站位出现,丰度仅为0.2 ind/m3。暖水种小齿海樽(Doliolumdenticulatum)是秋季北黄海唯一记录到的海樽类,分布几乎遍及整个研究水域,并具有很高的丰度,平均丰度为34.4 ind/m3。典型的暖水种小齿海樽在北黄海的大量出现并成为浮游动物的优势种可能是温带水域的海洋生态系统对全球变暖的响应信号。
北黄海;海樽类;种类组成;小齿海樽;浮游动物
海樽类隶属于被囊动物亚门(Tunicata)、海樽纲(Thaliacea),是胶质浮游生物的重要组成部分。海樽类终生营浮游生活,多生活在热带海域和大洋中,其分布状况与海流的影响有密切关系,可作为海流或水团,尤其是暖流的指示种[1-2]。这一纲的生物由于出现时往往数量很大,因而又称为丰生纲。海樽类的数量波动会引起桡足类数量的变化[3-4],进而对整个浮游生物群落结构产生影响。此外,海樽类滤食的粒径范围广泛[5-6],加之它们产生的大量粪粒和有机碎屑沉降迅速,使得海樽在海洋生物地化循环中具有重要的地位[7]。因此,海樽类的数量分布和其与环境关系等生态学特征在全球范围内都受到广泛的关注[3-4,6,8-11]。
中国关于海樽类的生态学研究的报道主要集中在台湾海峡[12-14]、南海[15]、东海海域[2,16-18]和南黄海[19]。关于北黄海的海樽类的报道极少,仅陈介康1978年对北黄海发现的2种纽鳃樽做了分类描述,并就其数量分布与渔业的关系做了探讨[20]。除此之外,尚未见有关北黄海海樽类的其它专门报道。本文根据2006—2007年在北黄海执行的4个航次大面调查所获得的大、中型浮游动物样品,分析了北黄海海樽类的种类组成和数量分布,并就发现的一些新的现象进行了探讨。该研究所得结果有助于提高对海樽类生态特征和地理分布的认识,并可为全球气候变化对海洋生物影响的研究提供重要的参考依据。
1 材料与方法
2006年7~8月(夏季)、2007年1月(冬季)、2007年4~5月(春季)和2007年10月(秋季)采用中国海洋大学“东方红2号”科学调查船在北黄海海域(36.95°N~39.66°N,120.95°E~124.02°E)进行4次大面调查(见图1)。调查站位数分别为夏季78个,冬季81个,春季82个,秋季82个。
样品视水深采用大型浮游生物网(网口内径80cm,筛绢孔径0.505 mm)或浅水Ⅰ型浮游生物网(网口内径50 cm,筛绢孔径0.50 mm)底表垂直拖网采集,保存于5%福尔马林海水溶液中;实验室内,在体视显微镜下计数测定浮游动物样品中海樽的丰度(ind/m3)并鉴定到种。海水的盐度、温度采用随船配置的CTD测定[21]。叶绿素a数据由中国海洋大学环境科学与工程学院李正炎教授提供。采用主成分分析方法(SPSS 11.5)分析海樽种类的分布与各环境因子(水深,表层温度,底层温度,表层盐度,底层盐度,表层叶绿素a和底层叶绿素a)的关系。

图1 研究区域及采样站位
2 结果
2.1 种类组成
本研究共记录海樽类4种,分别隶属于全肌目(2种)和半肌目(2种)。春季记录到1种,夏季3种,秋季1种(见表1)。其中,梭形纽鳃樽在春季和夏季2个季节都出现。冬季在北黄海未记录到海樽类。

表1 北黄海海樽类组成及丰度
2.2 海樽类的平面分布
One-Way ANOVA分析表明,海樽类总丰度季节间差异显著(F=17.833,p=0.000),呈现明显的季节波动。丰度以秋季最高,夏季次之,冬季无分布。
春季,仅记录到梭形纽鳃樽1种,其平均丰度为2.5 ind/m3,且出现频率很低,仅为7.3%。梭形纽鳃樽在北黄海的分布极不均匀,仅出现在研究水域的东南部,丰度最高值出现在B107站,高达110.0 ind/m3(见图2)。
夏季,北黄海记录到3种海樽类。其中,以梭形纽鳃樽最占优势,分布也极不均匀,分布水域较之春季向东北方向扩展,出现频率较春季也有所提高,达到12.8%,其平均丰度为5.2 ind/m3(见图3)。贝环纽鳃樽的分布水域位于梭形纽鳃樽的分布区之内,出现频率较低(5.1%),且丰度很低,平均丰度仅为0.1 ind/m3(见图4)。软拟海樽仅在位于石岛东部外海的1个站位出现,且丰度极低,仅为0.2 ind/m3。
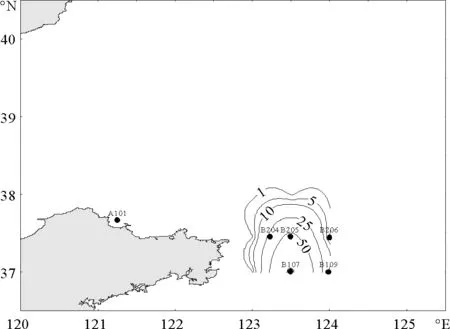
图2 春季梭形纽鳃樽出现的站位和平面分布(ind/m3)
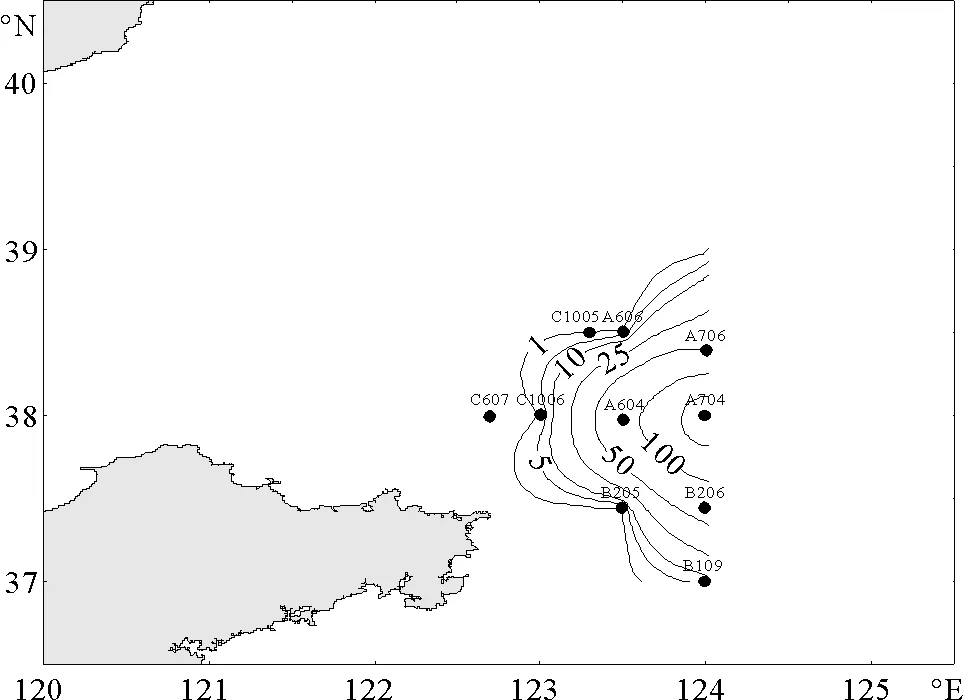
图3 夏季梭形纽鳃樽出现的站位和平面分布(ind/m3)

图4 夏季贝环纽鳃樽出现的站位和平面分布(ind/m3)
秋季,小齿海樽是北黄海唯一记录到的海樽类,该种类在北黄海出现频率很高,达到62.2%,并具有很高的丰度,平均值为34.4 ind/m3。秋季小齿海樽在研究水域整个浮游动物群落中都具有重要的优势地位,其优势度高达0.067。主要集中分布在研究水域的中部偏南海区,但在近岸水域,特别是辽东半岛近岸水域丰度很低(见图5)。

图5 秋季小齿海樽出现的站位和平面分布(ind/m3)
2.3 海樽类的分布与环境因子的关系
主成分分析结果显示,春季前2个主成分累计贡献率为55.8%,梭形纽鳃樽的出现与各环境因素的相关性不明显,但倾向于生存在温度和盐度都相对较高的水域(见图6a);夏季,前2个主成分累计贡献率为53.1%,贝环纽鳃樽和梭形纽鳃樽的分布与底层温度存在负相关性,但与水深和底层盐度正相关(见图6b);秋季,前2个主成分累计贡献率为66.3%,小齿海樽的出现与各环境因素的相关性不明显,但倾向于生存在叶绿素浓度较高的水域(见图6c)。相关性分析结果显示,北黄海各季节海樽种类与环境参数间的相关性均不显著。各海樽类种类分布水域的平均温度、盐度和其变化范围见表2。

种类Species表层温度①SST/℃均值Mean范围Range底层温度②SBT/℃均值Mean范围Range表层盐度③SSS均值Mean范围Range底层盐度④SBS均值Mean范围Range小齿海樽Doliolumdenticulatum18.4316.51~19.2514.418.77~18.8331.1530.08~31.8431.7530.10~32.66软拟海樽Dolioettagegenbauri22.03-14.65-30.69-31.32-贝环纽鳃樽Cyclosalpabakeri24.1222.18~25.0910.927.91~14.5931.5930.92~31.9832.2831.82~32.53梭形纽鳃樽Salpafusiformis18.9810.31~25.889.437.39~14.5931.6430.64~32.5032.3631.81~33.17
注:① Sea surface temperature; ② Sea bottom temperature; ③ Sea surface salinity; ④ Sea bottom salinity
3 讨论
本研究共记录到北黄海海樽类4种,种类数显著低于南黄海的7种[22]、台湾海峡13种[12]、台湾南湾区16种[14]、东海20种[18]和南海中部23种[15]。海樽类是一类大洋暖水性浮游动物,与暖流的关系密切,主要分布在暖水区[1]。因此,海樽类的种类数呈现由南海、东海、南黄海至北黄海逐次减少的趋势。
梭形纽鳃樽是北黄海重要的浮游被囊动物之一,在本研究中春季和夏季都有出现。本研究2个季节记录到的梭形纽鳃樽个体均为复体,Liu等[19]在南黄海的周年研究也表明,南黄海梭形纽鳃樽种群以复体为主(93.8%)。梭形纽鳃樽广泛分布于世界各大洋,适温范围非常广(7~25 ℃),从低纬度到中高纬度都有分布[23]。梭形纽鳃樽在我国东海和南海都有报道,但是丰度都不高[12,15,18]。Liu等研究指出,梭形纽鳃樽的丰度和平面分布在南黄海存在明显的季节变化,全年平均丰度以6月最高[19]。有学者曾在黑潮区[24]和日本海西部的韩国沿岸[25]也曾记录到大量的梭形纽鳃樽,并认为其出现是暖流北向输送的结果。徐兆礼等在东海的研究表明梭形纽鳃樽具有较宽的适温范围(12.0~26.2 ℃),但最适温度在20 ℃以下(18.24 ℃),具有较高的盐度适应性,其最适盐度超过34,并指出该种在东海主要出现在盐度较高的冬春季,从地理分布上讲,其地理分布与暖流有密切联系,因此认为该种属于暖温带外海种[26]。Bathmann曾报道梭形纽鳃樽在水温较低(11.8~12.1 ℃)的春季在爱尔兰西部水域大量出现,可以适应较低的温度[27]。从本结果来看,梭形纽鳃樽分布的密集区位于黄海冷水团区,表层温度范围与徐兆礼等的结果[26]一致,但底层温度很低(见表2)。陈介康在北黄海的研究指出梭形纽鳃樽的分布以外海高盐水与沿岸低盐水的交汇区数量最多[20],徐兆礼等也得到类似结论[26],认为梭形纽鳃樽往往出现在沿岸水和外海水混合水团偏高盐水一侧。但从本研究结果来看,并未有类似的现象。这可能与该种的特殊适应性有关。Berner研究表明梭形纽鳃樽的出现与任何环境物理参数均无关联性[8],本研究也得到类似结果。有研究指出,与其它上层浮游动物相比,纽鳃樽的分布非常不规律[9]。陈介康认为该种在北黄海可以作为暖流的指示种[20],考虑到梭形纽鳃樽特殊的适应性,这一结论值得进一步商榷。
本研究是第2次在北黄海大量记录到梭形纽鳃樽,陈介康曾于1965年秋季(9~11月)在北黄海首次记录到大量的梭形纽鳃樽[20]。在涉及北黄海的多次大面积、多航次的综合调查中[28-29]均未记录到该种的存在。Brattström综合了大量的资料,对北大西洋挪威沿海梭形纽鳃樽的出现状况做了统计,结果表明该种在一些年份完全消失,在大多数年份以较小的丰度出现,在极少数年份形成大的集群,丰度极高,但其年际变动无任何规律[30]。就北黄海有限的调查资料分析来看,似乎也符合这一特征。纽鳃樽是一类典型的r-选择策略生物[31],其“机会主义”生殖策略可能是其丰度年际波动剧烈的重要原因之一。
陈介康曾在北黄海采集到贝环纽鳃樽8个个体,并做了形态描述[20];肖贻昌指出,贝环纽鳃樽系“冷水种”,其分布范围局限于黄海深水区,垂直分布以深层为主,一般向北不进入渤海海峡,向南不越过33°N,基本与黄海冷水团的范围吻合[32]。在全国海洋综合调查报告(第八册)中也指出,贝环纽鳃樽主要分布在南、北黄海中央水域,是黄海冷水团的指示种,尤以夏季的数量为多[33]。在作者的研究中也仅在夏季记录到该种,其分布区位于黄海冷水团的边缘[21],与上述研究的结论是一致的。
在本研究中发现小齿海樽在2007年秋季成为北黄海重要的优势种,记录到所有个体均为有性个体。徐兆礼等通过对东海海樽类生态类群的统计分析,认为小齿海樽系亚热带外海种[26]。在1958—1959年全国海洋综合调查中,该种仅出现于东海、南海海域,其分布范围在6月达到最北仅为32°N[33]。在王云龙等1997—2000年的调查中,该种同样仅出现于东海、南海海域,且丰度不高[29]。
在北黄海以往的调查研究中,从未见有小齿海樽在北黄海有分布的报道。毕洪生等以1959年全国海洋普查浮游动物中网周年标本为材料,对渤海的浮游动物进行的研究记录到1959年6月小齿海樽在渤海的零星分布,数量极低,指出当时的水文条件不足以使该种类存活,并推断该种类是由黄海海流带入渤海的[34]。根据毕洪生等的这一研究结果,可以推断在当时的北黄海应该有小齿海樽分布,但并没有确凿的证据。而在本次秋季航次调查中,其分布范围已经延伸到了39°N,到达辽宁近岸水域,平均丰度达34.4 ind/m3,在38°N~38.5°N、122°E附近水域甚至出现了>500 ind/m3的峰值区。在本次调查之后的2009年秋季(10月)杨青等[35]也在北黄海记录到了大量小齿海樽(平均丰度达81.0 ind/m3,最高值达到817.5 ind/m3)。王荣等研究表明小齿海樽在2001年冬季(11~12月)在南黄海浮游动物群落中具有一定的优势地位,认为像小齿海樽和肥胖箭虫等这类适温适盐范围较广的暖水种,夏、秋季在南黄海有较广的分布,并形成高生物量区,这是种群分布区扩展并在当地大量繁殖的结果而并非缘于海流输送,并指出其11月的调查中仍有较大范围分布的小齿海樽极有可能是秋季遗留的种群[36]。徐兆礼等在东海的研究结果表明,小齿海樽的适温适盐范围较广,其适温范围为13.8~28.4 ℃,最适温度为20.4 ℃[26],并指出对海洋环境广泛的适应性是该种有较高优势性的重要原因[16]。本研究中小齿海樽分布区的表层水温为16.5~19.3 ℃(见表2),处于其适温范围之内。因此,秋季如此大量的小齿海樽在北黄海出现也很有可能并非源于外源输入,而是在当地大量繁殖的结果。
随着全球变暖的加剧,在全球范围内暖水种北移的现象已多有报道[37-38]。冯琳和林霄沛研究表明,1945—2006年间,东中国海SST具有明显的长期升高的线性变化趋势,平均每年升高0.015℃,62年间共升高了0.9℃[39]。典型暖水种小齿海樽在北黄海的大量出现,这一现象在以往的观测中未见报道。考虑到该海域历史上观测资料不多,而且影响生物生存的因素非常复杂,小齿海樽在北黄海的大量出现是否为温带海洋生态系统对全球变暖的响应尚无法确定,但这一问题值得引起充分的重视,并进行更深入的观测研究。
致谢:徐东晖、黄有松等同学帮助采集浮游动物样品;中国海洋大学“东方红2”调查船提供采样平台,谨致谢忱。
[1] 郑重. 指示生物研究—海洋浮游生物的新动向之二 [J]. 自然杂志, 1978, 1(5): 296-302.
[2] 林茂, 张金标. 东海中部管水母和海樽类的聚集及其对水团边界的指示作用[C].//国家海洋局科技司. 黑潮调查研究论文选(五). 北京: 海洋出版社, 1993: 452-459.
[3] Deibel D. Blooms of the pelagic tunicate,Doliolettagegenbauri: Are they associated with Gulf Stream frontal eddies? [J]. Journal of Marine Research, 1985, 43: 211-236.
[4] Paffenhöfer G A, Atkinson L P, Lee T N, et al. Distribution and abundance of thaliaceans and copepods off the southeastern U.S.A. during winter [J]. Continental Shelf Research, 1995, 15(223): 255-280.
[5] Andersen V, Nival P. A pelagic ecosystem model simulating production and sedimentation of biogenic particles: role of salps and copepods [J]. Marine Ecology Progress Series, 1988, 44: 37-50.
[6] Madin L P, Purcell J E, Miler C B. Abundance and gazing effects ofCyclosalpabakeriin the subarctic Pacific [J]. Marine Ecology Progress Series, 1997, 157: 175-183.
[7] Perissinotto R, Pakhomov E A. The trophic role of the tunicateSalpathompsoniin the Antarctic marine ecosystem [J]. Journal of Marine Systems, 1998, 17: 361-374.
[8] Berner L. Studies on the Thaliacea of the temperate northeast Pacific Ocean [D]. San Diego: University of California, San Diego, 1957: 144.
[9] Hubbard L T, Pearcy W G. Geographic distribution and relative abundance of Salpidae off the Oregon coast [J]. Journal of the Fisheries Research Board of Canada, 1971, 28: 1831-1836.
[10] Deibel D. The abundance, distribution, and ecological impact of doliolids.//Bone Q, ed, The biology of pelagic tunicates [M]. Oxford: Oxford University Press, 1998: 171-186.
[11] Tew K S, Lo W T. Distribution of Thaliacea in SW Taiwan coastal water in 1997, with special reference toDoliolumdenticulatum,ThaliademocraticaandT.oriental[J]. Marine Ecology Progress Series, 2005, 292: 181-193.
[12] 林茂. 台湾海峡西部海域海樽类(Thaliacea)的初步分析 [J]. 海洋通报, 1988, 7(3): 66-71.
[13] 张金标, 连光山, 王云龙, 等. 台湾海峡东部海域海樽类被囊动物的分布 [J]. 台湾海峡, 2003, 22(3): 279-285.
[14] 张金标, 黄将修, 连光山. 台湾南湾区秋末冬初海樽类的种类组成和数量分布 [J]. 海洋通报, 2003, 22(6): 9-16.
[15] Lin Mao, Lin Rongcheng. Seasonal abundance and distribution of pelagic tunicates (Chordata: Thaliacea) in the central South China Sea [J]. Acta Oceanologica Sinica, 2006, 25(3): 148-156.
[16] 徐兆礼, 林茂, 张金标. 东海海樽类优势种的数量变化 [J]. 动物学报, 2006, 52(1): 53-62.
[17] 徐兆礼, 林茂, 张金标. 东海海樽类数量分布及与环境的关系 [J]. 海洋与湖沼, 2007, 38(6): 549-554.
[18] 徐兆礼, 林茂. 东海海樽种类组成和多样性 [J]. 海洋水产研究, 2007, 28(1): 26-32.
[19] Liu Yongqin, Sun Song, Zhang Guangtao. Seasonal variation in abundance, diel vertical migration and body size of pelagic tunicateSalpafusiformisin the Southern Yellow Sea [J]. Chinese Journal of Oceanology and Limnology, 2012, 30(1): 92-104.
[20] 陈介康. 在黄海北部发现的两种纽鳃樽[J]. 动物学杂志, 1978, 2: 13-16.
[21] 鲍献文, 李娜, 姚志刚, 等. 北黄海温盐分布季节变化特征分析 [J]. 中国海洋大学学报:自然科学版, 2009, 39(4): 553-562.
[22] 左涛. 东黄海浮游动物群落结构研究 [D]. 青岛: 中国科学院海洋研究所, 2003: 115.
[23] Thompson H. Pelagic tunicates of Australia [M]. Melbourne: Council for Scientific and Industrial Research, 1945: 196.
[24] Tsuda A, Nemoto T. Distribution and growth of salps in a Kuroshio warm-core ring during summer 1987 [J]. Deep-sea Research, 1992, 39(Sup.1): 219-229.
[25] Chae J, Choi H W, Lee W J, et al. Distribution of a pelagic tunicate,Salpafusiformisin warm surface current of the eastern Korean waters and its impingement on cooling water intakes of Uljin nuclear power plant[J]. Journal of Environmental Biology, 2008, 29(4): 585-590.
[26] 徐兆礼, 孙军, 林茂. 东海海樽类生态类群统计分析 [J]. 生态学报, 2008, 28(11): 5698-5705.
[27] Bathmann U V. Mass occurrence ofSalpafusiformisin the spring of 1984 off Ireland: Implications for sedimentation process [J]. Marine Biology, 1988, 97: 127-135.
[28] 郑重, 郑执中, 王荣, 等. 烟、威鲐鱼渔场及邻近水域浮游动物生态的初步研究 [J]. 海洋与湖沼, 1965, 7(4): 329-354.
[29] 王云龙, 沈新强, 李纯厚, 等. 中国大陆架及邻近海域浮游生物 [M]. 上海: 上海科学技术出版社, 2005: 118-132.
[30] Brattström H. OnSalpafusiformisCuvier (Thaliacea) on Norwegian coastal and offshore waters [J]. Sarsia, 1972, 48: 71-90.
[31] Silver M W. The habitat ofSalpafusiformis(Chordata: Tunicata) in the California Current as defined by stomach content studies and the effect of salp swarms on the food supply of the plankton community [D]. San Diego: University of California, San Diego, 1971: 135.
[32] 肖贻昌. 黄海浮游动物的基本生态特点 [J]. 海洋湖沼通报, 1979, 2: 51-55.
[33] 中华人民共和国科学技术委员会海洋组海洋综合调查办公室. 全国海洋综合调查报告(第八册)中国近海浮游生物的研究[R]. 青岛: 中科院海洋所, 1964: 159.
[34] 毕洪生, 孙松, 高尚武, 等. 渤海浮游动物群落生态特点Ⅰ.种类组成与群落结构 [J]. 生态学报, 2000, 20(5): 715-731.
[35] 杨青, 王真良, 樊景凤, 等. 北黄海秋、冬季浮游动物多样性及年间变化 [J]. 生态学报, 2012, 32(21): 6747-6754.
[36] 王荣, 高尚武, 王克, 等. 冬季黄海暖流的浮游动物指示 [J]. 水产学报, 2003, 27(增): 39-48.
[37] Beaugrand G, Reid P C, Ibanez F, et al. Reorganization of North Atlantic marine copepod biodiversity and climate [J]. Science, 2002, 296: 1692-1694.
[38] Stebbing A R D, Turk S M T, Wheeler A, et al. Immigration of southern fish species to southwest England linked to warming of the North Atlantic (1960—2001) [J]. Journal of the Marine Biological Association of the UK, 2002, 82: 177-180.
[39] 冯琳, 林霄沛. 1945~2006年东中国海海表温度的长期变化趋势 [J]. 中国海洋大学学报: 自然科学版, 2009, 39(1):13-18.
责任编辑 朱宝象
Species Composition and Distribution of Thaliacea in the North Yellow Sea
CHEN Hong-Ju1,2, LIU Guang-Xing1,2, JIANG Qiang2, ZHU Yan-Zhong2,3
(1. The Key Laboratory of Marine Environment and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China;2. College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100, China;3. State Environmental Protection Key Laboratory of Estuary and Coastal Environment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China)
According to the data collected in 4 surveys of the North Yellow Sea (36.95°N~39.66°N, 120.95°E~124.02°E) during a period lasting from 2006 and 2007, the species composition, abundance variation, distribution pattern and the relation between Thaliacea and environment were analyzed. A total of 4 species were recorded, 3 in summer and 1 in spring, 1 in autumn, and no Thaliacea species was recorded in winter.Salpafusiformiswas an important species in surveyed area, which was 2.5 and 5.2 ind/m3in average in spring and summer, respectively.Salpafusiformismainly distributed in the Yellow Sea Bottom Cold Water area, and the regional distribution in summer was more widely ranged than that in spring. Cold-water speciesCyclosalpabakeriwas only recorded in summer in the Yellow Sea Bottom Cold Water area, with a low average abundance 0.1 ind/m3. Warm-water speciesDoliolumdenticulatumwidely distributed in the North Yellow Sea in autumn, and the average abundance was 34.4 ind/m3. This was the first typical warm-water species recorded as a dominant species in the North Yellow Sea. The appearance of the typical warm-water species with great abundance in the North Yellow Sea might signal the temperate response of marine ecosystem to global warming, and more observations and studies on this rare phenomenon are highly appreciated.
North Yellow Sea; thaliacea; species composition;Doliolumdenticulatum; zooplankton
国家自然科学基金项目(31101875;40876066);国家重点基础研究发展计划项目(2005CB422306)资助
2014-03-31;
2014-06-18
陈洪举(1982-),男,讲师,从事海洋浮游生物学研究。E-mail: hongjuc@ouc.edu.cn
❋❋ 通讯作者: E-mail:gxliu@ouc.edu.cn
Q178.53;X145
A
1672-5174(2015)06-039-06
10.16441/j.cnki.hdxb.20140092

