生物催化2-羟基-4-甲硫基丁腈制备羟基蛋氨酸菌株的筛选及转化过程的研究
李宗通,金利群
(浙江工业大学生物工程研究所,浙江杭州 310014)
生物催化2-羟基-4-甲硫基丁腈制备羟基蛋氨酸菌株的筛选及转化过程的研究
李宗通,金利群
(浙江工业大学生物工程研究所,浙江杭州 310014)
筛选得到一株产腈水解酶的基因工程菌株(ZJB12048),在优化的转化条件下(反应温度50°C,反应体系pH值7.0(100 mmol/L柠檬酸/柠檬酸钠缓冲溶液),湿菌体浓度为0.02 g/ mL,底物浓度为150 mmol/L),其静息细胞对2-羟基-4-甲硫基丁腈具有较高的催化活力。高效液相色谱(HPLC)、液相-质谱(LC-MS)和核磁共振(NMR)分析结果表明,反应液中的转化产物为羟基蛋氨酸(2-羟基-4-甲硫基丁酸)。
筛选;2-羟基-4-甲硫基丁腈;腈水解酶;2-羟基-4-甲硫基丁酸;鉴定
羟基蛋氨酸化学名为2-羟基-4-甲硫基丁酸(2-hydroxy-4-(methylthiol)butanoic acid,HMB),又称为蛋氨酸羟基类似物,是一种蛋氨酸的类似物替代品。蛋氨酸羟基类似物的化学结构式和蛋氨酸除了第二个碳原子上的基团不同外,其他部分完全相同,即HMB上是一个羟基代替了蛋氨酸上的氨基。研究表明,在动物体内等量蛋氨酸与羟基蛋氨酸具有相同的生物效价,此外羟基蛋氨酸还表现出一些特有的性质,如良好的抑菌效果,增强动物机体免疫及抗氧化能力,有效减缓热应激反应的损害及良好的过瘤胃效果等[1-5]。因此,HMB作为一种性能优越的蛋氨酸源被广泛应用于动物饲料营养产业。
20世纪80年代,美国孟山都公司以化学合成蛋氨酸的过程中产生的中间体2-羟基-4-甲硫基丁腈为原料经过两步水解得到HMB[6-7]。在此之后,许多学者研究不同方法水解2-羟基-4-甲硫基丁腈制备HMB[8-9]。化学合成HMB反应条件比较严苛,对设备要求较高,使用大量有机溶剂且产生副产物,对环境污染严重。相对而言,利用微生物产生的腈水解酶催化2-羟基-4-甲硫基丁腈水解制备HMB的工艺过程简单、副产物少、反应条件温和、环境污染小,具有很广阔的发展空间[10-12]。罗纳-普朗克动物营养素公司报道使用固定化腈水解酶作为生物催化剂催化2-羟基-4-甲硫基丁腈制备2-羟基-4-甲硫基丁酸或其铵盐,收率高,不使用有机溶剂且不产生无机盐,可实现工业规模化生产[13]。
本研究以实验室保藏的产腈水解酶菌株为基础,筛选出具有较高催化活力的腈水解酶产生菌,用于催化水解2-羟基-4-甲硫基丁腈制备HMB,并对其转化条件进行了研究,为生物催化制备羟基蛋氨酸的工业化生产奠定了基础。
1 材料与方法
1.1 实验材料
1.1.1 试剂
羟基蛋氨酸标样购自百灵威科技;2-羟基-4-甲硫基丁腈由实验室合成;其他试剂均为市售分析纯。
1.1.2 菌种
腈水解酶产生菌从实验室保藏的野生型菌株及构建的一系列重组菌中筛选。
1.1.3 培养基
野生型菌株:
1)种子/发酵培养基(g/L):葡萄糖10.0,谷氨酸钠10.0,酵母粉3.0,己内酰胺1.0,KH2PO40.75,K2HPO4·3H2O 0.75,MgSO4·7H2O 0.5,pH 7.0,115°C下灭菌30 min。
2)斜面/平板培养基(g/L):牛肉膏5.0,蛋白胨10.0,NaCl 5.0,pH 7.0,115°C下灭菌30 min。
基因工程菌株:
1)Luria-Bertani培养基(g/L):酵母粉5,蛋白胨10,NaCl,pH 7.0,121°C下灭菌20 min。
2)斜面/平板培养基是在液体Luria-Bertani培养基中加入1.5%~2.0%的琼脂。
1.2 实验方法
1.2.1 菌种的培养
野生菌的培养:从斜面培养基上挑取一环菌体接入50 mL的LB液体培养基中,置于30°C、150 r/min条件下培养20 h作为种子液,按2%接种量接种至新鲜的发酵培养基中,30°C、150 r/ min条件下培养48 h,9000 r/min下离心10 min收集菌体,用生理盐水清洗两次,冷冻保藏备用。
工程菌的培养:将工程菌接种至50 mL含50 μg/mL卡那霉素(Kan)的LB液体培养基中,37°C、150 r/min条件下培养10~12 h,2%接种量转接至新鲜LB液体培养基中,37°C、150 r/min条件下培养至菌体浓度OD600约为0.6~0.8,加入终浓度为0.1 mmol/L的IPTG,28°C、150 r/min条件下诱导培养10 h。诱导结束后9000 r/min下离心10 min收集菌体,用生理盐水清洗两次,冷冻保藏备用。
1.2.2 菌株转化活力的测定
静息细胞转化:取湿重为0.1 g野生菌或工程菌的菌体,用10 mL纯水重悬菌体,置于转化瓶中,加入终浓度为10 mmol/L的2-羟基-4-甲硫基丁腈,40°C、180 r/min条件下反应,定时取样,加HCl终止反应,离心去除沉淀,检测上清中产物浓度。
1.2.3 羟基蛋氨酸的定量分析方法
羟基蛋氨酸的定量分析采用HPLC检测法。HPLC分析检测条件:C18高效液相色谱柱(250 mm×4.6 mm,5 μm,J&K Scientific Ltd.),流动相采用20∶80∶0.05的乙腈∶水∶三氟乙酸(TFA),流速为1.0 mL/min,柱温设置为40°C,检测波长210 nm,进样量为20 μL。进样前使用0.22 μm微孔滤膜对样品溶液进行除杂处理。
1.2.4 转化条件优化
在菌株筛选过程中,转化条件为:反应温度40°C,纯水反应体系,0.01 g/mL的菌体添加量,底物浓度为10 mmol/L。在原有转化条件的基础上,采用单因素试验分别对反应温度、pH值、反应体系溶剂、菌体添加量及底物浓度等条件进行优化。
2 结果
2.1 产腈水解酶菌株筛选
从实验室保藏的可以产腈水解酶的119株野生型菌株及30株基因工程菌株中,筛选能将2-羟基-4-甲硫基丁腈转化为2-羟基-4-甲硫基丁酸的菌株。根据活力测定的结果,共有21株野生型菌株和10株工程菌能够将2-羟基-4-甲硫基丁腈转化为2-羟基-4-甲硫基丁酸(部分结果见表1)。其中野生型菌株与基因工程菌的催化能力差别很大,前者的催化能力基本都偏低(表1)。编号为ZJB12048的基因工程菌对2-羟基-4-甲硫基丁腈的活力最高,在40°C条件下反应25 min转化率可达100%。因此,后续实验选择编号为ZJB12048的基因工程菌作为2-羟基-4-甲硫基丁腈转化为2-羟基-4-甲硫基丁酸的生物催化剂。

表1 产腈水解酶菌株的筛选
2.2 静息细胞催化条件的优化
2.2.1 反应温度对催化反应的影响
考察了反应温度对水解反应的影响,将反应体系置于不同温度(35~80°C)中保温10 min后,加入20 mmol/L底物(2-羟基-4-甲硫基丁腈)进行反应,反应3 min取样终止反应,测定反应初速率,结果见图1(a)。在温度范围为35~65°C时,随着温度的升高,反应的初始速率也逐渐升高;当温度高于65°C时,反应初始速率随着温度的升高急剧下降,酶活力出现明显的损失,酶分子开始明显的变性。
同时实验考察了该腈水解酶的热稳定性,结果见图1(b)。根据热稳定性计算出在50、55、60、65和70°C条件下的失活常数分别为-0.01544、-0.03696、-0.04456、-0.12070和-0.31616,并计算出各温度下相对应的半衰期分别为44.9、18.8、15.2、5.7和2.2 h。综合考虑温度对催化反应的影响和腈水解酶热稳定性的结果,选择50°C作为后续试验的反应温度。

图1 温度对催化反应的影响(a)与腈水解酶的热稳定性(b)
2.2.2 反应体系pH值对催化反应的影响
50°C条件下,在三种不同缓冲溶液中考察了不同pH值对反应的影响,结果见图2。在近中性反应条件下,催化反应具有较好的反应速率;在偏酸性(<6)或偏碱性(>8)环境中,催化活力迅速下降。在柠檬酸/柠檬酸钠缓冲溶液pH 7.0时,该菌株具有最好的催化效果。
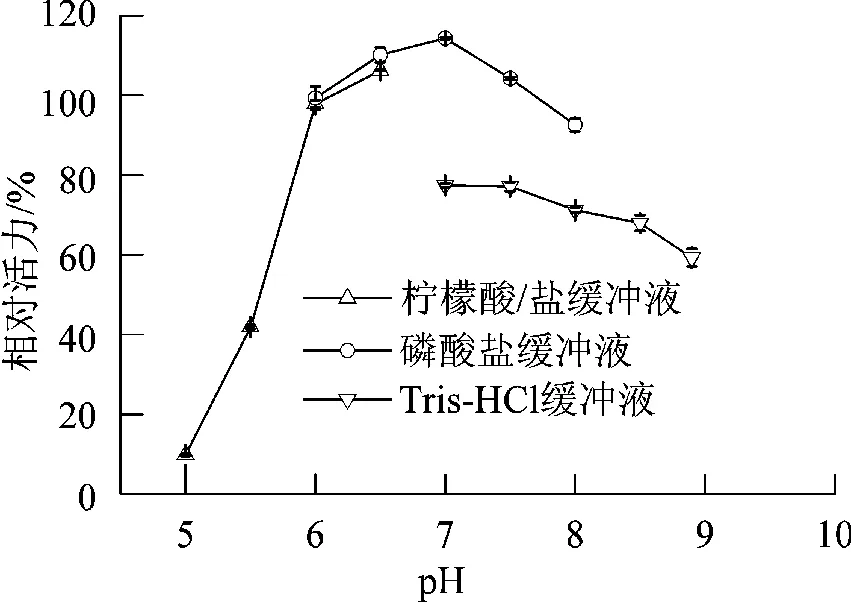
图2 反应pH值对催化反应的影响
2.2.3 静息细胞添加量对催化反应的影响
微生物转化过程中,反应体系中静息细胞的添加量会影响催化反应的速率。由图3结果可见,随着反应体系中静息细胞浓度的持续增加,细胞的催化反应速率不断增加,而相对酶活随着静息细胞浓度的增加而呈现下降的趋势,说明静息细胞不断增加会出现催化剂饱和现象而无法参与催化反应。综合考虑催化效率及催化剂的有效利用,选择20 g/L的静息细胞浓度为最适浓度。
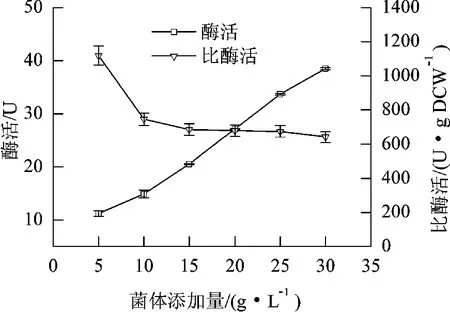
图3 静息细胞添加量对催化反应的影响
2.2.4 底物浓度对催化反应的影响
酶的活性中心会在底物达到一定浓度时趋于饱和,此时酶的催化效率最高;随着底物浓度的不断增加,底物会对酶产生一定的抑制作用。此外,腈类化合物有一定的毒性,高浓度对菌体的催化能力有一定的影响,因此对底物的添加量进行了考察,测定反应速率及最终反应的产率,结果如图4。当浓度在0~150 mmol/L范围内时,随着底物浓度增加,催化活力不断增强,反应初速率不断增大,反应最终的产率可以达到100%;而当底物浓度超过150 mmol/L时,催化反应速率开始下降,反应的最终产率逐渐下降,底物不能够完全被转化,说明底物对酶产生了抑制。

图4 底物浓度对反应的影响
2.3 反应产物的鉴定
采用高效液相色谱(HPLC)分析产物标样及催化反应产物,结果见图5。其中,1号谱线是2-羟基-4-甲硫基丁酸标准品溶液的分析结果,2号谱线为催化反应液的色谱分析结果。1号谱线中保留时间5.233 min处的色谱峰为2-羟基-4-甲硫基丁酸色谱峰,在2号谱线的5.235 min保留时间处有较大峰面积的色谱峰。对比产物标准品与催化反应液的色谱图,可初步确定5.235 min的色谱峰是产物2-羟基-4-甲硫基丁酸的色谱峰。

图5 高效液相色谱分析图
利用液相-质谱(LC-MS)分析方法对图5中初步确定的目标产物进行分子量的测定(图6)。m/z=149.0是M-H峰,与羟基蛋氨酸的分子离子峰匹配。
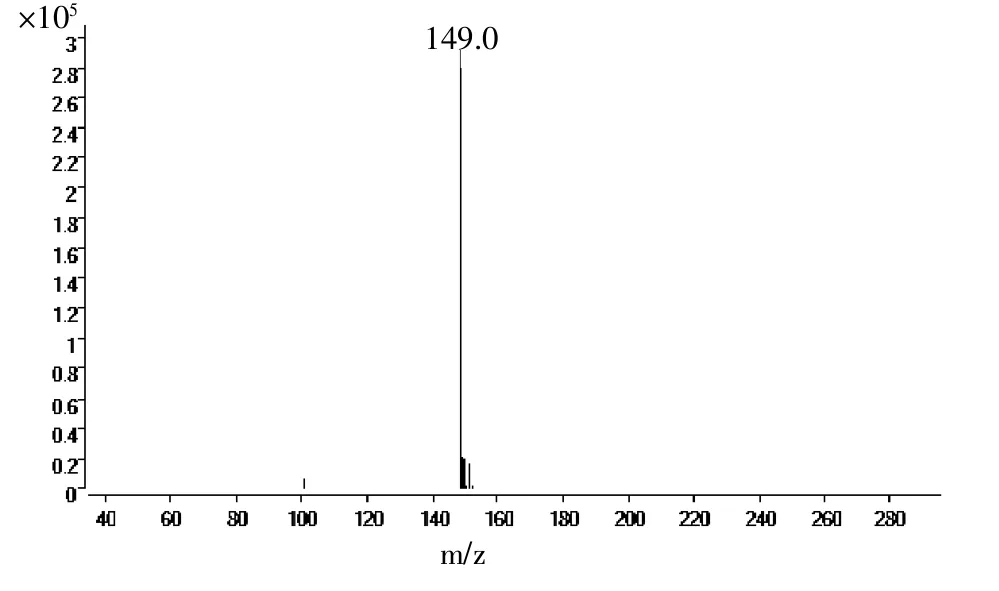
图6 目标产物的LC-MS分析结果
利用核磁共振氢谱分析了目标产物,结果如图7。该产物的1H NMR的数据为:1H NMR(500 MHz,D2O):δ4.29(dd,J=8.1,4.1 Hz,1H),2.58-2.54(m,2H),2.06-1.98(m,4H),1.90(ddd,J= 16.7,11.1,7.0 Hz,1H)。
综合液相色谱、质谱和核磁共振氢谱的分析结果,可以确定反应液中的产物及萃取液中的物质确为2-羟基-4-甲硫基丁酸。
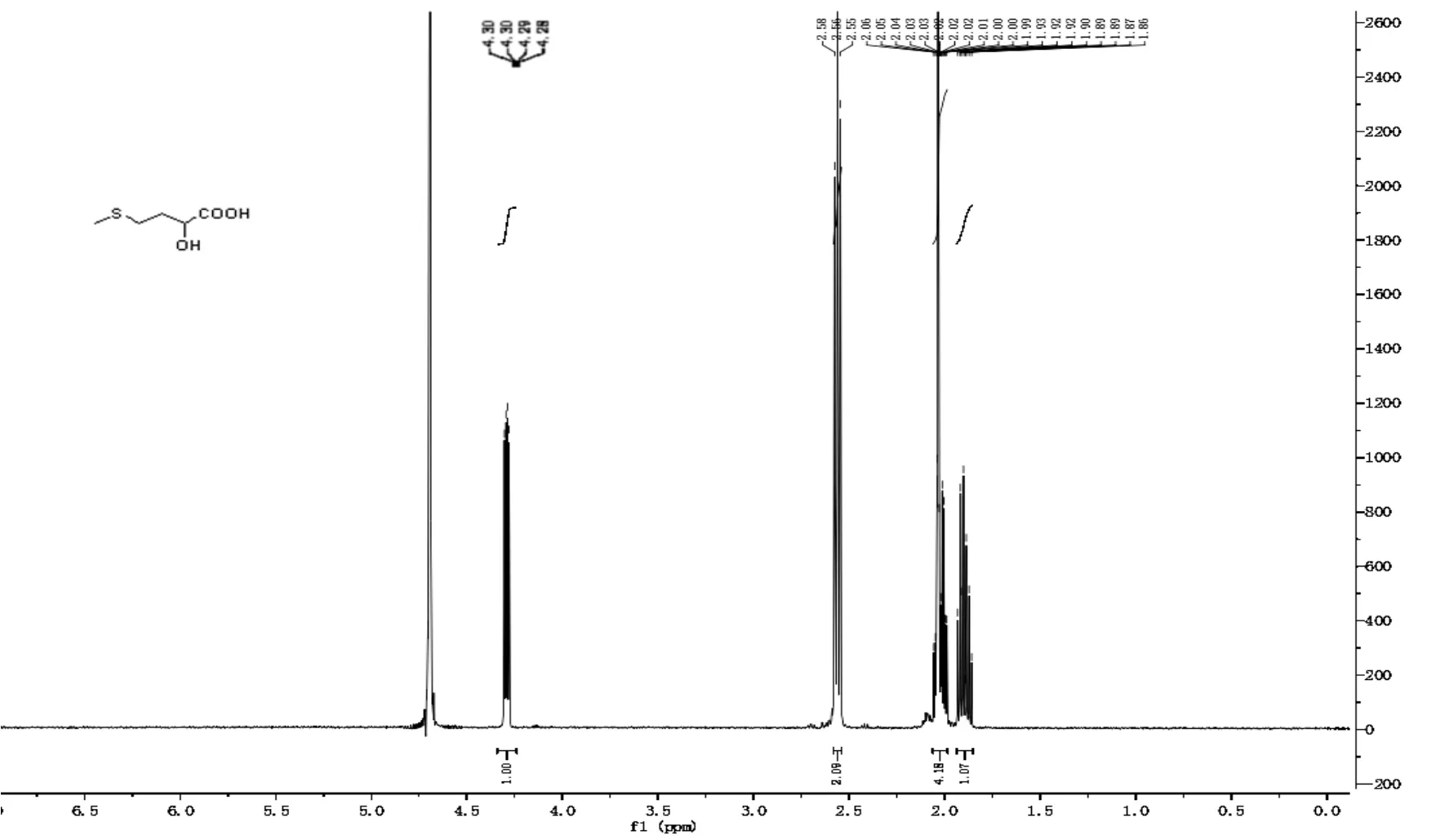
图7 目标产物核磁共振(1H NMR)分析谱图
3 结语
本文筛选得到21野生型菌株和10株工程菌株能以2-羟基-4-甲硫基丁腈为底物转化为2-羟基-4-甲硫基丁酸。其中,编号为ZJB12048的工程菌的活力最高。对反应温度,热稳定性,体系pH值,催化剂浓度等转化条件进行了优化。优化后的反应条件为:反应温度50°C,pH值7.0,催化剂浓度0.02 g/mL,底物浓度150 mmol/L。优化后反应速率由534.11 μmol·min-1·g-1DCW提高为1346.06 μmol·min-1·g-1DCW,共提高2.52倍。该菌株对2-羟基-4-甲硫基丁腈具有良好的催化效果。
利用HPLC、LC-MS和1H NMR对反应液中的产物进行分析鉴定,结果显示反应液中的产物确实是2-羟基-4-甲硫基丁酸。该菌株对2-羟基-4-甲硫基丁腈具有良好的催化效果。微生物催化剂不能连续重复使用,不能满足实际中的应用,但可以通过固定化和设计连续催化工艺来解决,相关工作正在进行中。
[1]张萍.“最廉价”的过瘤胃蛋氨酸——蛋氨酸羟基类似物(MHA)[J].乳业科学与技术,2001(2):35-36.
[2]MURPHY K G,BLOOM S R.Gut hormones and the regulation of energy homeostasis[J].Nature,2006,444(7121):854-859.
[3]王之盛,崔芹,刘永刚,等.蛋氨酸羟基类似物的抑菌和酸化剂效果研究[J].中国畜牧杂志,2006,42(13):20-22.
[4]TANG Xue,YANG Yonglan,SHI Yonghui,et al.Comparative in vivo antioxidant capacity of DL-2-hydroxy-4-methylthiobutanoic acid(HMTBA)and DL-methionine in male mice fed a high-fat diet[J].Journal of the Science of Food and Agriculture, 2011,91(12):2166-2172.
[5]聂伟,呙于明,杨鹰.蛋氨酸与蛋氨酸羟基类似物在蛋鸡日粮中应用效果研究[J].中国畜牧杂志,2007,43(9):22-24.
[6]RUEST,DENNIS A,TAKANO,et al.Liquid 2-hydroxy-4-methlythiobutyric acid and process for the preparation thereof: USP,4524077[P].1985.
[7]GRENDEL,ROBERT W,KLOPFENSTEIN,et al.Regeneration of sulfuric acid from sulfate by-products of 2-hydroxy-4-(methylthio)butyric acid manufacture:USP,5498790A[P].1993.
[8]WEIGEL,RODENBACH H,WECKBECKER,et al.Process for producing of 2-hydroxy-4-mehtylthiobutyric acid ammonium salt:USP,2006/0178529A1[P].2006.
[9]MATSUOKA,KAZUYUKI.Process for producing 2-hydroxy-4-methylthiobutyric acid:USP,5386056[P].1985.
[10]娄文勇,宗敏华,刘森林.微生物酶催化腈水解反应的研究进展[J].微生物学通报,2001,28(6):76-81.
[11]徐建妙,郑裕国,沈寅初.腈水解酶的来源、结构、作用机制及其应用[J].微生物学通报,2005,32(5):141-146.
[12]郑裕国,薛亚平,柳志强,等.腈转化酶在精细化学品生产中的应用[J].生物工程学报,2009(12):1795-1807.
[13]BULLE,OLIVIER F,PIERRARD,et al.Industrial scale process for the preparation of 2-hydroxy-4-methylbutyric acid using a nitrilase:USP:6180359B1[P].2001.
(责任编辑:朱小惠)
Screening and biotransformation optimization of a strain catalyzing 2-hydroxy-4-(methylthio) butyronitrile to methionine hydroxy analogue
LI Zongtong,JIN Liqun
(Institute of Bioengineering,Zhejiang University of Technology,Hangzhou 310014,China)
ZJB12048,a nitrilase-producing genetic engineering strain,was isolated.Under the optimized transformation conditions as followed,reaction temperature 50°C,initial pH value 7.0 (100 mmol/L citric acid/sodium citrate buffer solution),concentration of wet cells 0.02 g/mL and the concentration of substrates 150 mmol/L,2-hydroxy-4-(methylthio)butyronitrile were transferred into methionine hydroxy analogue by the rested cells.And the obtained product was identified as 2-hydroxy-4-(methylthio)butyric acid using HPLC,LC-MS and1H NMR.
screening;2-hydroxy-4-(methylthio)butyronitrile;2-hydroxy-4-(methylthio)butyric acid;nitrilase;identification
TQ925
A
1674-2214(2015)02-0007-05
2014-05-06
浙江省自然科学基金基础青年项目(20110208)
李宗通(1987—),男,河南焦作人,硕士,研究方向为生物催化与生物转化,E-mail:lizongtong_1987@126.com.

