能谱CT在预测肝硬化门脉高压食管静脉曲张出血风险的应用
王芳,沈加林,华静,华小兰
能谱CT是由高低能量(140kVp和80kVp)在0.5ms内实现瞬间切换后采集两组不同物质密度投影数据,重建出40~140keV共101个能量级的虚拟单能量图像[1-3]。能谱CT利用物质分离技术[4]得到的碘基值能直接反映组织的摄碘情况,间接反映组织的血供情况[5-6]。有学者发现能谱CT碘基值和CT灌注指标在反映血流动力学改变具有很好的相关性[7]。本文探讨能谱CT肝硬化门高压血流动力学改变,寻求一种无创方法评估肝硬化门高压,为预防食管静脉曲张出血(esophageal varices bleeding,EVB)提供重要的参考价值。
材料与方法
1.临床资料
回顾性分析本院2014年2月-11月经临床生化、影像学检查确诊为肝硬化41例,肝功能A级20例、B级13例、C级8例。其中乙肝17例,丙肝1例,血吸虫性肝硬化1例,酒精性肝硬化6例,自身免疫性肝病16例。排除肝癌,门静脉栓子,胃冠状静脉栓塞,脾切除,以及脾肾分流术的患者。所有出血患者在病情稳定后3d内行能谱CT扫描。选取无肝脏疾病而需要诊断其他腹部脏器疾病而行能谱CT检查46例作为对照组,所有对照组均不伴有其他影响肝血流动力学的疾病。
2.仪器与方法
采用GE Discovery CT 750HD(GE Healthcare,Wisconsin,USA)能谱CT扫描机对所有患者均行动脉期、门脉期、延迟期三期扫描。扫描范围为膈顶至双肾下极水平。扫描参数为:螺旋扫描,球管旋转速度0.8s/r,准直器宽度40mm,螺距系数1.375,层厚1.25mm,自动毫安技术,两种不同的Vp即(140kVp和80kVp)瞬间切换,视野350mm× 350mm。增强扫描采用非离子型碘对比剂(优维显,370mg I/mL)100mL,注射流率为4.0mL/s。动脉期开始时间由智能监测扫描触发,监测的兴趣区(ROI)设在降主动脉,降主动脉CT值达100HU后触发扫描,门脉期、延迟期扫描在动脉期结束后35s、90s开始。
3.观测指标与测量方法
将扫描所得数据采用AW4.4后处理工作站的能谱CT分析软件生成碘-水基物质图像。由两位具有五年以上诊断经验的放射科医师,在动脉期、静脉期轴位图像上选取肝门静脉左右支汇合层面,分别在肝左叶、右叶、尾状叶,脾脏避开大血管位置、门静脉主干设定面积约25mm2的类圆形ROI,测定ROI中的碘含量(图1)。以及测量门静脉主干内径(肝门静脉左右支汇合处)、脾静脉主干内径(脾静脉与肠系膜上静脉汇合处)。门静脉期冠状面图像上胃左静脉起始段设定面积约4mm2(即起自门静脉主干或脾静脉起始处1mm处)测量肝硬化组胃左静脉碘基值(图2)。两位放射科医师测量前均已经过训练,可以熟练的进行测量。取两位医师所测得的数据的平均值作为测量结果。CT下食管静脉曲张,即食管内壁结节状对比剂显影,两位医师结果不一致时经讨论后决定。
4.相关参数的计算方法

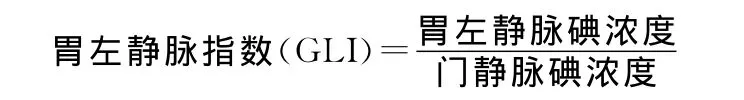
注:对于比值的测定主要是为了消除个体之间的差异以及个体之间循环血流速度的影响。
5.统计学方法
采用SPSS 20.0进行统计学分析。计量资料用均数±标准差表示,符合正态性分布的两组之间采用成组设计t检验,不符合正态性分布的采用非参数Wilcoxon秩和检验(表格中*表示非参数检验)。计数资料采用构成比表示,并采用卡方检验进行两组比较。对不同肝功能分级的相关参数进行单因素方差分析和均数两两比较。脾静脉内径与碘基值之间的相关性采用Spearman相关性分析。均以P<0.05为有统计学意义。根据诊断性实验方法计算敏感度及特异度,并绘制出ROC曲线,计算ROC曲线下面积,找出约登指数(敏感性和特异性-1)最高临界点。
结 果
1.一般资料
正常组和对照组之间年龄和性别(表1)之间没有统计学差异(P>0.05)。
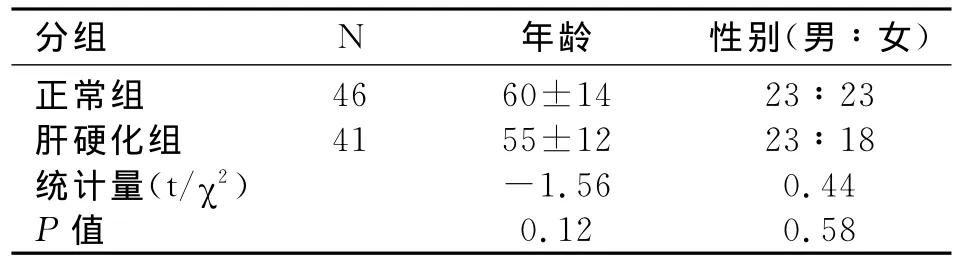
表1 正常组与肝硬化组一般资料比较
2.正常组与肝硬化组之间的比较
正常组和肝硬化组LSV、SIC具有统计学意义(P<0.05,表2)。肝硬化组的LSV、SIC较正常组低。
3.不同肝功能分级之间的比较
肝硬化组不同肝功能分级之间LIC、LSA具有统计学意义(P<0.05,表3)。随着肝功能分级的增加,LIC、LSA也随之增加。且Child-C级与Child-A级和Child-B级之间差异有统计学意义,Child-A级和Child-B级之间差异无统计学意义。其它参数差异均无统计学意义。
4.碘基值反映门高压血流动力学改变
碘基值与门脾静脉主干内径之间相关性的研究:门静脉主干内径<15mm为A组,≥15mm为B组,各参数之间差异均无统计学意义(表4)。脾静脉主干内径<10mm的为C组,>10mm的为D组。SIC、GLI具有统计学意义(表5)。D组GLI和SIC比C组高,且与脾静脉内径之间具有相关性,r分别为0.358、0.338。
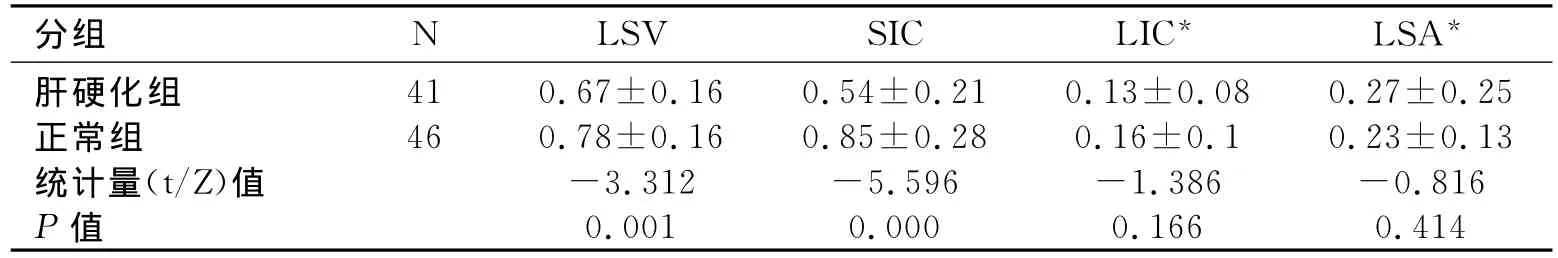
表2 正常组与肝硬化组能谱参数比较
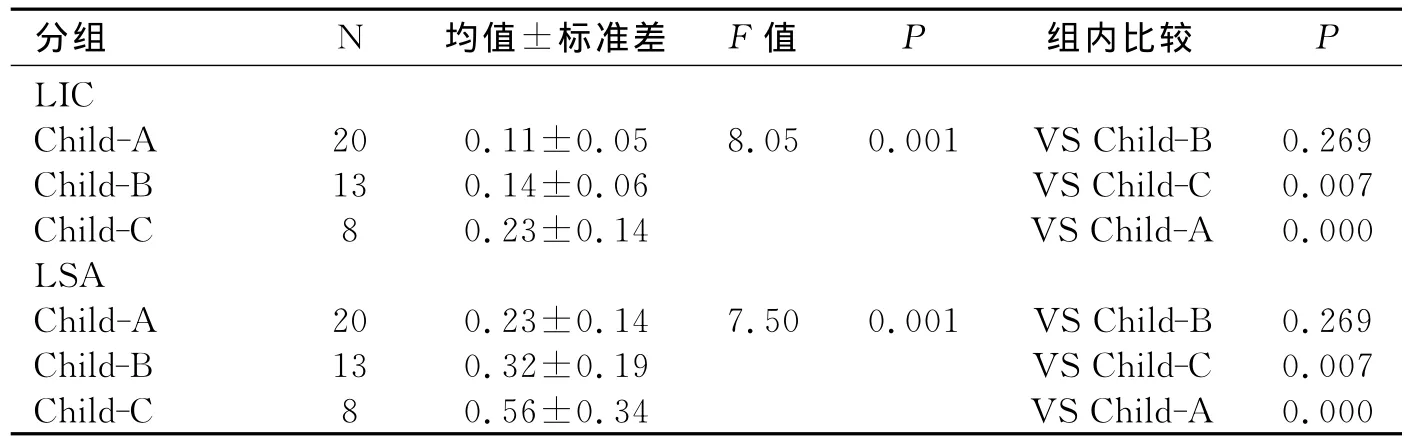
表3 肝硬化组不同肝功能分级之间能谱参数比较
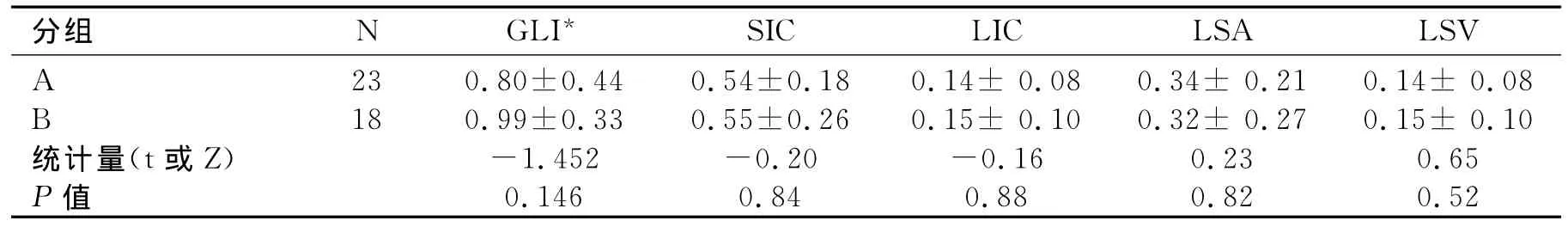
表4 A组(门静脉内径<15mm)与B组(门静脉内径≥15mm)能谱参数比较
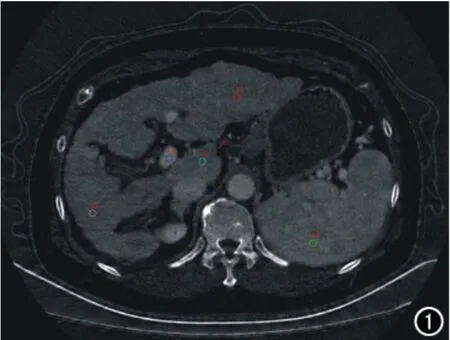
图1 门静脉期横轴面ROI。
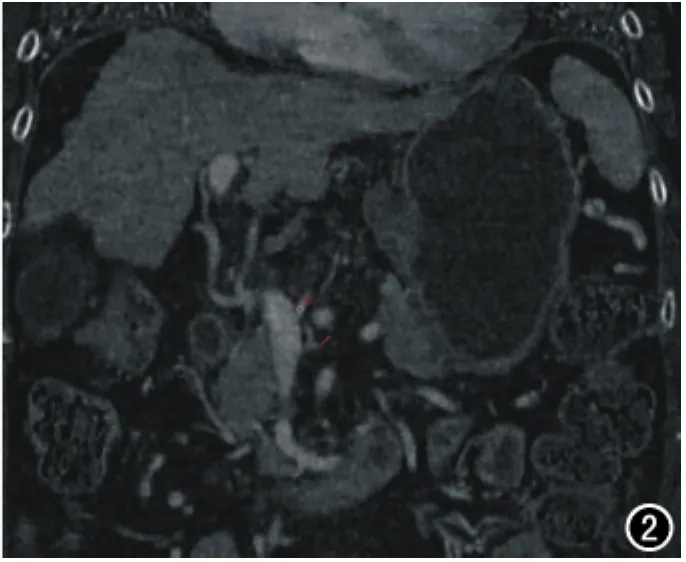
图2 冠状面胃左静脉ROI。
碘基值与食管静脉曲张及其破裂出血:CT下食管无曲张组与有曲张组比较GLI差异具有统计学意义(表6)。有曲张组的GLI大于无曲张组。肝硬化门高压出血组与未出血组LSV和GLI差异具有统计学意义(表7)。出血组的LSV较未出血组低,出血组的GLI较未出血组的高。
胃左静脉指数ROC曲线下面积为0.71,诊断出血风险的敏感度为82.4%,特异性为65.0%,临界值是0.87,可以作为肝硬化门脉高压EVB风险指标,即大于0.87时,应给予药物干预或胃镜下检查治疗,以预防EVB(图3)。
讨 论
肝静脉楔压(hepatic venous pressure gradient,HVPG)是反映肝硬化门脉压力的金标准,因其风险大、费用高而没有广泛运用于临床。当HVPG达到10~12mmHg时,肝硬化患者会出现失代偿表现,如腹水,食管静脉曲张(esophageal varices,EV)形成,当HVPG超过12mmHg时,EVB风险就会增加[8-10]。因此,对肝硬化患者门脉压力进行评估,能有效地预防EVB。
国内外学者研究了多种无创技术反映门高压以及EV,其中包括彩色多普勒超声、弹性超声、内镜超声等[11-15]。这些基于超声基础上的无创技术不仅受到被检者自身条件的限制,如肥胖、腹水等,而且还受到操作者的主观影响,如操作手法、角度,其临床应用受到限制。CT门静脉成像虽然可以直观地反映整个门脉系统,却只能从形态学上而没有从血流动力学方面来评估门高压以及EV程度[16]。肝硬化患者应定期行胃镜检查以评估EV发展变化情况。胃镜不仅能反映EV程度,而且还能在胃镜下进行治疗。然而其作为有创检查也不被患者接受,且易诱发EVB。能谱CT碘基值能反映血流动力学改变,研究门高压血流动力学改变,以减少频繁的胃镜检查,为预防EVB提供重要的参考价值。
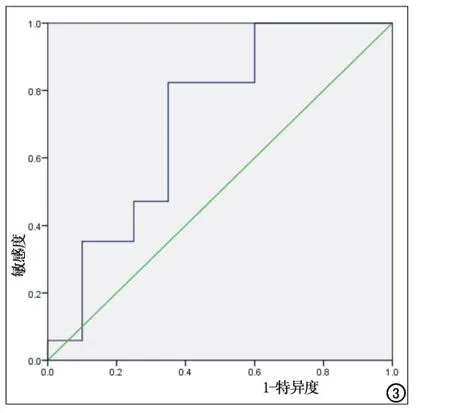
图3 胃左静脉指数ROC曲线。
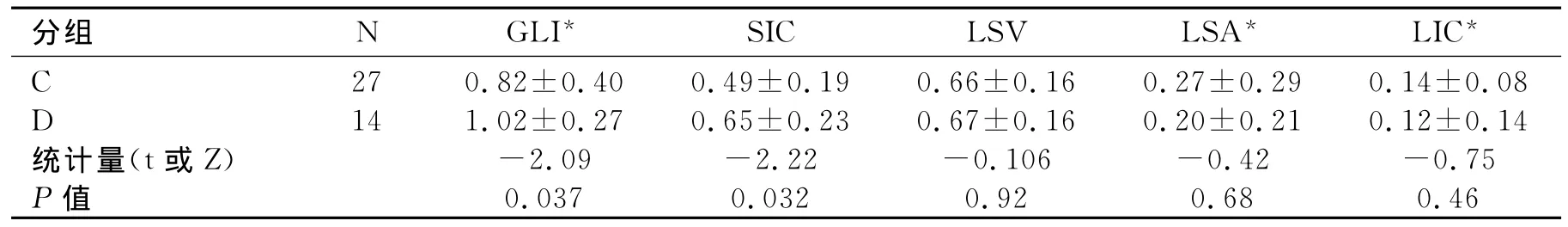
表5 C组(脾静脉内径<10mm)与D组(脾静脉内径≥10mm)能谱参数比较
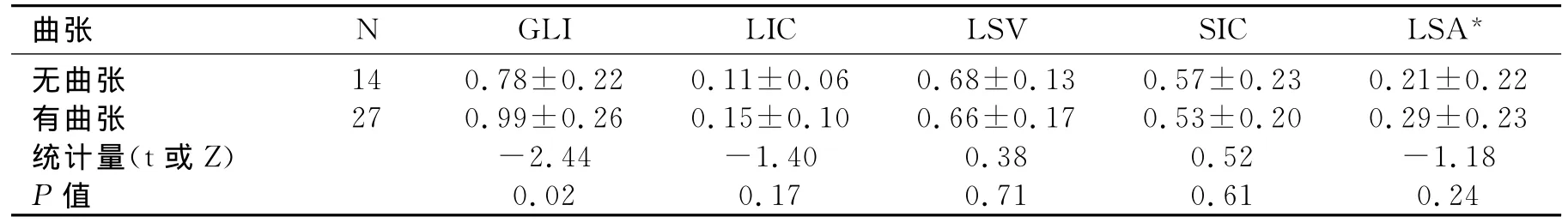
表6 EV(+)组与EV(-)组能谱参数比较
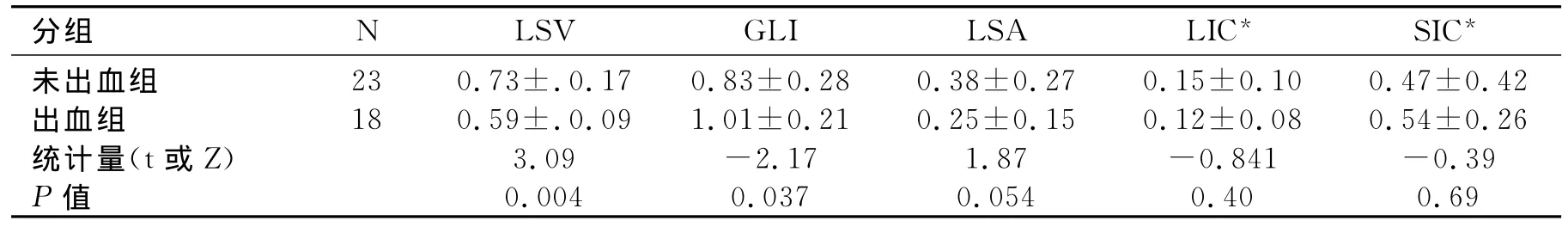
表7 出血组与未出血组能谱参数比较
1.门静脉高压形成机制
肝脏为双重血供,其中75%由门静脉供血,25%由肝动脉供血。当发生肝脏纤维化时,再生结节以及假小叶的形成导致肝内静脉扭曲变形,门静脉血液回流受阻是门静脉高压形成的始动因素。肝硬化早期肝脏通过自身调节作用来维持肝脏总灌注量相对稳定,即肝动脉血供代偿增加来弥补门静脉血供减少。当肝硬化进一步发展,肝动脉血供的增加不足以弥补门静脉血供减少,肝脏总灌注减少造成肝功能损害而出现失代偿表现。随着肝内阻力增加,门静脉压力随之增加。当门脉压力达到一定阈值时侧枝循环形成以减轻门脉压力。同时由于肝细胞变性、坏死,肝功能受损,NO等血管活性物质在肝内灭活减弱,导致内脏血管阻力降低及心输出量增加,使得内脏血流量增加,内脏血循环处于低阻力高动力的循环状态。因此,门高压形成初期为门静脉阻力增加所致,后期为内脏充血导致血流量增加所致。
2.碘基值反映不同肝功能分级之间血流动力学改变
肝功能分级反映的是肝脏储备能力,部分代偿期肝硬化患者门静脉血供降低,肝动脉血供代偿增加,而此时脾动脉供血尚未增加,即LIC以及LSA随着肝功能分级的增加而增加(表3)。肝硬化失代偿期肝脏动脉血供增加不足以代偿静脉血供减少,因此肝脏总灌注量减少,这种血流的改变导致了肝细胞受损、肝功能恶化,因此Child-C级的LIC较Child-A、B级进一步增加,说明肝功能的损害与肝灌注减少密切相关。
3.碘基值反映门高压血流动力学改变
门静脉高压形成初期为门静脉阻力增加所致,后期为血管活性物质NO增加导致脾脏充血及血流量增加为主。脾动脉血液经脾脏后再经脾静脉汇入门静脉。正常人门静脉血流约20%~30%来自脾动脉,而门高压时60%~70%来自脾动脉。脾静脉血流量回流增多维持和加重了门脉高压。因此,SIC在D组相对于C组大(表5)。另外据文献报道,门脉高压征主要包括门静脉主干内径≥15mm;脾静脉主干内径≥10mm[17]。且门、脾静脉内径不仅可以反映门脉压力,而且其还能预测EV程度。随着门、脾静脉内径逐渐增大,EV程度逐渐加重,且EVB风险也逐渐增高。Lee通过研究也发现门、脾静脉主干内径在一定范围内随着门脉压力的增高而增大[18]。本文研究发现A组和B组之间(表4),能谱CT碘基值没有统计学意义,而C组和D组(表5)在GLI、SIC具有统计学意义,且与脾静脉内径具有相关性,r分别为0.358、0.338。这可能与肝硬化门脉高压侧枝循环的开放,门静脉管径扩张程度减轻,脾静脉血流量增多脾静脉增宽有关。
4.碘基值反映食管静脉曲张及其出血风险
胃左静脉是食管静脉丛通向门静脉系统的主要通道,当门脉高压时,门静脉压力超过胃左静脉压力,导致血流从胃左静脉反流入食管静脉丛形成EV。本研究中EV组较无EV组GLI高,即胃左静脉分流导致胃左静脉血流增加,门静脉血流降低。当门脉压力超过12mmHg时,EVB风险增加。此时,胃左静脉血流进一步增高,脾脏被动充血,进一步维持和加重了门脉高压,最终导致EVB。因此,出血组的GLI较非出血组高,即门高压时胃左静脉分流增大,GLI增大。出血组的LSV降低也反映了脾静脉血流量的增加在维持门静脉高压中起着重要的作用。此研究结果与Adithan等[19]的结果类似。将出血组的和未出血组的GLI和LSV进行ROC曲线分析,选取截点,确定对出血风险的诊断价值。发现GLI的临界值为0.87时,ROC曲线下面积为0.71,诊断出血风险的敏感度82.4%,特异度65%,而LSV的ROC曲线下的面积仅为0.27,可见GLI有更高的诊断价值。因此监测胃左静脉血流有助于评估肝硬化门高压,从而为预防EVB提供重要参考价值。
能谱CT碘基值和CT灌注指标在反映肝硬化血流动力学改变具有很好的相关性,但能谱CT采用双低(低剂量及低辐射剂量)成像,使得能谱CT的辐射剂量远远低于CT灌注的辐射剂量。此外,门脉高压是肝癌形成的一个独立危险因素,能谱CT具有多参数成像以及最佳单能量成像等优势,使得其较胃镜、CT灌注更易检出肝硬化早期小肝癌。
当然,本文也有局限性:样本量较少,纳入肝硬化患者病因各异,可能导致数据偏倚;出血患者病情稳定后血流动力学较出血时有所改变。
综上所述,能谱CT胃左静脉指数可以作为预测EVB风险指标。对肝硬化患者进行能谱CT随访或筛查,以评估EV程度及破裂出血风险,选取0.87作为GLI监测预警指标进行药物干预或内镜下治疗以预防EVB,从而减少频繁的胃镜有创检查。能谱CT不仅能从形态学上反映EV,而且能从血流动力学方面为临床评估肝硬化门高压、预测EVB风险提供重要的参考价值。
[1] Yeh BM,Shepherd JA,Wang ZJ,et al.Dual-energy and low-kVp dual-energy and low-kVp CT in the abdomen[J].AJR,2009,193(1):47-54.
[2] Silva AC,Morse BG,Hara AK,et al.Dual-energy(spectral)CT:applications in ab-dominal imaging[J].Radiographics,2011,31(4):1047-1050.
[3] Krasnicki T1,Podgórski P,Guziński M,et al.Novel clinical applications of dual energy computed tomography[J].Adv Clin Exp Med,2012,21(6):831-841.
[4] Mendonca P,Lamb P,Sahani D.A flexible method for multi-material decomposition[J].IEEE Trans Med Imaging,2014,33(1):99-116.
[5] Lv P,Lin X,Gao J,et al.Spectral CT-preliminary studies in the liver cirrhosis[J].Korean J Radiol,2012,13(4):434-442.
[6] 赵丽琴,贺文,胡志海,等.动脉碘分数在不同肝功能分级肝硬化患者中的变化特点[J].首都医科大学学报,2013,34(3):229-332.
[7] Zhang LJ,Wu SY,Wang M,et al.Quantitative dual energy CT measurements in rabbit VX2liver tumors:comparison to perfusion CT measurements and histopathological findings[J].Eur J Radiol,2012,81(8):1766-1775.
[8] Addley J,Tham TC,Cash WJ.Use of portal pressure studies in the management of variceal haemorrhage[J].World J Gastrointest Endosc,2012,4(7):281-289.
[9] Hobolth L,Bendtsen F,Moller S.Indications for portal pressure measurement in chronic liver disease[J].Scand J Gastroenterol,2012,47(8-9):887-892.
[10] Wadhawan M,Dubey S,Sharma BC,et al.Hepatic venous pressure gradient in cirrhosis:correlation with the size of varices,bleeding,ascites,and child's status[J].Dig Dis Sci,2006,51(12):2264-2269.
[11] Kakutani H,Hino S,Koyama S,et al.How Do we select an endoscopic treatment for esophageal varices on the basis of hemodynamic analysis using color doppler endoscopic ultrasonography[J].Surg Laparosc Endosc Percutan Tech,2012,22(5):410-414.
[12] Mittal P,Gupta R,Mittal G,et al.Association between portal vein color Doppler findings and the severity of disease in cirrhotic patients with portal hypertension[J].Iran J Radiol,2011,8(4):211-217.
[13] Sgouros SN,Vasiliadis KV,Pereira S.Systematic review:endoscopic and imaging-based techniques in the assessment of portal haemodynamics and the risk of variceal bleeding[J].Aliment Pharmacol Ther,2009,30(10):965-976.
[14] Zardi EM,Di Matteo FM,Pacella CM,et al.Invasive and non-invasive techniques for detecting portal hypertension and predicting variceal bleeding in cirrhosis:a review[J].Ann Med,2014,46(1):8-17.
[15] de Franchis R,Eisen GM,Laine L,et al.Esophageal capsule endoscopy for screening and surveillance of esophageal varices in patients with portal hypertension[J].Hepatology,2008,47(5):1595-1603.
[16] Kang HK,Jeong YY,Choi JH.Three-dimensional multi-detector row CT portal venography in the evaluation of portosystemic collateral vessels in liver cirrhosis[J].Radiographics,2002,22(5):1053-1061.
[17] 涂蓉,张阳德,伍保忠,等.肝硬化CT分级方法研究[J].放射学实践,2003,18(9):621-623.
[18] Lee JY,Kim TY,Jeong WK,et al.Clinically severe portal hypertension:role of multi-detector row CT features in diagnosis[J].Dig Dis Sci,2014,59(9):2333-2343.
[19] Adithan S,Venkatesan B,Sundarajian E,et al.Color Doppler evaluation of left gastric vein hemodynamics in cirrhosis with portal hypertension and its correlation with esophageal varices and variceal bleed[J].Indian J Radiol Imaging,2010,20(4):289-293.