UPLC-MS/MS快速测定甘蓝类蔬菜中活性成分莱菔硫烷
李占省,刘玉梅*,方智远,杨丽梅,庄 木,张扬勇,李凌云,吕红豪,孙培田
(1.中国农业科学院蔬菜花卉研究所,北京100081;2.农业部蔬菜品质监测检验中心,北京100081)
十字花科芸薹属蔬菜(Brassica oleracea)如甘蓝、白菜、青花菜、花椰菜、芥蓝、苤蓝等含有丰富的粗纤维、蛋白质、维生素C和一些矿物质如钙、磷、铁、锌等。其中,芸薹属甘蓝类蔬菜如青花菜、甘蓝、羽衣甘蓝等还含有一种抗癌活性成分——莱菔硫烷(Sulforaphane,SF)(图1)。莱菔硫烷分子量为177.29,是一种异硫氰酸盐类物质。它在蔬菜中以4-甲亚磺酰基丁基硫甙(Glucoraphanin,GRA或RAA)的形式存在于植物液泡中。GRA自身并无生物活性,只有当细胞遭到破坏时才与细胞基质中黑芥子酶发生水解反应,生成莱菔硫烷[1-2]。研究表明,莱菔硫烷能够显著降低多种癌症的发病率如胃癌、肝癌、乳腺癌、结肠癌和肺癌等。此外,它在治疗近视、老年痴呆和心脑血管疾病方面也有一定的功效[3-10]。

图1 莱菔硫烷结构式
莱菔硫烷的检测方法有气相色谱(GC)、气相色谱-质谱(GC-MS)和高效液相色谱(HPLC)[11-12]。目前,人们多采用HPLC法测定莱菔硫烷含量,但莱菔硫烷在高温下不稳定且易降解,所以GC和GC-MS法逐渐被HPLC替代。由于HPLC法往往需要较长的洗脱时间或冲洗时间,检测比较耗时[13]。因此,建立一种快速、准确检测蔬菜中莱菔硫烷的方法,对于提高工作效率和减少试剂消耗具有重要价值。笔者采用酶解-萃取法提取莱菔硫烷,以甲醇和水为流动相,建立一种快速检测莱菔硫烷的超高效液相色谱-串联质谱法(UPLC-MS/MS)。
1 材料与方法
1.1 试验材料 莱菔硫烷标准样品购于美国LKTTM,纯度大于98%。将10 mg标准品用甲醇(HPLC)定容到10 ml棕色容量瓶中,配制成1 000 mg/L的母液,在-20℃低温、避光保存。根据需要吸取一定量的母液,将其分别稀释成0.1、0.5、1.0、5.0、10.0 和 20.0 μg/L 系列标准液。
1.2 样品采集 甘蓝类蔬菜被栽培于中国农业科学院蔬菜花卉研究所试验基地。分别对甘蓝类蔬菜可食性部分(商品器官)进行取样,即甘蓝(叶球)4份、青花菜(花球)4份、芥蓝(花薹)4份和苤蓝(球茎)4份。取样后,将其去杂、擦干,然后根据需要将一定量样品进行液氮处理,真空冷冻、干燥。
1.3 样品前处理 将真空冷冻、干燥好的样品统一机械粉碎成粉末,精确称取干燥样品0.5 g,按照料液比为1∶30的比例加入pH为7.0的缓冲液(磷酸二氢钾和磷酸氢二钾配制,0.1 mol/L),在室温下酶解1.5 h,加入30 ml乙酸乙酯进行萃取,5 500 r/min离心10.0 min,收集上清液,重复萃取2次后合并3次萃取液,将萃取液在35℃下旋转蒸干,最后用10.0 ml甲醇定容,过滤膜(0.22 μm),低温 -20 ℃保存。
1.4 色谱-质谱条件
1.4.1 色谱条件。Waters BEH 反相 C18(2.1 mm × 50.0 mm,1.7 μm),柱温30 ℃,流速0.25 ml/min,进样量10 μl,流动相为甲醇和水。方法为梯度洗脱,即B泵(甲醇)初始浓度为40%,A泵为60%,10 min时B泵变为100%,13 min时变为40%,A泵又重新变为60%,结束此次进样。
1.4.2 质谱条件。电喷雾离子源ESI(+),毛细管电压为3.0 kV,离子源温度为110℃,脱溶剂气温度为350℃,脱溶剂气流量为500 L/h,锥孔反吹气流量为50 L/h。检测模式为多反应监测扫描模式(MRM),见表1。保留时间为2.17 min。
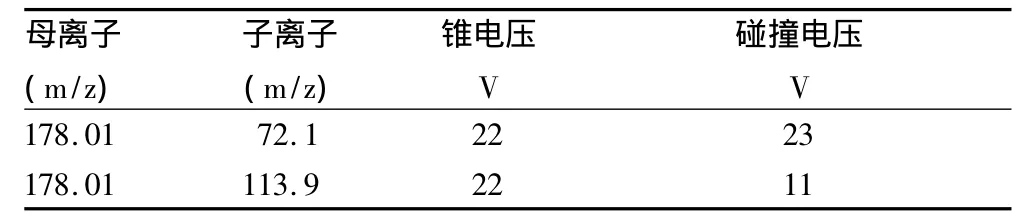
表1 多反应监测
2 结果与分析
2.1 样品提取条件的优化 莱菔硫烷具有旋光性,在高温和强酸碱条件下极不稳定[14]。莱菔硫烷前体GRA在不同的pH条件下生成的次生代谢产物不同,在pH 3.0~5.0时以腈类为主,在中性条件下以异硫氰酸酯类为主,而莱菔硫烷就属于该组分,在偏碱条件下以硫氰酸酯类为主,因此要提高莱菔硫烷的生成量,就必须严格控制酶解条件的pH环境[15-16]。
对莱菔硫烷萃取剂的选择,多采用乙酸乙酯[17]。该研究对乙酸乙酯、乙腈和二氯甲烷等有机溶剂展开了研究。乙腈与水互溶,分离比较困难;二氯甲烷具有中等毒性,微溶于水,与水接触后会缓慢释放出氯化氢气体,且其浓度比水大,分离繁琐;乙酸乙酯为萃取剂,不但可以降低成本和毒性,其浓度比水小,不溶于水,易收集上清液。从表2可以看出,乙酸乙酯加样回收率为94% ~97%,能够满足试验和生产需要。
2.2 色谱柱的选择 莱菔硫烷是一种饱和异硫氰酸盐,而流动相中甲醇浓度始终≥40%。Waters BEH反相C18(2.1 mm×50.0 mm,1.7μm)柱具有较好的峰对称性和稳定的柱效。1.7μm柱是通用的超高效液相色谱柱,具有较好的pH适应性,能够在1.0~12.0的范围内进行分离。三键键合式烷基柱使其具有较好的选择性和灵敏度。该研究表明,Waters BEH C18柱能够很好地分离和检测目标成分。
2.3 色谱条件的选择 常用的流动相有甲醇和水、乙腈和水。该研究采用梯度洗脱的方法,研究流动相分离莱菔硫烷的效果。从保留时间、杂质干扰程度、峰形和基线漂移等方面进行比较,发现在流速为0.25 ml/min,洗脱程序如表1所述条件下,莱菔硫烷能够快速地被分离和检测,保留时间为2.17 min,峰形对称,无杂质干扰(图2)。因此,最终选用甲醇和水作为流动相。

图2 样品中莱菔硫烷的MRM图谱
2.4 质谱条件的选择 将莱菔硫烷的标准液直接进样后全扫描,找出目标的分子离子峰,对其轰击产生子离子。在MRM模式检测条件下,将分子离子和1~2个信号强度适宜的子离子组成监测离子对,使得特征例子的丰度和比例达到最优。
2.5 线性范围和检出限 将系列标准液(0.1、0.5、1.0、5.0、10.0和20.0 μg/L)进行测定,以峰面积(Y)为纵坐标,以浓度为横坐标进行回归分析,获得线性方程。结果表明,线性方程为 Y=3.69e-4X - 1.27,R2=0.999 4,标准偏差为2.4%(RSD,n=6),可见线性方程良好。根据前处理过程,计算出仪器检出限(LOD,S/N=3)为0.06 ~0.15 μg/L,定量下限(LOQ,S/N=10)为0.3 ~0.4 μg/L,表明该方法具有较高的灵敏度,能够进行莱菔硫烷的准确检测。
2.6 准确度和精密度 分别以1.0和5.0μg/L 2个浓度进行加样,测定回收率和精密度。从表2可以看出,莱菔硫烷加样回收率为94% ~97%,相对标准偏差为0.6% ~1.2%,表明该方法准确度和精密度较好。
2.7 样品测定 根据建立的UPLC-MS/MS检测体系,对甘蓝类蔬菜4个变种共计20份材料进行测定。从表3可以看出,在供试材料中均检测到莱菔硫烷成分,且变种材料间存在差异。检测结果表明,在4种甘蓝变种中莱菔硫烷含量平均值分别为 38.65、376.54、151.31 和 133.79 mg/kgDW,可见青花菜花球中平均含量最高,甘蓝叶球中含量最低,芥蓝和苤蓝含量间差别不大。
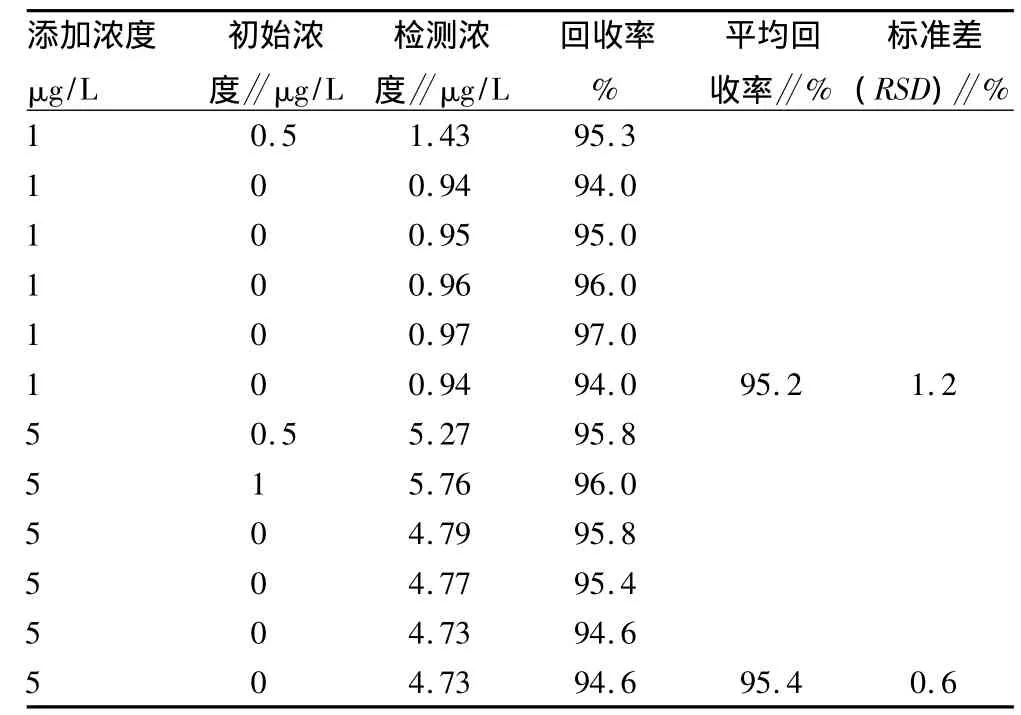
表2 莱菔硫烷回收率的测定

表3 蔬菜样品中来莱菔硫烷含量mg/kgDW
3 结论
该研究用Waters BEH C18柱,以甲醇和水为洗脱溶剂,采用梯度洗脱的方法可准确、快速分离目标物莱菔硫烷,峰形对称。该方法准确可靠,快速灵敏,能够满足在蔬菜中快速检测莱菔硫烷的需要。研究表明,在4个甘蓝类蔬菜变种中均能检测到莱菔硫烷成分,甘蓝叶球中莱菔硫烷含量为20.46 ~58.05 mg/kgDW,青花菜花球中含量范围为85.17 ~607.95 mg/kgDW,芥蓝花薹中含量范围为 45.59 ~210.12 mg/kgDW,苤蓝球茎中含量范围为 40.51~205.33 mg/kgDW,可见该法能够满足试验和生产需要。
[1]AGRAWAL S,WINNIK B,BUCKLEY B,et al.Simultaneous determination of sulforaphane and its major metabolites frombiological matrices with liquid chromatography-tandem mass spectroscopy[J].Journal of chromatography B,analytical technologies in the biomedical and life sciences,2006,840(2):99-107.
[2]ALVAREZ-JUBETE L,VALVERDE J,KEHOE K,et al.Development of a novel functional soup rich in bioactive sulforaphane using broccoli(Brassica oleracea L.ssp italica)florets and byproducts[J].Food Bioprocess Tech,2014,7(5):1310 -1321.
[3]ABDULL RAZISA F,IORI R,IOANNIDESC.The natural chemopreventive phytochemical R-sulforaphane is a far more potent inducer of the carcinogen-detoxifying enzymesystems in rat liver and lung than the S-isomer[J].International journal of cancer journal international du cancer,2011,128(12):2775-2782.
[4]ABBAOUI B,RIEDL K M,RALSTON R A,et al.Inhibition of bladder cancer by broccoli isothiocyanates sulforaphane and erucin:Characterization,metabolism,and interconversion[J].Molecular nutrition & food research,2012,56(11):1675 -1687.
[5]ABDULL RAZISA F,NOORNM.Sulforaphane is superior to glucoraphanin in modulating carcinogen-metabolising enzymes in Hep G2 cells[J].Asian Pacific journal of cancer prevention,2013,14(7):4235 -4238.
[6]AGYEMAN A S,CHAERKADY R,SHAW P G,et al.Transcriptomic and proteomic profiling of KEAP1 disrupted and sulforaphane-treated human breast epithelial cells reveals common expression profiles[J].Breast cancer research and treatment,2012,132(1):175 -187.
[7]ANDELOVA H,RUDOLF E,CERVINKA M.In vitro antiproliferative effects of sulforaphane on human colon cancer cell line SW620[J].Acta medica,2007,50(3):171 -176.
[8]ANNABI B,ROJAS-SUTTERLIN S,LAROCHE M,et al.The diet-derived sulforaphane inhibits matrix metalloproteinase-9-activated human brain microvascular endothelial cell migration and tubulogenesis[J].Molecular nutrition & food research,2008,52(6):692 -700.
[9]LIZ,GALLIU,BECKERL E,et al.Sulforaphane protects hearts from early injury after experimental transplantation[J].Annals of transplantation:Quarterly of the polish transplantation society,2013,18:558 -566.
[10]MYZAK M C,DASHWOOD R H.Chemoprotection by sulforaphane:Keep one eye beyond Keap1[J].Cancer letters,2006,233(2):208 -218.
[11]LIANGH,YUANQP,DONGH R,et al.Determination of sulforaphane in broccoli and cabbage by high-performance liquid chromatography[J].J Food Compos Anal 2006,19(5):473 -476.
[12]CAMPAS-BAYPOLI ON,SANCHEZ-MACHADOD I,BUENO-SOLANO C,et al.HPLCmethod validation for measurement of sulforaphanelevel in broccoli by-products[J].Biomedical chromatography:BMC,2010,24(4):387-392.
[13]CELIK H,ARIBURNU E,BAYMAK M S,et al.A rapid validated HPLC method for determination of sulforaphane and glucoraphanin in broccoli and red cabbage prepared by various cooking techniques[J].Anal Methods-Uk,2014,6(13):4559 -4566.
[14]LIANGH,YUANQP,XIAOQ.Effects of metal ions on myrosinase activity and the formation of sulforaphane in broccoli seed[J].JMol Catal BEnzym,2006,43(1/2/3/4):19 -22.
[15]ROSSITERJT,JONESA M,BONESA M.A novel myrosinase-glucosinolate defense system in cruciferous specialist aphids[J].Recent Adv Phytochem,2003,37:127 -142.
[16]ANGELINO D,JEFFERY E.Glucosinolate hydrolysis and bioavailability of resulting isothiocyanates:Focus on glucoraphanin[J].J Funct Foods,2014,7:67 -76.
[17]LI Z S,LIU Y M,FANG Z Y,et al.Variation of sulforaphane levels in broccoli(Brassica oleracea var.Italica)during flower development and the role of gene Aop2[J].J Liq Chromatogr R T,2014,37(9):1199 -1211.

