钙、镁浓度对厌氧氨氧化过程中N2O释放影响的研究
刘语涵,王敦球,金 樾,叶 晔,张文杰*
(1.桂林理工大学,广西矿冶与环境科学实验中心,广西桂林541004;2.桂林理工大学,土木与建筑工程学院,广西桂林541004;
3.环境保护部水专项管理办公室,北京100029)
厌氧氨氧化是指厌氧氨氧化菌(Anaerobic Ammonium-Oxidizing Bacteria,Anammox)在缺氧条件下,以 NO2--N为电子受体、NH4+-N为电子供体,将NO2--N和NH4+-N同时转化为 N2的过程[1-2]。20 世纪90 年代,Mulder等[3]在生物处理系统中首先发现了厌氧氨氧化现象。基于厌氧氨氧化技术的生物脱氮技术具有明显的优势。但是,在脱氮过程中,依旧会排放强温室气体N2O。N2O在大气中稳定不易分解,可不断积累,寿命长达120年以上,在光分解作用下与氧原子反应生成氮氧化物,会破坏臭氧层[4]。该文针对Ca、Mg等微生物新陈代谢和生长的必要元素对厌氧氨氧化过程中N2O的释放影响展开研究,从而为厌氧氨氧化的实际工程应用提供可靠的运行参数。
1 材料与方法
1.1 试验装置 该试验所使用的装置是上流式ANAMMOX(ANX)反应器(由有机玻璃加工制作而成)。反应器规格为9 cm×9 cm ×74 cm,有效容积为5.5 L,调节槽内径12.5 cm,高20 cm,内部填充粒径为1~3 mm的活性炭颗粒作为细菌载体。试验装置用黑布包裹避光,防止光线对细菌造成负面影响[5]。反应器外层夹套通入保温循环水,将内部温度维持在(32±1)℃。
ANX系统原理如图1所示。ANX系统的调节槽中设置pH在线监测仪器,通过酸液泵添加1.5 mol/L H2SO4控制其pH在7.4~7.6,并安装双叶片的搅拌机,使得调节槽内基质充分混匀;人工废水经进水泵后进入调节槽,搅拌均匀后经循环泵从ANX反应器底部进入反应主体部分,经污泥层的微生物处理后部分出水经溢流管流至调节槽和进水混合,其余的排出反应器;反应器主体内安装有折流挡板,防止污泥随着上升水流或反应产生的气体排出反应器,导致污泥流失,挡板起到泥水分离的作用;反应过程产生的气体由集气系统收集。
1.2 试验用水 该试验采用人工模拟废水,组分见表1,其中微量元素Ⅰ及微量元素Ⅱ主要组成及浓度参照Zhang等[6-7]方法投加(表2)。另外试验用水需经N2(纯度为99%)曝气,并在之后投加少量的无水亚硫酸钠,将溶解氧控制在0.1 mg/L以下。

表1 人工废水组分

表2 微量元素的物质组成
1.3 接种污泥 接种污泥取自实验室已培养1年[8]的污泥,具有较高厌氧氨氧化活性,其中主要功能性菌为Planctomycete KSU-1、Uncultured anoxic sludge bacterium KU-2 等。在试验反应器内接种污泥1 L。
1.4 试验方法 试验控制HRT在2.5 h左右,调节槽pH在7.4 ~7.6。试验过程分 I、II、III共3 个阶段,第 I阶段的人工废水中CaCl2·2H2O和MgSO4·7H2O浓度分别为200 mg/L和100 mg/L;第II阶段分别为300 mg/L和200 mg/L;第III阶段分别为400 mg/L和300 mg/L。
1.5 分析方法
1.5.1 常规指标测试分析。主要水质检测指标和分析方法见表3。

表3 分析项目及方法
1.5.2 N2O 测试分析。
(1)气体收集。完全封闭反应器,反应器中的气体从反应器顶部出气孔进入集气桶中,从集气桶上的阀门抽取集气桶上部空间的气体到气体采样袋中,气体采样袋需用桶内气体冲洗2次后再收集待测定。每天取1次样,标记好时间。
(2)气体分析。采用配有热导检测器(TCD)的上海精科GC-112A气相色谱仪测定收集气体中的N2O含量,使用的色谱数据工作站为浙江大学智达信息工程有限公司研发的N(VI)2000色谱数据工作站。使用的气体标准样品为上海神开气体有限公司生产的N2O标准样品,浓度为10×10-2,气体标准样品中的平衡气体为氩气。色谱仪的填充材料为JN PorapaKQ,柱长2 m,色谱条件:载气为高纯度氢气(纯度>99.999%),载气流量为4.1 ml/min,柱箱温度为 50 ℃,进样器温度为80℃,检测器温度为120℃,检测器电流为140 mA,进样量为 1 ml。
N2O含量的计算公式如下:
式中:C样品为气体样品中N2O的含量;A样品为气体样品中N2O的峰面积;C标样为气体标样中N2O的含量;A标样为气体标样中N2O的峰面积。
2 结果与分析
2.1 脱氮性能 由图2和图3可知,试验运行的23 d内反应器脱氮性能稳定。第I阶段,CaCl2·2H2O和 MgSO4·7H2O的投加量分别为200、100 mg/L,进水总氮负荷在1.8~1.9 kg/(m3·d)之间,进水 NH4-N和 NO2-N浓度分别为83.42、106.27 mg/L,出水中NH4-N和NO2-N浓度有较小的波动,但基本都在10 mg/L以下,NH4-N和NO2-N的去除率均在90%以上。第II阶段,CaCl2·2H2O和MgSO4·7H2O的投加量分别为300、200 mg/L,进水中总氮负荷有所降低,在1.6~1.7 kg/(m3·d)。进水NH4-N和NO2-N浓度分别为76.02、95.40 mg/L,出水中 NH4-N 浓度在5 mg/L 以下,去除率达到100%,出水中NO2-N浓度在8 mg/L以下,去除率达到98%。第III阶段,CaCl2·2H2O和MgSO4·7H2O浓度分别为400、300 mg/L,进水总氮负荷维持不变,系统脱氮性能优良,系统中NH4-N和NO2-N的去除效率接近100%。这说明系统中Anammox活性高,能够维持稳定的脱氮性能。
2.2 Ca2+、Mg2+浓度对N2O释放的影响分析 由图4可知,I、II、III阶段Ca、Mg元素投加量呈递增趋势。第I阶段,进水中的 Ca2+、Mg2+浓度分别为 95.68、12.35 mg/L,N2O 含量在0.176 7% ~0.303 1%,浓度波动不大,其平均值为0.243 3%;第 II阶段,进水中的 Ca2+、Mg2+浓度分别为124.60、10.65 mg/L,N2O 含量在0.132 2% ~0.362 9%,其平均值为0.253 6%;第III阶段,进水中的Ca2+、Mg2+浓度分别为70.65、7.88 mg/L,N2O 含量在 0.194 5% ~0.582 5%,其平均值为0.403 7%。
由表4可知,在第I、II阶段,提高进水中Ca2+、Mg2+浓度对系统中N2O的释放影响不大,N2O含量在0.25%左右。在第III阶段,CaCl2·2H2O和MgSO4·7H2O浓度分别为400、300 mg/L,而进水中检测到的 Ca2+、Mg2+浓度仅为70.65、7.88 mg/L,同时还发现人工模拟废水中有较多的沉淀物质。原因是配制废水时Ca2+、Mg2+和其他离子结合生成沉淀物,导致水中Ca2+、Mg2+流失。在此浓度下,N2O的释放量有所升高,最高达0.582 5%。该试验出水中均检测到较高浓度的Ca2+、Mg2+,说明反应器内并没有发生营养元素的不足,相反出现金属积累。可以认为试验中Ca、Mg元素是过量投加,并且不会影响系统中Anammox的生长。但是,较高浓度的Ca2+、Mg2+会促进温室气体N2O的释放,造成二次污染。
3 结论与讨论
Ca、Mg是微生物新陈代谢和生长的必要元素,在厌氧氨氧化活性修复中极为关键[9]。试验表明:①整个过程中,系统的脱氮性能很稳定,Ca2+、Mg2+浓度的变化对系统的影响可以忽略;②为减少N2O的释放,应尽量减少水中Ca2+、Mg2+浓度,其最佳投加量分别为 95.68、12.35 mg/L,CaCl2·2H2O和MgSO4·7H2O的最佳投加量分别为200、100 mg/L。该试验出水中均检测到较高浓度的Ca2+、Mg2+,说明反应器内并没有发生营养元素的不足,相反出现金属积累。因此,可以认为试验中Ca、Mg元素是过量投加,不会影响系统中Anammox的生长。但是,较高浓度的Ca2+、Mg2+会促进温室气体N2O的释放,造成二次污染。因此,从环保方面考虑,第I阶段的Ca、Mg投加量较为适宜,既能减轻N2O的释放,又能降低运行成本。随着N2O的减量化研究的不断深入,定能高效地减少其排放量,为我国的可持续发展做出贡献。
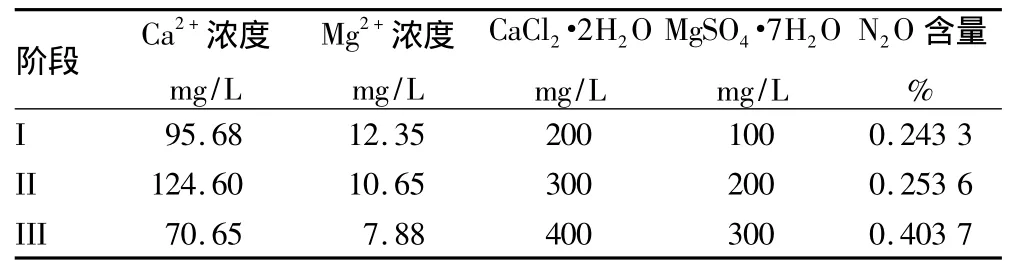
表4 3个阶段中Ca、Mg投加量及N2O含量
[1]VAN DE GRAAF A A,MULDER A,DE BRUIJN P,et al.Anaerobic-oxidation of ammonium is a biologically mediated process[J].Applied and environmental microbiology,1995,61(4):1246 -1251.
[2]VANDEGRAAFA A,DEBRUIJNP,ROBERTSONL A,et al.Autotrophlic growth of anaerobic ammonium-oxidizing micro-organisms in a fluidized bed reactor[J].Microbiology,1996,142(8):2187 -2196.
[3]MULDER A,VAN DE GRAAF A A,ROBERTSON L A,et al.Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor[J].FEMSmicrobiology ecology,1995,16(3):177 -184.
[4]SHARMA C,GUPTA P K,PARASHAR D C.Atmosheric nitrous oxide:Sources and sinks[J].Tropical ecology,1996,37(2):153 -166.
[5]JETTEN M SM,CIRPUS I,KART A L B,et al.1994 -2004:10 years of research on the anaerobic oxidation of ammonium[J].Biochem Soc Tran,2005,33:119 -123.
[6]ZHANGL,YANGJ,MA Y,et al.Treatment capability of an up -flow anammox column reactor using polyethylene sponge strips as biomass carrier[J].Journal of bioscience and bioengineering,2010,110(1):72 -78.
[7]ZHANG W J,ZHANG X H,WANG D Q,et al.Trace elements enhance biofilm formation in UASB reactor for solo simple molecule wastewater treatment[J].Bioresource technology,2011,102(19):9296 -9299.
[8]吴鲜梅,王敦球,李亮,等.厌氧氨氧化污泥启动EGSB反应器研究[J].水处理技术,2013,39(2):57 -61.
[9]LIU S,ZHANG Z T,NI J.Effects of Ca2+on activity restoration of the damaged anammox consortium[J].Bioresource technology,2013,143:315-321.

