4 种禽源病毒感染CEF 后β -catenin 基因的动态表达
傅安静,黄名英,高 艳,文 红
(1.成都农业科技职业学院,四川 成都611130 ;2.西南民族大学,四川 成都610041 ;3.成都温江区农法局动物检疫疾病控制中心,四川 成都 611130)
新城疫病毒(NDV)、高致病性禽流感病毒(AIV)、禽白血病病毒(ALV)、网状内皮增生症病毒(REV)严重危害养禽业。利用鸡胚成纤维细胞(CEF)探讨病毒与宿主相互作用的机制,对研究病毒感染及宿主抗病机理有重要意义。β连环蛋白(β-catenin)是Wnt/β-catenin 信号通路的一个关键参与者,Wnt/βcatenin 信号通路在细胞增殖分化、人类恶性肿瘤的发生发展中都有重要作用[1]。而有关病毒感染与Wnt/β-catenin 信号之间关系的研究多集中于丙型肝炎病毒(HCV)、人类疱疹病毒4 型(EBV)等致瘤性慢病毒,通过多种机制增加β-catenin 积累,激活其信号传导,从而促进细胞恶性转变及病毒感染伴随的癌症的发生[2-4]。ALV、REV感染后对β-catenin 表达的影响是否与人致瘤病毒相似;NDV、AIV感染后对βcatenin 表达的影响又如何,都未见文献报道。因此,本试验对这4 种病毒感染CEF 后β-catenin mRNA的动态表达进行检测,为探讨这几种病毒感染与机体的相互作用提供参考。
1 材料与方法
1.1 毒株和鸡胚 新城疫强毒株F48E9(NDVF48E9),购自中国兽医药品监察所;H5N1 亚型禽流感病毒(AIVH5N1)A/Duck/Guangdong/8/2001、禽网状内皮增殖症病毒(REV)SD9901 和禽白血病病毒(ALV)NX0101,均由中国动物卫生及流行病学中心提供。SPF 鸡胚,购自青岛易邦生物公司,由本实验室孵育至10 日龄后使用。
1.2 主要仪器 实时荧光定量PCR仪ABI 7300(ABI公司,美国);凝胶成像系统Doc2000(Bio-Rad 公司,美国);紫外分光光度计DU800(Beckman公司,美国);高速冷冻离心(Eppendorf 公司,德国)。
1.3 主要试剂 SYBR®Premix ExTaqTM,购自日本TaKaRa 公司;TRIZol Reagent,购自Invitrogen 公司;RT-PCR 试剂盒,购自博瑞克公司;DMEM/high 培养基、0.25%胰酶、小牛血清,均购自Hyclone 公司。
1.4 病毒感染CEF和采样 按文献[5]方法进行CEF的培养,待细胞长成单层后,继一代至24 孔板上,每孔接5×105个细胞。待细胞在24孔板上长成单层后,分别接100 个TCID50(组织细胞半数感染量)的病毒NDVF48E9、AIVH5N1、ALV和REV,同时设对照组,对照组加同样体积的Hank′s 液。NDVF48E9 和AIVH5N1 37 ℃感作30 min,ALV和REV感作60 min,添加含2%小牛血清的DMEM维持液,继续培养。NDVF48E9 和AIVH5N1 在接毒后3、6、9、12、24 h,ALV和REV在接毒后24 h、3、5、7 d 和8 d,每个时间点接毒组和对照组都设3 个复孔,加TRIZol 收集细胞,细胞于-80 ℃保存。
1.5 RNA的提取及质量检测与cDNA的合成 按说明书进行RNA的提取,电泳检测其完整性以及通过核酸蛋白检测仪测OD260/280的比值和RNA的浓度。cDNA的合成按照反转录试剂说明书进行。
1.6 β-catenin mRNA表达水平的检测及数据统计和分析 参考本实验室优化筛选的内参基因,以核糖体蛋白亚基4(RPL4)作为内参基因。用Rrt-PCR方法对样本中β-catenin mRNA表达量进行检测,引物序列为PF:5′-TGCTACAGCCGTTTCTAAT-3′,PR:5′-GCTACAATAACTTTGGGATAA-3′,反应体系为:SYBR Green I 10 μL,ROX 0.4 μL,PF、PR 各0.5 μL,cDNA2 μL,去离子水6.6 μL,共20 μL 反应体系。反应条件为:95 ℃5 min;95 ℃30 s,52 ℃30 s,72 ℃30 s,共40 个循环。对细胞样品中β-catenin mRNA的表达量进行相对定量[6],同时用t检验对数据进行统计学处理。以对照组细胞的β-catenin mRNA表达量为“1”,接毒组是对照组的倍数。
2 结果
2.1 病毒感染后细胞病变情况及病毒的Rrt-PCR检测结果 NDVF48E9 接毒组细胞9 h 开始出现细胞病变,24 h 时细胞病变达到60%,30 h 时细胞病变达到90%;AIVH5N1 接毒组细胞12 h 时开始出现细胞病变,24 h 时细胞病变达到40%,30 h时细胞病变达到80%;ALV和REV接毒组细胞无细胞病变和死亡,但是ALV和REV都是在感染CEF 后7 d 检测到病毒;对照组无细胞病变和死亡,说明4 种病毒成功感染CEF。接毒后的细胞形态见图1。
2.2 RNA质量检测结果 RNA样本的电泳检测见图2,结果显示,3 条带分别为5 SrRNA、18 SrRNA、28 SrRNA;所有RNA样本的核酸蛋白检测仪检测OD260/280比值都在1.8~2.0 之间。说明所提取的RNA符合要求。
2.3 4 种禽源病毒感染后β-catenin mRNA的动态表达
2.3.1 AIVH5N1 感染后β-catenin mRNA的动态表达 AIVH5N1 感染CEF 后β-catenin mRNA的表达水平如图3 所示。结果显示,AIVH5N1 感染后3h 诱导β-catenin mRNA的表达,接毒组是对照组的3.14 倍,差异极显著(P<0.01);接毒后6 h 时略高于对照组,是对照组的1.12 倍,无统计学意义;随后β-catenin mRNA的表达水平降低,接毒后9、12、24 h 时接毒组分别是对照组的0.5、0.03、0.3 倍,其中12 h 时差异极显著(P<0.01)。

图1 接毒后各组细胞形态
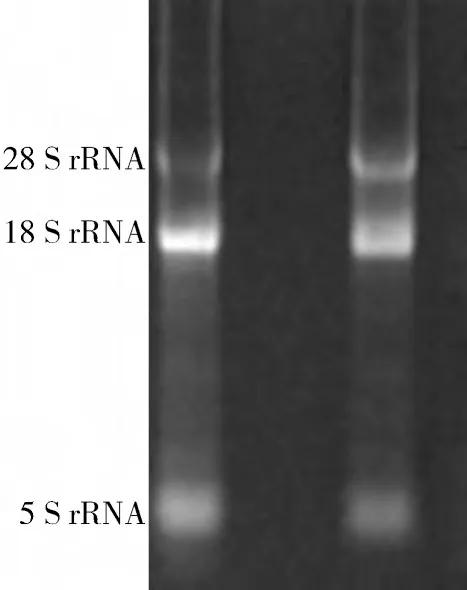
图2 R NA电泳结果
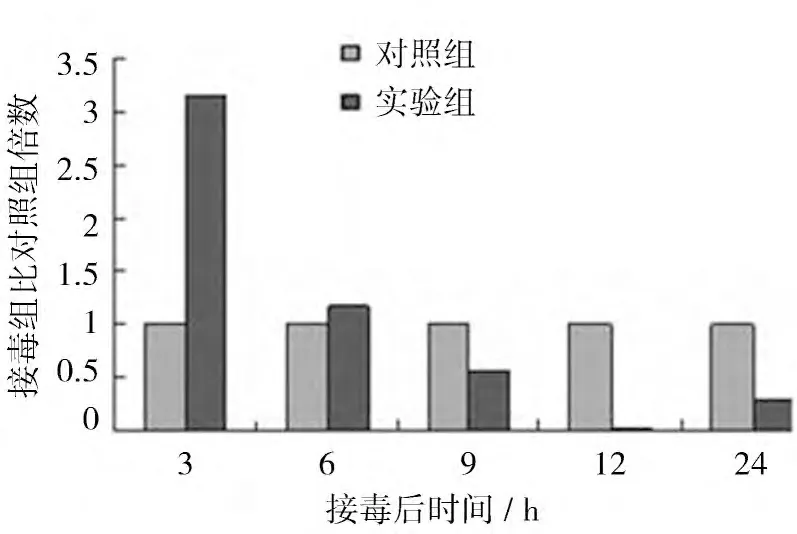
图3 AIV感染CEF 后β-cateninmR NA的表达量比对照组
2.3.2 NDVF48E9 感染后β-catenin mRNA的动态表达 NDVF48E9 感染CEF 后β-catenin mRNA的表达水平如图4 所示。结果显示,NDVF48E9 感染后3 h 诱导β-catenin mRNA的表达,接毒组是对照组的1.55 倍,无统计学意义;随后,接毒组细胞β-catenin mRNA表达水平降低,感染后6、9、12、24 h 接毒组β-catenin mRNA表达水平分别是对照组的0.84、0.22、0.53、0.25 倍,其中接毒后9、24 h 时差异显著(P<0.05)。

图4 NDV感染CEF 后β-cateninmRNA的表达量比对照组
2.3.3 ALV感染后β-catenin mRNA的 动态 表达ALV感染CEF 后β-catenin mRNA的表达水平如图5所示。结果显示,ALV感染后24 h,接毒组β-catenin mRNA的表达水平略低于对照组,是对照组的0.82倍,无统计学意义;随后诱导β-catenin mRNA的表达,接毒后3、5、7、8 d时,接毒组细胞β-catenin mRNA的表达水平分别是对照组的6.20、3.11、6.70、2.21倍,其中3、7 d 时差异极显著(P<0.01),5 d 时差异显著(P<0.05)。
2.3.4 REV感染后β-catenin mRNA的动态表达
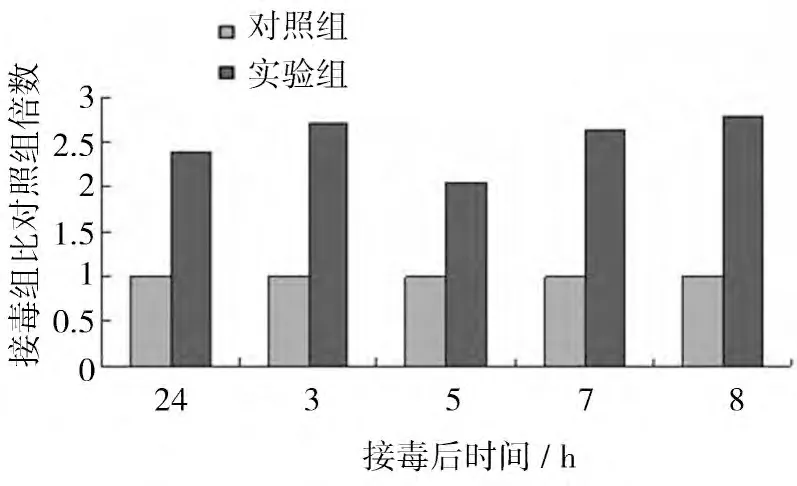
图5 ALV感染CEF 后β-cateninmR NA的表达量比对照组
REV感染CEF 后β-catenin mRNA的表达水平如图6 所示。结果显示,REV感染后诱导β-catenin mRNA的表达,接毒后24 h、3、5、7、8 d 接毒组βcatenin mRNA的表达水平分别是对照组的2.38、2.71、2.05、2.64、2.80 倍,差异均显著(P<0.05)。
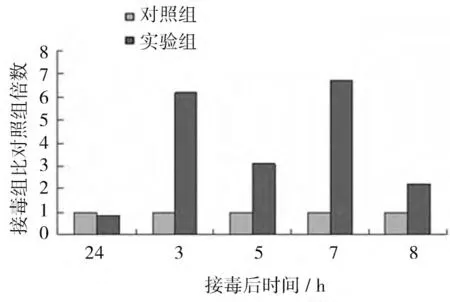
图6 R EV感染CEF 后β-cateninmR NA的表达量比对照组
3 讨论与小结
4 种禽源病毒感染后对CEF 内β-catenin mRNA表达的影响 本研究显示,β-catenin 参与NDV、AIV、REV和ALV的感染应答,但表达模式不同:NDV、AIV感染初期都诱导β-catenin mRNA的表达,感染中、后期抑制β-catenin mRNA的表达;REV和ALV感染后均诱导β-catenin mRNA的表达。
一些病毒的体内或体外感染研究中,感染后抑制机体β-catenin 表达的报道很少见。GSK-3β是β-catenin 降解复合体的重要成员之一,是βcatenin 的负调节物,该酶激活会抑制β-catenin 的积累[7]。Wnt/β-catenin 信号传导途径下游的效应物TCF-4 可能与HIV形成多蛋白复合体,导致HIV转录的抑制,而通过转染显性负相突变体阻断TCF-4 或β-catenin 的活性,则又增强HIV的复制[8]。这些有关HIV的资料表明,病毒感染后有可能通过一些机制抑制Wnt/β-catenin 信号传导而致病,或诱导细胞凋亡,或增强病毒复制。NDV感染后能引起宿主细胞凋亡,而研究表明,NDV引起的细胞病变效应是由凋亡引起的[9-10]。AIVH5N1 感染也会诱导细胞凋亡,包括鸭胚成纤维细胞(DEF)、人气管上皮细胞、人肺癌细胞系A549、MDCK 细胞等,研究表明,H5N1 亚型AIV导致哺乳动物气管上皮细胞死亡是由于细胞凋亡的诱导[11-13]。Wnt/β-catenin 信号通路参与调控细胞凋亡[14],这就提示了Wnt/β-catenin 信号通路在NDV、AIV感染诱导细胞凋亡,引发细胞病变死亡中发挥作用的可能性。
REV和ALV感染CEF 后持续诱导β-catenin mRNA的表达,这与一些人类致瘤性病毒感染后βcatenin 的表达模式相似。丙型肝炎病毒(HCV)的非结构蛋白5A(NS5A)可通过激活PI3K 和Akt 激酶而刺激GSK-3β的磷酸化,使其失活,导致β-catenin的积累和β-catenin 依赖性转录的增强;或者可能单独与p85形成复合体,与β-catenin 直接作用,激活βcatenin 信号[8-9]。EBV的潜伏膜蛋白(LMP)同样可通过一些途径激活β-catenin 信号,导致β-catenin 的高表达和积累,成为其致细胞恶性转变和肿瘤产生的诱因[4]。REV和ALV都是致瘤性慢病毒,其感染后β-catenin mRNA的表达模式与人类致瘤病毒相似,由此可推测Wnt/β-catenin 信号通路可能也在REV和ALV的致病中发挥了重要作用。
这4 种病毒感染后通过何种蛋白成分、何种途径影响Wnt/β-catenin 信号通路,作用如何都有待研究,但上述结果为进一步研究病毒感染致病与机体相互作用的分子机制提供了有价值的参考。
[1]Nusse R.Wnt signaling in disease and in development[J].Cell Res,2005,15(1):28-32 .
[2]Milward A,Mankouri J,Harris M.Hepatitis Cvirus NS5Aprotein interacts with beta-catenin and stimulates its transcriptional activity in a phosphoinositide-3 kinase-dependent fashion[J].JGen Virol,2010,91(2):373-381.
[3]Park CY,Choi SH,Kang SM,et al.Nonstructural 5Aprotein activates beta-catenin signaling cascades:implication of hepatitis Cvirus-induced liver pathogenesis[J].JHepatol,2009,51(5):853-864.
[4]Tomita M,Dewan MZ,Yamamoto N,et al.Epstein-Barr virusencoded latent membrane protein 1 activates beta-catenin signaling in Blymphocytes[J].2009,100(5):807-812
[5]殷震,刘景华.动物病毒学[M].2 版.北京:科学出版社,1997:223-224.
[6]Vandesompele J,De Preter K,Pattyn F,et al.Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J].Genome Biol,2002,3(03):43.
[7]吴桐,庞小颖,张浩.Wnt 信号途径的分子机制[J].食品与药品,2006,8(7):5-8.
[8]Kumar A,Zloza A,Moon R T,et al.Active beta-catenin signaling is an inhibitory pathway for human immunodeficiency virus replication in peripheral blood mononuclear cells[J].JVirol,2008,82(6):2813-2820.
[9]Ravindra P V,Tiwari AK,Sharma B,et al.HN protein of Newcastle disease virus causes apoptosis in chicken embryo fibroblast cells[J],Arch Virol,2008,153:749-754.
[10]Ravindra P V,Tiwari AK,Ratta B,et al.Newcastle disease virus-induced cytopathic effect in infected cells is caused by apoptosis[J].Virus Research,2009,141:13-20.
[11]Ueda M,Daidoji T,Du A,et al.Highly pathogenic H5N1 avian influenza virus induces extracellular Ca2+influx,leading to apoptosis in avian cells[J].JVirol,2010,84(6):3068-3078.
[12]Lam WY,Tang JW,Yeung AC,et al.Avian influenza virus A/HK/483/97(H5N1)NS1 protein induces apoptosis in human air-way epithelial cells[J].JVirol,2008,82(6):2741-2751.
[13]Yng W,Qu S,Liu Q,et al.Avian influenza virus A/chicken/Hubei/489/2004(H5N1)induces caspase-dependent apoptosis in a cell-specific manner[J].Mol Cell Biochem,2009,332(1-2):233-241.
[14]韩琳,冯新港.Wnt 信号通路及其在动物生长发育过程中的作用[J].中国兽医寄生虫病,2008,16(3):47-52.

