胶东半岛地区鸡源空肠弯曲杆菌毒力基因携带状况调查
翟海华 ,王 娟,盖文燕,黄秀梅,曲志娜,王君玮,常维山
(1.山东农业大学动物科技学院,山东 泰安271018 ;2.中国动物卫生与流行病学中心,山东 青岛 266032)
空肠弯曲杆菌是全球范围内引起人类腹泻的主要细菌性病原菌之一,是一种人兽共患病病原菌。空肠弯曲杆菌可在多种家禽、家畜和野生动物的肠道内定植,特别是禽类,所以这些动物都是潜在的感染源,家禽被认为是感染人类的最主要的来源[1]。被污染的食物和水以及与动物的直接接触都是传播空肠弯曲杆菌的主要途径。空肠弯曲杆菌的致病机制包括粘附、趋化、定植、侵袭,产生毒素以及与致病相关的分泌蛋白等,虽然人们对本菌的发病机制还并不明确,但研究证实毒力基因是主要的致病因素。为了解胶东半岛地区空肠弯曲杆菌的分布、毒力因子的流行情况,本试验对胶东半岛地区不同来源的禽源空肠弯曲杆菌进行了分离鉴定,并选择了与上述致病机制相关的14 种毒力基因,合成了相应的引物,进行毒力基因的检测,为分析菌株之间的差异以及细菌可能的致病力提供了线索。
1 材料与方法
1.1 培养基及主要试剂 Cary-Blair 氏运送培养基(北京陆桥生物技术有限责任公司),空肠弯曲杆菌选择性琼脂基础以及配套试剂(Sigma 公司,哥伦比亚血琼脂基础培养基(OXOID公司);2×TaqPCR Master Mix(Promega 公司),DNAMarker DL-2 000[TaKaRa 宝生物工程(大连)有限公司];新鲜绵羊血,氧化酶试纸,3%过氧化氢酶试剂,1%马尿酸钠,茚三酮(青岛海博生物科技公司);API Campy Kit(法国生物梅里埃公司)。
1.2 样品来源 共238 份样品,均来自胶东半岛地区。其中2 个市场上出售活鸡的泄殖腔拭子20份,2 家大型禽屠宰场鸡盲肠样品66 份,3 家养鸡场泄殖腔拭子152 份。
1.3 试验菌株 空肠弯曲杆菌标准菌株(ATCC3 3560),结肠弯曲菌,大肠杆菌,鼠伤寒沙门菌,金黄色葡萄球菌,粪肠球菌,阪崎肠杆菌的标准菌株均由中国动物卫生与流行病学中心动物产品安全监测室保存。
1.4 样品采集与运送 养鸡场和活禽市场:采集被检鸡的泄殖腔拭子,共采集泄殖腔拭子样品172 份。屠宰场:屠宰线上采集鸡盲肠段,共采集盲肠样品66 份。所有样品采集后均置于备有冰袋的泡沫盒中尽快运送至实验室。
1.5 细菌分离与鉴定
1.5.1 细菌分离与纯化 泄殖腔拭子直接划线接种于空肠弯曲杆菌选择培养基。对盲肠样用接种环勾取少量盲肠盲端内容物,划线接种于空肠弯曲杆菌选择培养基上。将划好的培养基放入厌氧培养盒内,加上微需氧产气袋,密封后42 ℃培养36~48 h。挑取疑似菌落接种于哥伦比亚血平板进行纯化,纯化2~3 代,对纯化好的菌株进行血清保存。
1.5.2 模板制备 采用煮沸法提取模板:用接种环挑取哥伦比亚培养基上的适量菌落于500 μL灭菌的蒸馏水中,涡旋混匀,12 000 r/min 离心5 min,移去上清;再加入200 μL 灭菌水,吹打混匀,放入100 ℃水浴锅内作用10 min;取出立即冰浴5~10 min,12 000 r/min 离心5~10min,取上清于新的1.5 mL 离心管中,置于-20 ℃冰箱中备用。
1.5.3 菌株初步鉴定 对可疑菌落进行革兰染色、氧化酶试验、过氧化氢酶试验和马尿酸钠水解试验,按照GB/T 4789.9-2003 进行菌株的鉴定。符合条件的菌株进一步用API 试剂盒进行空肠弯曲杆菌的鉴定,根据API 判定标准进行结果判读。
1.5.4 PCR鉴定 参照Van 等[2]的方法选择16SrRNA基因设计合成引物,片段大小为733 bp。PCR反应体系(25 μL):2×TaqPCR Master Mix 12.5 μL,DNA模板1.5 μL,上下游引物各0.5 μL,双蒸水9 μL。循环参数优化为:94 ℃预变性5 min,94 ℃30 s,56 ℃30 s,72 ℃1 min,30 个循环,72 ℃延伸7 min。将PCR 产物于1.2%琼脂糖(0.5×TBE)进行凝胶电泳,溴化乙锭(EB)染色后,在凝胶成像仪上观察结果。试验以空肠弯曲杆菌ATCC33560为阳性对照,其他非空肠弯曲杆菌为阴性对照。
1.6 毒力因子检测
1.6.1 引物设计 基因cadF和cdtC引物根据Bang[3]等的试验方法,基因flaA和racR引物是根据薛峰[4]等介绍的方法,其他10种毒力基因引物是根据GenBank公布的基因序列设计的,引物序列、片段大小和退火温度,见表1。引物由上海生工生物工程技术服务有限公司合成。
1.6.2 毒力基因扩增 经PCR鉴定为空肠弯曲杆菌阳性的模板,进行相应毒力基因的扩增。反应体系为25 μL体系:2×TaqPCR Master Mix 12.5 μL,DNA模板1.5 μL,上下游引物各0.5 μL,双蒸水9 μL。PCR扩增条件为94 ℃预变性5 min,94 ℃30 s,43 ℃~56 ℃30 s,72 ℃1 min,30 个循环,72 ℃延伸7 min。扩增结束后,取5 μL PCR 扩增产物进行电泳,置于凝胶成像系统获取图像并分析电泳结果。PCR产物胶回收后,采用PCR 产物直接测序方法进行测序。

表1 毒力基因PCR 引物
2 结果
2.1 菌株鉴定
2.1.1 初步鉴定 在空肠弯曲杆菌选择性培养基上可疑菌落呈灰白色或浅红色,半透明,扁平湿润有光泽,有呈沿接种线向外扩散的趋势。革兰染色为阴性,镜检呈逗点状,若菌体相连,呈螺旋形或海鸥形。凡是镜检符合弯曲杆菌形态特征,氧化酶试验阳性,过氧化氢酶试验阳性,马尿酸盐水解试验阳性的可疑菌再进行API 鉴定,根据标准判读培养结果。
2.1.2 PCR 鉴定 利用所建立的方法,对分离到的可疑菌株进行PCR 鉴定,结果238 份采集的样品中共分离到107 株空肠弯曲杆菌,分离率为45%,PCR 结果见图1。
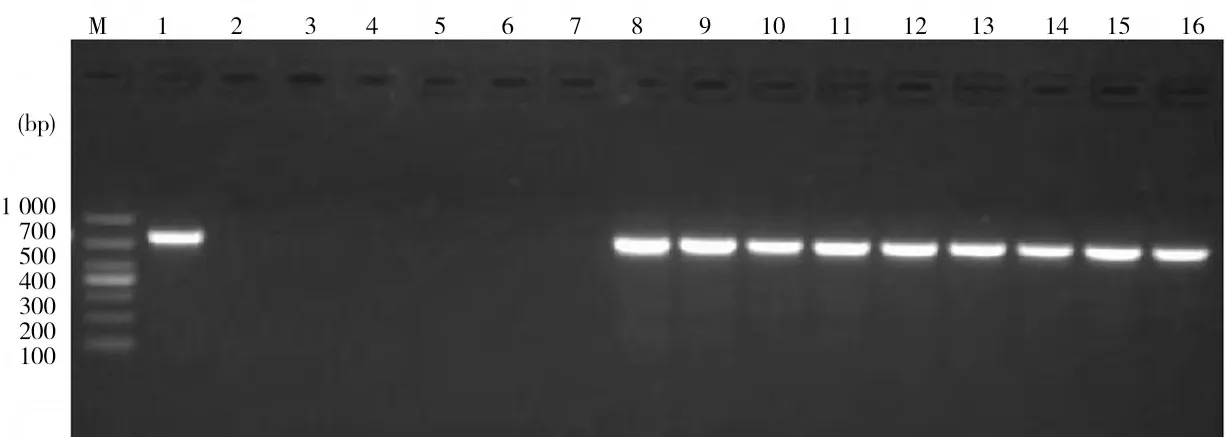
图1 空肠弯曲杆菌PCR 检测结果
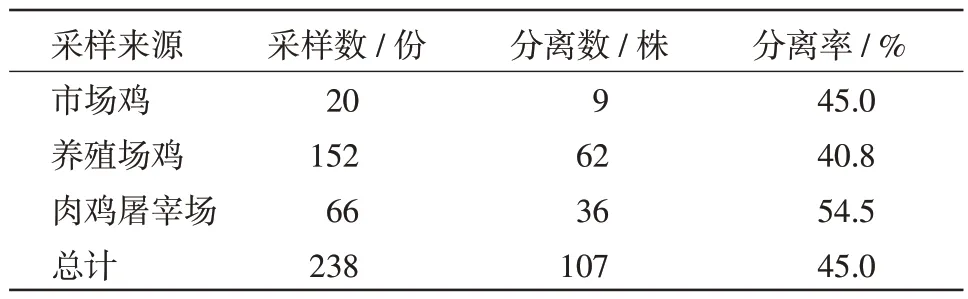
表2 空肠弯曲菌分离结果
2.2 毒力基因检测结果 14 种空肠弯曲杆菌毒力基因PCR 扩增产物结果见图1,以空肠弯曲杆菌参考菌株作对照,并对PCR 产物进行测序,经比对PCR 产物是目的基因产物。空肠弯曲杆菌分离株各个毒力基因的检出率如图3 所示。针对所检测的14 种毒力因子,107 株空弯分离株中有4 株含有全部14 种毒力因子,占总分离数的3.7%,39 株含有13 种毒力因子,占总数的36.4%,38 株含有12 种毒力因子,占总数的35.5%,23 株含有11 种毒力因子,占总数的21.5%,还有3 株含有10 种毒力因子,占总数的2.8%。
3 讨论
娜仁高娃等[5]从700 多份新鲜鸡粪样品中共分离到空肠弯曲杆菌208 株,分离率为26.9%。陈荀等[6]从养殖场和屠宰场鸡粪样品中分离率为74.29%和66.38%。本次试验对胶东半岛地区市场、蛋鸡养殖场和肉鸡屠宰场的鸡源空肠弯曲杆菌进行分离鉴定,平均分离率为45%。
目前对于空肠弯曲杆菌的致病机理不是十分明确,但许多研究已经证实毒力因子与细菌的毒力及致病能力相关。本试验中选择了目前国内外研究较多的14 种毒力相关基因,对胶东半岛地区107 株空肠弯曲杆菌分离株毒力相关基因的存在情况进行了调查分析。

图2 空肠弯曲杆菌毒力基因PCR 检测图
鞭毛在空肠弯曲杆菌致病过程中起到提供动力和粘附作用,鞭毛蛋白基因flaA是重要的毒力因子,粘附蛋白PEB1 是主要的粘附因子。本试验中flaA和peb1A的检出率分别为100%和99.07%,与国内外研究报道一致。pldA基因编码一种外膜磷脂酶A,在病菌入侵细胞时起作用,磷脂酶还和溶血活性有关[7]。侵入抗原蛋白基因ciaB是空肠弯曲菌最大限度入侵组织细胞所必需侵入抗原蛋白,racR基因是racRracS系统的一员,编码调节蛋白在弯曲杆菌定植禽类肠道时起作用,cadF 基因编码外膜蛋白与纤连蛋白结合,介导空肠弯曲杆菌与宿主肠上皮细胞。本试验中pldA,ciaB,racR,cadF 的检出率分别为100%,96.26%,97.20%和99.07%。细胞致死性膨胀毒素(CDT)基因cdtA,cdtB,cdtC的检出率分别76.64%,100%和100%,在Hamidian[8]和张茂俊[9]等的研究中这3 种基因的检出率都接近100%,而本结果cdtA的检出率较低,原因需要进一步研究。趋化因子cheW,cheY 的检出率为99.07%,98.13%,高检出率说明趋化作用在空肠弯曲杆菌的致病过程中起到非常重要的作用。热休克蛋白dnaK和grpE的检出率为100%和71.96%。neuB1 基因决定了空肠弯曲杆菌LOS中唾液酸的合成与表达,本试验中neuB1 检出率为4.67%。
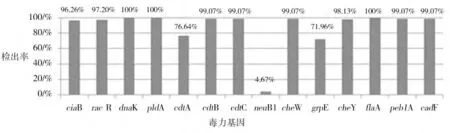
图3 107株空肠弯曲杆菌毒力基因检测结果
胶东半岛地区鸡源空肠弯曲杆菌毒力基因携带率较高,所分离到的菌株所携带的毒力基因数都超过10 种。感染宿主没有临床表现,可能本菌致病性与多种因素有关。菌株毒力基因高携带率说明具有潜在致病力,如果人们接触到被污染的没有加工成熟的食品,很容易造成感染,应加强各生产环节的安全控制,保证食品安全。国内对空肠弯曲杆菌毒力因子的研究报道还比较少,要加强空肠弯曲杆菌及其毒力基因的检测,这对空肠弯曲杆菌病的防控具有重要意义。
[1]Griekspoor P,Colles F M,McCarthy N D,et al.Marked host specificity and lack of phylogeographic population structure of Campylobacter jejuni in wild birds[J].Molecular ecology,2013.22:1463-1472.
[2]Van de Giessen AW,Tilburg J,Ritmeester WS,et al.Reduction of Campylobacter infections in broiler flocks by application of hygiene measures[J].Epidemiology and infection,1998,121(01):57-66.
[3]Bang DD,Nielsen E M,Scheutz F,et al.PCR detection of seven virulence and toxin genes of Campylobacter jejuni and Campylobacter coli isolates from Danish pigs and cattle and cytolethal distending toxin production of the isolates[J].Journal of applied microbiology,2003,94(6):1003-1014.
[4]薛峰,徐飞,张小荣,等.空肠弯曲菌PCR-RAPD分子亚分型及其毒力相关基因分析[J].农业生物技术学报,2010,18(3):586-591.
[5]娜仁高娃,陈霞,吴聪明.鸡源空肠弯曲菌和结肠弯曲菌的临床分离及多重PCR 鉴定[J].中国兽医杂志,2010,46(1):38-39.
[6]陈荀,刘书亮,吴聪明,等.鸡肉生产链中空肠弯曲杆菌的污染分析及PFGE 分型研究[J].中国人兽共患病学报ISTIC,2012,28(10):1012-1016.
[7]Xuan Thanh Bui,Klaus Qvortrup,Anders Wolff,et al.Effect of environmental stress factors on the uptake and survival of Campylobacter jejuni in Acanthamoeba castellanii[J].BMCMicrobiology,2012,12:232.
[8]Hamidian M,Sanaei M,Bolfion M,et al.Prevalence of putative virulence markers in Campylobacter jejuni and Campylobacter coli isolated from hospitalized children,rawchicken,and rawbeef in Tehran,Iran[J].Canadian journal of microbiology,2011,57(2):143-148.
[9]张茂俊,顾一心,冉陆,等.空肠弯曲菌多重聚合酶链反应基因鉴定及其毒力相关基因分析[J].中华流行病学杂志,2007,28(4):377-380.

