凡纳滨对虾Hox基因及其在早期发育中表达模式的研究❋
孙晓晴,隗健凯,袁剑波,张晓军❋❋,李富花,相建海(. 中国科学院海洋研究所实验海洋生物学重点实验室, 山东 青岛 26607;2. 中国科学院大学, 北京 00049)
凡纳滨对虾Hox基因及其在早期发育中表达模式的研究❋
孙晓晴1,2,隗健凯1,2,袁剑波1,张晓军1❋❋,李富花1,相建海1
(1. 中国科学院海洋研究所实验海洋生物学重点实验室, 山东 青岛 266071;2. 中国科学院大学, 北京 100049)
Hox基因是决定动物形态多样性的关键基因,同一类型Hox基因的同源异型结构域(Homeodomain)序列及其功能在进化上高度保守。甲壳动物是仅次于昆虫的第二大类节肢动物,但有关其Hox基因研究在深度和广度上都远远不如昆虫。本研究首先通过RNA-Seq测序技术和生物信息学方法分析发现在凡纳滨对虾(Litopenaeusvannamei)中存在13种Hox基因,分别为Lvlab、Lvpb、Lvhox3、Lvdfd、Lvscr、Lvftz、Lvantp、Lvubx、LvabdA、LvabdB、Lvmsx、Lvmnx和Lvdll;然后根据RNA-Seq数据,克隆获得了这13条基因的开放阅读框(ORF)的cDNA序列,并对其序列结构、早期发育表达模式及同源关系进行了初步分析。序列分析显示这些Hox基因的结构非常保守,同源比对显示同一类型的Hox基因的氨基酸序列在不同物种之间具有较高的保守性;表达模式分析结果发现,不同Hox基因在早期发育过程中的表达模式不同,从囊胚期开始,按时序表达的先后顺序基本为Lvmsx、Lvlab、Lvpb、Lvhox3、Lvdfd、Lvscr、Lvftz、Lvmnx、Lvdll、Lvantp、Lvubx、LvabdA、LvabdB。根据各Hox基因表达时期对应的对虾胚胎和幼体发育情况,初步推测了这些基因在凡纳滨对虾的发育过程中可能的功能。
Hox基因;凡纳滨对虾;甲壳动物;早期发育;表达模式
Hox基因是后生动物中普遍存在的一类含有同源框(Homeobox)的基因,它们都具有一段约180 bp的可转录出约60个氨基酸的同源异型结构域(Homeodomain)保守蛋白的序列。这类基因在基因组上成簇存在,同一类型Hox基因在进化上高度保守。Hox基因调控生物体轴形成,参与动物早期胚胎发育,它编码的Homeodomain蛋白是一种转录调控因子,通过与靶基因序列特异结合而实现对生物发育的调控[1-2]。1984年,Hox基因在果蝇(Drosophilamelanogaster)中首次被发现[3-4],逐渐成为人们研究生物体形态进化的焦点。Hox基因若发生突变,则会产生同源异型表型,即同源异型突变。例如果蝇的BX-C基因簇中的Ubx发生突变后,第三胸节可变为与第2胸节类似的结构,原有的平衡棒被一对小翅所代替,这就是著名的果蝇双胸突变体[5]。因此,通过调控Hox基因的转录表达,可以达到控制生物形态发育的目的,这对研究生物体的形态发育和进化有重要意义。
根据大量节肢动物的Hox基因序列以及表达模式的研究报道,现在普遍认为节肢动物一套完整的Hox基因簇(Hoxgene clusters)可能由laial(lab)、proboscipedia(pb)、Hox3/zen、Deformed(Dfd)、Sexcombsreduced(Scr)、fushitarazu(ftz)、Antennapedia(Antp)、Ultrabithorax(Ubx)、abdominal-A(abdA) 和Abdominal-B(abdB) 10个基因所组成[6-8]。几乎所有的节肢动物都具有这一套Hox基因簇,这些基因之间通过复杂的相互作用造就了节肢动物的形态多样性。目前,在节肢动物中,有关Hox基因的研究大量集中于昆虫,特别是果蝇的Hox基因结构和功能研究已经非常深入,各Hox基因的功能和表达调控已经基本清楚。然而在甲壳动物中,Hox基因的研究还很缺乏。虽然甲壳动物与昆虫同属节肢动物门,但是它们的形态特征、遗传发育及生活习性有着非常大的差异,因此尽管它们共用一套同源的Hox基因来调控形态发育,但是Hox基因间的调控表达方式却很可能大不相同,从而在不同的体节产生不同功能的附肢来适应不同的生活环境。在甲壳动物的代表种类-对虾中,目前尚无有关Hox基因的报道。
对虾的发育过程与果蝇等昆虫及其他节肢动物有很大的不同,属于增节变态发育。在无节幼体阶段身体是不分节的,但已开始头胸发育并产生3对附肢;从无节幼体后期开始腹部出现分节;至溞状幼体和糠虾幼体,初期的3对附肢逐渐演变成口器、触角等器官,体节增多,身体变长并伴随着附肢的增长和功能分化(例如胸部附肢称为步足,行使行走功能;腹部附肢称为游泳足,行使游动功能),同时在发育过程中一直伴随着蜕皮现象[9]。对虾类的体节发育方式复杂,相关研究很少。本研究选择凡纳滨对虾(L.vannamei)为实验材料,通过用生物信息学方法对其转录组数据进行分析筛选,对相关Hox基因的开放阅读框的cDNA序列进行分析和克隆验证,同时与果蝇的Hox基因进行比对分析,并初步分析这些基因在对虾早期发育中的表达模式,以便尝试了解Hox基因在对虾类发育过程中的作用。这些研究将丰富甲壳动物Hox基因研究,为对虾形态发育和进化研究奠定基础。
1 材料和方法
1.1Hox基因序列的获得和生物信息学分析
在前期研究中,本课题组开展了凡纳滨对虾不同发育时期(胚胎、无节幼体、溞状幼体、糠虾幼体和仔虾)的RNA-Seq测序,共得到约26 Gb转录组数据,经组装得到66 815条单基因簇(Unigenes)[10]。从Fruitfly Base(http://flybase.org/)中下载了果蝇的2个Hox基因簇ANT-C和BX-C共8个Hox基因(lab、pb、Dfd、Scr、Antp、Ubx、abdA和abdB)的cDNA全长序列,将这些序列与凡纳滨对虾的转录组数据(SRR1039534)进行比对,得到同源序列数据。同时对转录组组装得到的Unigenes或Transcripts(转录本)进行筛选,收集注释为Hox基因的序列。将2方面得到的数据合并后进行分类和筛选,然后将得到的序列在NCBI去冗余蛋白质数据库(Nr)中进行BlastX比对检索,对候选Hox基因序列进行精确分类,找出各自编码区和编码同源异型结构域区,并进行序列间的比对以及与果蝇各Hox基因的比对分析。
1.2 PCR克隆验证
由于不同的Hox基因表达的时期不一样,根据RNA-seq结果,选择凡纳滨对虾多个Hox基因集中表达的无节幼体、溞状幼体和糠虾幼体3个发育时期的样品,按照北京全式金生物技术公司的TransZol Up方法提取3个样品的总RNA。以3种总RNA为模板,进行反转录,合成cDNA。
对筛选得到的各Hox基因序列,用primer 5.0软件设计系列引物,引物由上海生工生物技术有限公司合成。对于一个基因有多个Transcripts的情况,选取序列最长或包含同源异型结构域区最完整的一条转录本设计引物。
以制备的凡纳滨对虾的3种cDNA为模板,进行PCR扩增,获取不同的Hox基因cDNA片段。PCR反应体系为25μL:2×PCR Mix 12.5μL,模板cDNA 1μL,4μmol/L正向引物1μL,4μmol/L反向引物1μL,DNA Taq polymerase 0.25μL,ddH2O 9.25μL。PCR反应程序为:95℃变性5min;95℃变性30s,退火(温度因引物而异)30s,72℃延伸45s,40个循环;72℃延伸10min。
PCR产物经1%琼脂糖凝胶电泳检测,然后将产物片段纯化克隆并送到上海桑尼生物科技公司测序,得到的序列与转录组序列进行比对验证。
1.3Hox基因在早期发育中表达模式
根据本课题组的凡纳滨对虾20个不同早期发育时期的表达谱RNA-Seq测序数据[10],对经筛选鉴定的Hox基因序列在不同的早期发育时期的数据中进行检索,获得不同时期各Hox基因的表达量信息,并绘制热图进行聚类分析。根据各基因的表达量变化,结合对应的对虾胚胎和幼体发育时期的特征,分析各Hox基因在凡纳滨对虾早期发育中的表达模式及可能具有的功能。
2 结果与讨论
2.1Hox基因序列
在凡纳滨对虾转录组中,共筛选得到27条Unigenes或Transcripts与Hox基因相关(见表1)。经过BlastX比对进一步分类和分析,这27条Unigenes或Transcripts序列归结到13条Hox基因,分别是Lvlab、Lvpb、Lvhox3、Lvdfd、Lvscr、Lvftz、Lvantp、Lvubx、LvabdALvabdB、Lvmsx、Lvmnx和Lvdll。其中Lvlab、Lvpb、Lvdfd、Lvscr、Lvftz、Lvantp、Lvubx、LvabdA、LvabdB、Lvmsx和Lvdll拥有完整的ORF,BlastX比对覆盖了整个Homoedomain区域;其余的Hox基因序列都只包含部分ORF,经BlastX比对后发现,这些部分编码区覆盖不同Hox基因的全部或部分Homoedomain区域。
对13条Hox基因序列设计引物,PCR扩增得到目的片段,产物经克隆测序验证,各序列与转录组数据中的原始序列保持一致(所有13条序列均已上传至NCBI,可能存在多个转录本的基因,选择包含生物信息最多的一条上传)(见表1)。
2.2Hox基因序列分析
将凡纳滨对虾的13条Hox基因的蛋白序列进行比对和结构分析,发现Hox基因编码的蛋白结构主要由一个含YPWM的Motif(基序)(或者类似的4个氨基酸Motif)和一个高度保守的Homeodomain组成,并且不同类型的Hox基因序列的Homeodomain区域具有一定的相似性(见图1)。这说明不同类型的Hox基因可能来源于同一祖先,经过漫长的进化,逐渐在某些关键的氨基酸部位发生突变从而获得新的功能变成新的基因。很多Hox基因的作用因子通过与YPWM motif的结合来发挥调控作用。有研究认为,Hox3和ftz的Hox功能逐渐缺失与YPWM基序的丢失和突变有关[6],凡纳滨对虾的Hox基因大多含有这个基序或者类似的4个氨基酸序列,这可能与不同Hox基因发挥不同的功能作用密切相关,其中Lvhox3和Lvftz这2个基因缺失这种基序或者序列已经发生了很大的变化,其Hox功能是否同样缺失或改变将在下文讨论。
在NCBI中下载与这13条凡纳滨对虾Hox基因序列同源的果蝇Hox基因序列。经过比对,发现虽然凡纳滨对虾与果蝇在进化上的亲缘关系甚远,但是Hox基因的序列及结构保守程度非常高。其中2个物种的Hox3和ftz的序列相似度较低,尤其是凡纳滨对虾的Hox3与果蝇的由Hox3衍生的3个基因zen、zen2和bicoid相比,氨基酸序列的相似度逐步降低。在果蝇中,Hox3衍生的3个基因序列的YPWM Motif已经丢失,并且Homeodomain序列的改变很大,而ftz虽然Homeodomain序列仍旧很保守但已经丢失了YPWM序列,可见导致这2个基因完全丢失Hox基因调控体节发育功能的原因可能是由上文提到的YPWM Motif丢失引起[6]。
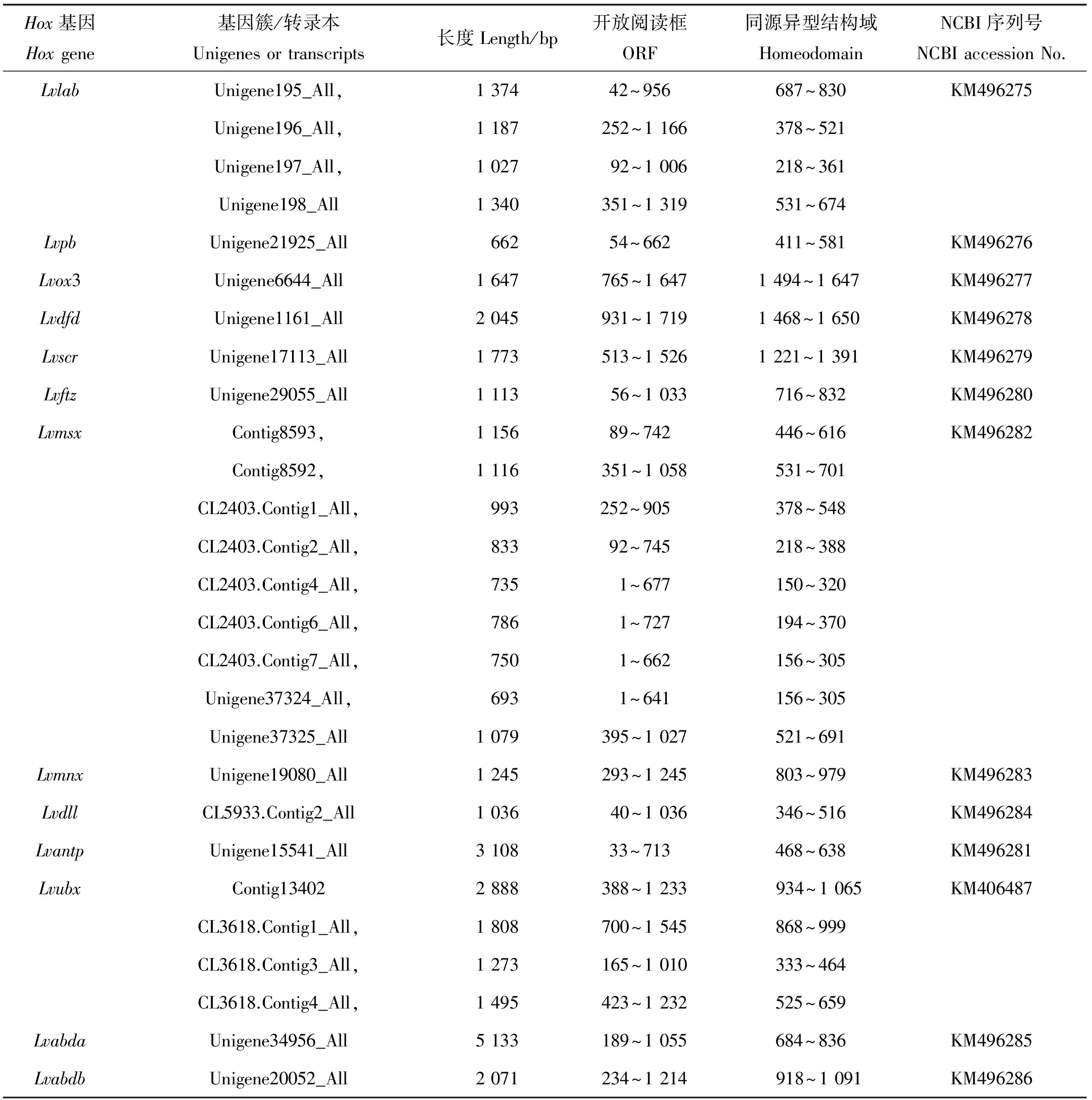
表1 凡纳滨对虾Hox基因信息

图1 凡纳滨对虾13条Hox基因的蛋白序列的同源性比对Fig.1 The similarity analysis of 13 Hox protein sequence of L. vannamei

(D.m:黑腹果蝇;L.v:凡纳滨对虾。D.m: D.melanogaster; L.v: L.vannamei)图2 凡纳滨对虾13条Hox基因的蛋白序列与果蝇的同源性比对Fig.2 Compare the homology of Hox protein sequences in D.melanogaster and L.vannamei
2.3Hox基因在凡纳滨对虾幼体不同时期中的表达
根据凡纳滨对虾幼体不同发育时期的表达谱RNA-Seq数据,将注释为Hox基因的Unigenes或Transcripts进行聚类分析,相似表达形式的Unigenes或Transcripts聚类到一个模块中。见图3,从这个热图可以看出不同的Unigenes或Transcripts在不同时期的表达水平各不相同,但总体看来,Lvlab、Lvpb、Lvhox3、Lvdfd、Lvftz、Lvmsx、Lvdll和Lvmnx主要在无节幼体及之前的时期表达活跃,Lvscr、Lvantp、Lvubx、LvabdA和LvadB则在溞状幼体及之后的时期活跃表达。
2.4 对凡纳滨对虾Hox基因功能的推测
由于Hox基因是一类高度保守的基因,因此可以通过同一类型的Hox基因在其他节肢动物种类中的作用和该基因在凡纳滨对虾发育过程中高表达时期对应的发育特征推测Hox基因在凡纳滨对虾的发育过程中的功能。
从图3中可以看出,凡纳滨对虾在受精卵处于囊胚以前的时期,所有的Hox基因基本都没有表达或者非常低量表达;从囊胚期开始随着细胞分化而开始陆续表达Hox基因。

(左面:聚类结果;右面:Hox基因的表达谱数据;上面:不同的发育时期,由左到右依次是:zygo(受精卵),C2(2细胞期),C4(4细胞期),C32(32细胞期),blas(囊胚期),gast(原肠胚期),Lbe1(肢芽早期),Lbe2(肢芽晚期),Lim1(膜内无节幼体早期),Lim2(膜内无节幼体晚期),N1(无节幼体1期),N3(无节幼体3期),N6(无节幼体6期),Z1(溞状幼体1期),Z2(溞状幼体2期),Z3(溞状幼体3期),M1(糠虾幼体1期),M2(糠虾幼体2期),M3(糠虾幼体3期),P1(仔虾1期)。Left: The result of cluster analysis; Right: Expression level ofHoxgenes; Up: Different developmental stage ofL.vannamei, from the left to right: zygote, 2 cells, 4 cells, 32cells, blastula, gastrulae, limb bud 1, limb bud 2, nauplius in membrane 1, nauplius in membrane 2, Nauplius 1, Nauplius 3, Nauplius 6, Zoeae 1, Zoeae 2, Zoeae 3, Mysis 1, Mysis 2, Mysis 3,Post-larva 1.)
图3 凡纳滨对虾Hox基因在不同发育时期的表达谱
Fig.3 TheHoxgenes expression profiling ofL.vannameiin different developmental stages
从肢芽早期到膜内无节幼体晚期,凡纳滨对虾先后出现3对附肢:第一触角、第二触角和大颚,并且在胚体前端的腹面中央出现红褐色的单眼[9]。在这期间,Lvlab、Lvhox3、Lvmsx、Lvdfd、Lvftz、Lvmnx和Lvdll7个基因先后开始表达,表达量先升高再降低。Lvlab、Lvdfd和Lvmsx3个基因的表达趋势一致,而Lvhox3的表达则表现为与其相反的趋势。Lvftz与Lvdfd同时在膜内无节幼体开始表达,但表达量上调和下调的变化很大。Lvmnx和Lvdll开始表达的时期较晚,且表达量一直不高,但表达时期延伸到了后面的溞状幼体1期(见图4a~f)。因此,推测Lvlab、Lvmsx、Lvhox3、Lvdfd和Lvftz可能参与调控凡纳滨对虾触角、大颚和单眼的发育,Lvdll和Lvmnx可能与3对附肢的后期发育有关,并且参与无节幼体期附肢的细节特征和功能分化。对虾无节幼体期分为6个时期,主要特征是躯体增大,3对附肢相应增长增大,细节特征增多,到无节幼体期6期,出现头胸甲、2对小颚和2对颚足,腹部出现多对附肢原基,口器和消化器官逐渐形成[9]。Hox基因的表达表现为孵化前期高表达的基因如Lvlab、Lvmsx、Lvhox3和Lvftz等开始低量表达或者不表达,而另外一些Hox基因,如Lvpb、Lvscr、Lvantp开始上调表达,推测Lvpb、Lvscr、Lvantp可能主要参与口器和消化器官的发育形成,并且Lvdll和Lvmnx可能也起到重要的调控作用。
至溞状幼体时期具完整的口器和消化器官,身体开始分节并且在胸节长出附肢[9]。从Hox基因的表达上可以看出,Ubx、LvabdA、LvabdB开始表达。
凡纳滨对虾在糠虾幼体至仔虾时期已具有全部的体节和附肢,且各附肢的细节特征逐步得到完善。这段时期主要表达LabdA、LvabdB3个基因(见图4g~p)。这3个基因之间LvabdA和Lvubx的表达趋势一致并且同LvabdB的表达趋势相反,呈此消彼长的变化规律,推测这3个基因之间相互作用共同调节和完善凡纳滨对虾胸腹节及其附肢的发育。
2.4.1Lvlab在节肢动物Hox基因的研究中,lab总是最先表达的一个基因[6-7]。在果蝇幼体期,lab与触角、视叶原基、中肠和部分由脑发出的神经发育密切相关;成体时表达则仅限于眼部、触角及其他头部区域的发育[11]。在甲壳动物球鼠妇(Porcelliolaevis)中,lab仅在第二对触角表达,调控触角发育[12]。Lvlab主要在凡纳滨对虾肢芽早期开始大量表达,在膜内无节幼体晚期迅速下降,以后表达量一直很低。推测Lvlab在凡纳滨对虾发育过程中的作用至少有一点与其他节肢动物相同,就是与触角的发育密切相关。
2.4.2Lvhox3和lvftzHox3和ftz都是非常古老的Hox基因之一,在生物漫长的进化史中,这2个基因的序列、表达区域以及功能都发生了改变。在蜈蚣和蜘蛛等多足类和螯肢类动物中,这2个基因仍具有Hox基因的功能,参与颚的发育[6];在果蝇等昆虫中,这2个基因经过复杂的进化历史,已经丢失了Hox-like功能,而分别在胚外组织和神经元中获得了不同的新的功能[6]。在甲壳动物中,这2个基因在水溞(Daphniapulex)胚胎发育的不同时期表达位置不同,最终在大颚节或大颚节后部表达,因此研究者认为ftz和Hox3在水溞中仍具有Hox基因功能[13];球鼠妇中Hox3仅在大颚肢芽中心表达[8],藤壶(Sacculinacarcini)中,ftz仅在神经系统表达[14]。在凡纳滨对虾中,Lvhox3在囊胚期迅速大量增加,原肠胚表达量达到最大后迅速下降,在其他时期的表达水平都较低。Lvftz从原肠胚期开始表达,在肢芽期达到最大量表达,无节幼体时期及之后微量表达或不表达。推测,既然这2个基因在凡纳滨对虾胚胎早期、变态发育开始发生前大量表达,就可能仍具有Hox基因调控动物形态发育的功能,至于具体调控胚胎和幼体的哪一部分发育,以及是否具有调其他新功能,还有待深入研究。
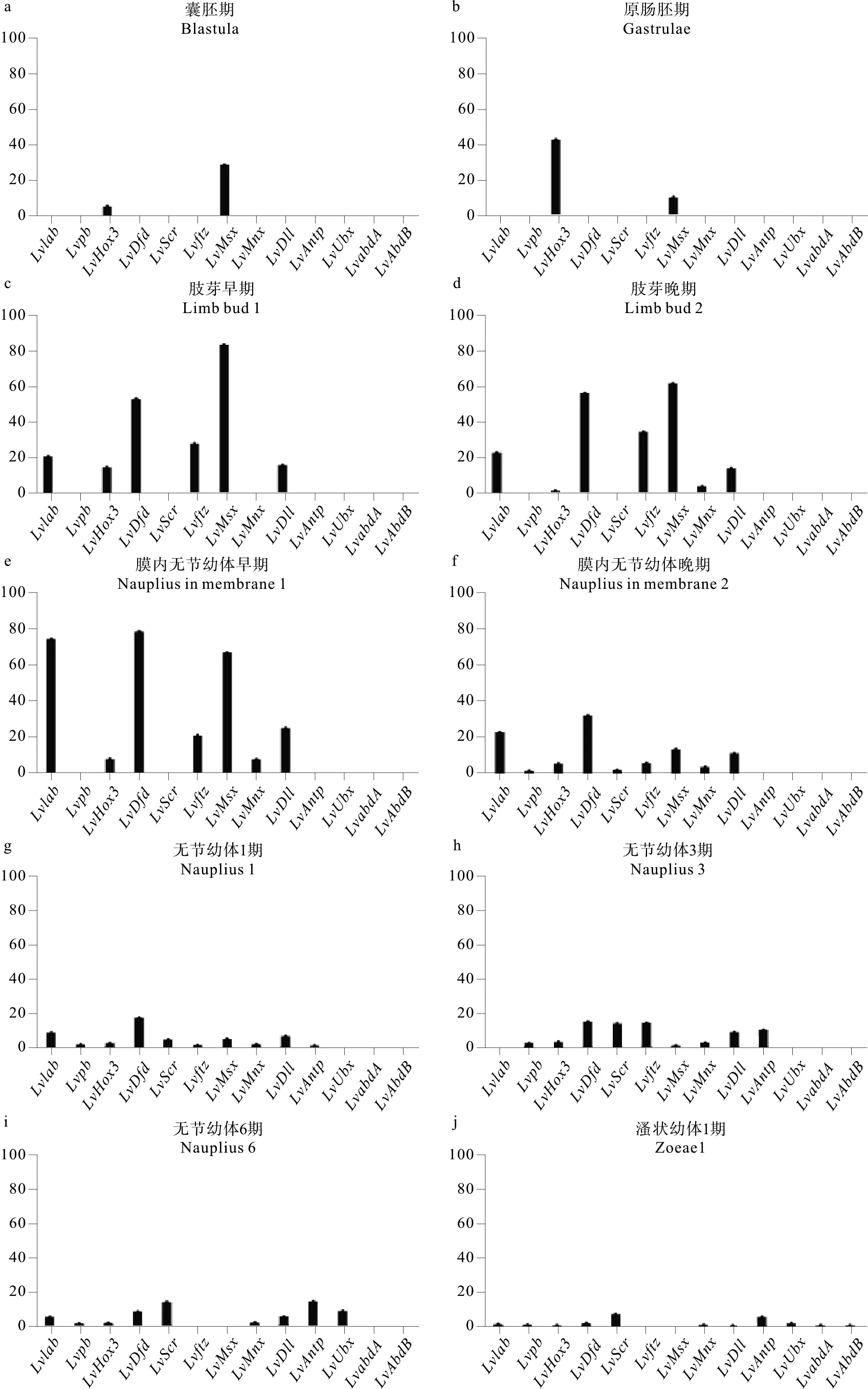
(每图纵坐标代表Hox基因的表达量,横坐标是不同的Hox基因,由左到右依次是:Lvlab、Lvpb、Lvhox3、Lvdfd、Lvscr、Lvftz、Lvmsx、Lvdll、Lvmnx、Lvantp、Lvubx、LvabdA、LvabdB。A~p分别是凡纳滨对虾不同的发育时期各Hox基因的表达情况:a.囊胚期,b.原肠胚期,c.肢芽早期,d. 肢芽晚期,e. 膜内无节幼体早期,f.膜内无节幼体晚期,g. 无节幼体1期,h. 无节幼体3期,i.无节幼体6期,j.溞状幼体1期,k. 溞状幼体2期,l.溞状幼体3期,m.糠虾幼体1期,n.糠虾幼体2期,o.糠虾幼体3期,p.仔虾1期。Ordinate: Expression level ofHoxgenes; Abscissa: 13Hoxgene, from the left to right:Lvlab,Lvpb,Lvhox3,Lvdfd,Lvscr,Lvftz,Lvmsx,lvdll,Lvmnx,Lvantp,Lvubx,LvabdA,LvabdB, a~p showed different development stage ofL.vannamei: a. blastula, b. gastrulae, c. limb bud 1, d. limb bud 2, e. nauplius in membrane 1, f. nauplius in membrane 2, g. Nauplius 1, h. Nauplius 3, i. Nauplius 6, j. Zoea 1, k. Zoea 2, l. Zoea 3, m. Mysis 1, n. Mysis 2, o. Mysis 3, p. Post-larva 1.)
图4 凡纳滨对虾胚胎及幼体发育的时期各Hox基因的表达变化
Fig.4 The dynamic expressions of 13Hoxgenes in difference early development stage ofL.vannamei
2.4.3LvMsxMsx从腔肠动物到哺乳动物均有表达,是一类高度保守的Hox基因。无脊椎动物只有单一的MSH/MSX,对背腹中枢神经系统的形成起着至关重要的作用,该功能在进化上高度保守[15-17]。凡纳滨对虾的Lvmsx从受精卵即出现,至原肠胚时期开始大量表达,几乎覆盖随后的所有发育时期,而高度表达时期主要集中在肢芽期到膜内无节幼体时期,根据前期文献,推测在Lvmsx的功能很多,可能对凡纳滨对虾的神经系统的发育起着至关重要的作用。在凡纳滨对虾中,疑似存在多个Lvmsx转录本,推测不同的转录本作为不同的转录因子或信号分子调控不同部分的神经发育[18]。
2.4.4Lvdfd有研究发现在球鼠妇中,Dfd仅在大颚节和小颚节表达,但是在大颚节中心受到抑制,而这个区域正是Hox3表达位置,因此推测Lvdfd受Hox3的表达抑制[12]。在凡纳滨对虾中,Lvdfd从原肠胚期开始连续表达,在膜内无节幼体早期达到最大后开始迅速下降,之后低量表达。在此期间形成的无节幼体的身体将来主要发育为对虾的头部,因此推测,Lvdfd的功能可能是负责头部大小颚的形成发育。结合Lvhox3的表达趋势及其在鼠妇中的作用,凡纳滨对虾中Lvdfd和lvhox3之间可能也存在着相互抑制的作用,共同调控大颚小颚的发育。
2.4.5LvdllDll在节肢动物中的最主要最普遍的功能是调控附肢的发育[6]。在昆虫中,Dll在腹部的附肢发育时表达受到Ubx/abdA的抑制而使腹部无附肢[19-20];而在多足纲和甲壳纲动物中,Dll在腹部的表达和及其对附肢的调控并不受Ubx或abdA抑制[21]。在果蝇中,Dll第二个功能还与触角的发育密切相关,由于果蝇的触角具有听觉和嗅觉的功能,研究证实,Dll还与嗅觉神经系统发育相关[22-23]。Lvdll在凡纳滨对虾肢芽早期表达迅速上调,膜内无节幼体早期达到最大量表达,之后表达量迅速下降,到溞状幼体时期以后一直微量表达。推测Lvdll主要参与调控凡纳滨对虾早期3对附肢的发育,可能远程调控胸腹部附肢的形成,由于胸部和腹部分别是功能分明的步足和游泳足,因此Lvdll的表达并不受完全Ubx或LvabdA的抑制,更有可能是一起共表达调控胸腹部附肢的发育,决定附肢的种类和功能。
2.4.6LvmnxMnx在人类基因中被称为HB9或HLXB9,对哺乳动物的胰腺发育和运动神经元的分化合并至关重要,突变可导致Currarino综合征[24]。无脊椎动物虽然缺乏胰腺,但是在原始的胚胎内胚层仍有该基因的表达[25]。在果蝇中,Mnx还是运动神经细胞迁移、轴突生长和决定运动神经元亚型种类所必需的调控因子。在凡纳滨对虾中,Lvmnx从肢芽早期开始有微量表达,在整个胚胎及胚后发育时期的表达量一直很低。推测Lvmnx在凡纳滨对虾中的功能有2种可能,一种是促进组织肝胰脏的发育,另一种可能与运动神经的发育分化密切相关。
2.4.7Lvpbpb在是昆虫特化结构唇颚发育的重要调控基因。在果蝇中主要在胚胎和成体的唇节颚节表达,并且分别与Dfd和Scr相互结合作用决定成体果蝇颚须和唇的特化[26];在螯肢类和多足类动物中,Lvpb在从大小颚到步足都有表达[6];而在球鼠妇中仅在第二触角表达[12]。Lvpb在凡纳滨对虾膜内无节幼体早期开始表达,这正是口形成的时期,但Lvpb一直到仔虾所有表达时期的有表达,只是表达量都很低。推测Lvpb可能与对虾口器的发育密切相关,但很可能还有其他的功能。
2.4.8LvscrScr在不同的节肢动物中的表达区域不一样,且功能呈现多样化。在果蝇中,可诱导唾液腺的发育,在家蚕中诱导丝腺和唾液腺的发育,在其他昆虫的一些特化附肢中也具有重要作用[6]。在马利筋长蝽(Oncopeltusfasciatus)中,Scr与pb共同作用决定唇的发育,与Dfd共同作用决定小颚的发育[27]。在甲壳动物中,Scr与Ubx相互作用调控颚肢的发育,两者动态表达产生不同的颚肢[7],如在球鼠妇和克原氏螯虾(Procambarusclarkii)中,Scr在早期胚胎发育的第一对小颚中表达[28-29]。在凡纳滨对虾中,Lvscr主要在无节幼体时期和溞状幼体早期表达,表达趋势与Lvpb的表达一致。由于在果蝇等昆虫中Scr对pb具有活化的正调控作用,推测Lvscr可能与Lvpb共同作用协调表达调控对虾口器颚的发育。
2.4.9LvantpLvantp已在3种甲壳动物中研究报道:在卤虫(Artemiafranciscan)中,Lvantp表达区域从第一对小颚节后部开始延伸到全部胸节[29];在球鼠妇中则从第二对小颚节开始延伸到整个胸部[30];在克原氏螯虾中,Antp的表达在腹部的表达较弱,在第二对小颚节附肢和3对螯肢中最强[28]。因此,Antp主要参与决定甲壳动物小颚和胸部附肢的发育。在凡纳滨对虾中,Antp在无节幼体时期表达量开始快速增加,至溞状幼体时期开始下降并趋于稳定低量表达。凡纳滨对虾自无节幼体时期末期开始出现多对附肢和头胸甲,在溞状幼体时期开始分节并且胸节长出附肢。由此推测lvantp主要参与调控凡纳滨对虾小颚、胸节及其附肢的发育。
2.4.10Lvubx在果蝇中,Ubx决定后部胸节和腹节发育,Ubx还通过抑制Dll的表达抑制腹部附肢的发育[19-20]。在卤虫中,Ubx/abdA的表达与胸腹部附肢的形态发育关系密切,Ubx/abdA在不同物种间的动态表达,诱导决定了各对附肢的功能,例如捕食、游泳、爬行或战斗[31]。在凡纳滨对虾中,Lvubx从无节幼体时期开始一直到糠虾幼体和仔虾时期都有表达,这段时间主要发生增节变态发育,出现胸节和腹节及附肢并且各附肢的分工明确。因此,推测Lvubx在凡纳滨对虾中的功能作用主要是与LvabdA和LvabdB共同作用在胸腹部决定体节和附肢的形态发育。
2.4.11LvabdAabdA在节肢动物中的主要功能作用是调节腹部附肢的发育。abdA在已研究的3种甲壳动物表达各异:在卤虫中,自第二胸节的神经节开始表达,覆盖整个胸部,与Ubx的表达区域重叠[29];在球鼠妇中,abdA在腹部表达跟Ubx表达区域无重叠[30];在克原氏螯虾胚胎发育后期,abdA与Ubx表达位置大多无重叠[28],因此导致这3种甲壳动物的胸腹部附肢形态各异。凡纳滨对虾的lvabdA在无节幼体时期开始连续表达,呈上调趋势,在糠虾幼体时期开始稳定表达,但表达量不高。表达趋势同Lvubx的表达呈现一致,推测LvabdA与Lvubx基因相互作用共同调控对虾胸部和腹部体节及附肢的发育。
2.4.12LvabdB在昆虫发育的过程中,AbdB不论在基因簇上的位置还是表达时间先后顺序都是最后一个,决定昆虫腹部后部体节和生殖腺的发育[7]。而在卤虫中AbdB基因只在位于胸节后部腹节前部之间的生殖节中表达,AbdB对生殖器官的发育具有重要的调控作用且该功能非常保守[29]。凡纳滨对虾LvabdB基因从无节幼体时期开始连续上调表达,但是表达量都很低,与Lvubx/LvabdA呈现一种此消彼长的表达趋势。推测,AbdB在凡纳滨对虾发育早期主要是与Lvubx和LvabdA共同参与调控体节和附肢形成,调控生殖器官发育的功能可能在仔虾后期发挥作用。
本研究中发现Lvlab、lvmsx和lvubx拥有多个转录本,这些转录本开始表达的时期、表达量及表达上调下调的趋势各不相同(见图5)。不同的转录本作为转录调控因子可能调控不同的靶基因或对同一靶基因的调控方式不同,从而引起不同的效应,例如造成体节特异的特征等[18]。由于目前缺乏对虾全基因组参考序列,目前还不能确定这些转录本是来自于可变剪切还是基因家族,随着研究的深入和对虾基因组序列数据的完善,这些转录本的来源和功能可以获得更深入的阐释。

图5 凡纳滨对虾多转录本的Hox基因在不同发育时期的表达Fig.5 The expressions of Hox genes with more than one transcripts in difference early development stage of L. vannamei
2.5 凡纳滨对虾Hox基因的同源关系分析
现在普遍认为所有的Hox基因拥有共同的祖先,经历多次基因复制或基因组加倍事件后逐渐产生具有不同功能的Hox基因。将13条Hox基因的Homeodomain序列进行比对和聚类分析,发现在凡纳滨对虾中,按照节肢动物Hox基因排列顺序相邻的2个Hox基因首先聚为一类,其次再和相隔基因聚在一起,如Lvpb和Lvhox3聚类后再与Lvlab聚类,Lvubx和LvabdA聚类后与Lvftz和Lvantp聚类然后再与Lvscr聚类(见图6)。这也在一定程度上支持了Hox基因拥有同一祖先的假设。聚类和同源性分析研究也发现存在于凡纳滨对虾中的3个Hox基因Lvmsx、Lvmnx和Lvdll与其他Hox基因的关系较远,自成一支,这3个基因或许都属于比较古老的Hox基因。

图6 凡纳滨对虾Hox基因的同源关系Fig.6 The homology of Hox homoedomain sequence of L. vannamei
3 结语
作为生物发育过程中至关重要的一类基因,Hox基因在漫长的进化中,各自的序列和功能既保守又动态变化,它们彼此之间相互作用,在时空顺序上组成了一个复杂的调控网络,共同决定生物体的组织发育和形态特征等。在凡纳滨对虾中首次发现了13种Hox基因,序列结构分析和同源比对结果显示这些Hox基因的Homeobox序列和Homeodomain都很保守,不仅是同一类型Hox基因与远缘物种-果蝇间保守,并且凡纳滨对虾的不同类型的Hox基因之间也具有一定的同源性,支持Hox来源域同一祖先的说法。通过对这些Hox基因在对虾早期发育不同时期的表达模式的分析,认为这些Hox基因全部参与了凡纳滨对虾的早期发育,且按一定的时空顺序先后开始表达。推测Lvlab、Lvmsx、Lvhox3、Lvdfd和Lvftz可能参与调控凡纳滨对虾触角、大颚的发育,Lvhox3和Lvftz2个基因可能仍具有Hox基因的功能。Lvdll和Lvmnx可能与3对附肢的后期发育有关,并且与Lvpb、Lvscr、Lvantp共同参与口器和消化器官的发育形成。同时发现这些Hox基因之间可能存在相互抑制共同作用的情况,如Lvubx、LvabdA和LvabdB3个基因之间相互作用共同调节和完善凡纳滨对虾胸腹节及其附肢的发育。根据不同时期凡纳滨对虾的生长发育情况,推测了Hox基因在这些时期可能行使的功能,这些结果为今后的对虾体节发育和Hox基因的功能验证研究提供了参考,为深入研究甲壳动物的进化及解释其形态多样性提供了更多的信息。
[1] Banerjee B S, Ferlanti E S, Ryan J F, et al. The Homeodomain Resource: sequences, structures and genomic information[J]. Nucleic Acids Res, 1999, 27(1): 336-337.
[2] Banerjee B S, Moreland T, Hsu B J, et al. The Homeodomain Resource: 2003 update[J]. Nucleic Acids Res, 2003, 31(1): 304-306.
[3] McGinnis W, Levine MS, Hafen E, et al. A conserved DNA sequence in homoeotic genes of theDrosophilaAntennapediaand bithorax complexes[J]. Nature, 1984, 308(5958): 428-433.
[4] Scott M P, Weiner A J. Structural relationships among genes that control development: sequence homology between theAntennapedia,Ultrabithorax, andfushitarazuloci ofDrosophila[J]. Proc Natl Acad Sci USA, b, 1984, 81(13): 4115-4119.
[5] Lewis E B. A gene complex controlling segmentation inDrosophila[J]. Nature, 1978, 276(5688): 565-570.
[6] Hughes C L, Kaufman T C.Hoxgenes and the evolution of the arthropod body plan[J]. Evolution & Development, 2002, 4(6): 459-499.
[7] Hou L.Hoxgenes and study ofHoxgenes in crustacean[J]. Chinese Journal of Oceanology and Limnology,2004,4(22): 392-398.
[8] Michalis A, Anastasios P Zacharias K, et al. Evolution of new appendage types by gradual changes inHoxgene expression-the case of crustacean maxillipeds[J]. Palaeodiversity, 2010, 3: 141-155.
[9] 赵法箴. 海洋水产研究资料, 对虾幼体发育形态[M]. 北京: 农业出版社, 1965.
[10] Wei J, Zhang X, Yu Y, et al. Comparative transcriptomic characterization of the early development in Pacific white shrimpLitopenaeusvannamei[J]. PLoS ONE, 2014, 9(9): e106201.
[11] Merrill V K, Diederich R J, Turner F R, et al. A genetic and developmental analysis of mutations inlabial, a gene necessary for proper head formation inDrosophilamelanogaster[J]. Dev Biol, 1989, 135: 376-391.
[12] Abzhanov A, Kaufman T C. Homeotic genes and the arthropod head: expression patterns of thelabial,proboscipedia, andDeformedgenes in crustaceans and insects[J]. Proc Natl Acad Sci USA, a, 1999, 96: 10224-10229.
[13] Papillon D, Telford M J. Evolution ofHox3 andftzin arthropods: insights from the crustaceanDaphniapulex[J]. Dev Genes Evol, 2007, 217(4): 315-322.
[14] Mouchel V E, Blin M Rigolot C, et al. Expression of a homologue of thefushitarazu(ftz) gene in a cirripede crustacean[J]. Evol Dev, 2002, 4: 76-85.
[15] Davidson D. The function and evolution ofMsxgenes pointers and paradoxes[J]. Trends Genet, 1995, 11(10): 405-411.
[16] Cornell R A, Ohlen T V.Vnd/nkx,ind/gsh, andmsh/msx: conserved regulators of dorsoventral neural patterning?[J]. Curr Opin Neurobiol, 2000, 10(1): 63-71.
[17] Ramos C, Robert B.Msh/Msxgene family in neural development[J]. Trends Genet, 2005, 21(11): 624-632.
[18] 田晓轩, 谢强, 卜文俊. 乳草长蝽Ubx基因克隆及多转录本分析[J]. 昆虫学报, 2011, 54(4): 390-396.
[19] Vachon G, Cohen B, Pfeiflec, et al. Homeotic genes of the bithorax complex repress limb development in the abdomen of theDrosophilaembryo through the target geneDistal-Less[J]. Cell, 1992, 71(3): 437-450.
[20] Warren R W, Nagy L, Seleque J. et al. Evolution of homeotic gene regulation and function in flies and butterflies[J]. Nature, 1994, 372: 458-461.
[21] Panganiban G, Sebring A, Nagy L, et al. The development of crustacean limbs and the evolution of arthropods[J]. Science, 1995, 270: 1363-1366.
[22] Panganiban G, Rubenstein J L. Developmental functions of theDistal-less/Dlxhomeobox genes[J]. Development, 2002, 129(19): 4371-4386.
[23] Plavicki J, Mader S, Pueschel E, et al. Homeobox genedistal-lessis required for neuronal differentiation and neurite outgrowth in theDrosophilaolfactory system[J]. Proc Natl Acad Sci USA, 2012, 109(5): 1578-1583.
[24] Hagan D M, Ross A J, Strachan T, et a1. Mutation analysis and embryonic expression of theHLXB9 Currarino syndrome gene[J]. Am J Hum Genet, 2000, 66(5): 1504-1515.
[25] Wendik B, Maier E, Meyer D. Zebrafishmnxgenes in endocrine and exocrine pancreas formation[J]. Dev Biol, 2004, 268(2): 372-383.
[26] Hughes C L, Kaufman T C. RNAi analysis ofDeformed,proboscipediaandSexcombsreducedin the milkweed bugOncopeltusfasciatus: novel roles forHoxgenes in the hemipteran head[J]. Development, 2000, 127: 3683-3694.
[27] Abzhanov A, Kaufman T C. Novel regulation of the homeotic geneScrassociated with a crustacean leg-to-maxilliped appendage transformation[J]. Development, b, 1999, 126: 1121-1128.
[28] Abzhanov A, Kaufman T C. Embryonic expression patterns of theHoxgenes of the crayfishProcambarusclarkii(Crustacea, Decapoda) [J]. Evol Dev, b, 2000, 2: 271-283.
[29] Averof M, Akam M.Hoxgenes and the diversification of insect and crustacean body plans[J]. Nature, 1995, 376: 420-423.
[30] Abzhanov A, Kaufman T C. Crustacean (malacostracan)Hoxgenes and the evolution of the arthropod trunk[J]. Development, a, 2000, 127: 2239-2249.
[31] Averof M, Patel N H. Crustacean appendage evolution associated with changes inHoxgene expression[J]. Nature, 1997, 388: 682-686.
责任编辑 高 蓓
HoxGenes and Their Expression Pattern in Early Development ofLitopenaeusvannamei
SUN Xiao-Qing1,2, WEI Jian-Kai1,2, YUAN Jian-Bo1, ZHANG Xiao-Jun1, LI Fu-Hua1, XIANG Jian-Hai1
(1. The Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
Hoxgenes involve in early embryonic development of animals and regulate the formation of body segments, tissues and organs. They have been widely studied to explain the morphological development and evolution in insects, especially inDrosophila, but rarely in crustaceans, which is the second largest group of arthropods. In this study, by RNA-seq sequencing and bioinformatics analysis, we found 13Hoxgenes in Pacific white shrimp (Litopenaeusvannamei):Lvlab,lvpb,lvhox3,lvdfd,lvscr,lvftz,lvmsx,lvdll,lvmnx,lvantp,lvubx,lvabdAandlvabdB. Molecular clone and sequence analysis showed the 13Hoxgenes are conserved in sequence structure. By analysis the expression pattern of these genes at the early development stages ofL.vannamei, we found that their expression indicated a dynamic change at different development stages and acoording a temporal order based on different function. Our findings suggested that there is a complicated interaction with theHoxgenes together to determine the morphology of the shrimp. This study provided important information for the morphological development and evolution analysis in crustaceans.
Hoxgene;Litopenaeusvannamei; crustacean; early development; expression pattern
国家高技术研究发展计划项目(2012AA092205;2012AA10A404);国家自然科学基金项目(31172396;31272683)资助
2014-09-30;
2014-12-12
孙晓晴(1985-),女,硕士生。E-mail:xiaoqingsun@126.com
❋❋ 通讯作者: E-mail: xjzhang@qdio.ac.cn
Q959.223
A
1672-5174(2015)08-052-11
10.16441/j.cnki.hdxb.20140323

