猪伪狂犬病病毒与猪圆环病毒2型双重PCR检测方法的建立及初步应用
吴学敏,陈如敬,车勇良,王隆柏,陈秋勇,严 山,刘玉涛,周伦江
猪伪狂犬病病毒与猪圆环病毒2型双重PCR检测方法的建立及初步应用
吴学敏1,陈如敬1,车勇良1,王隆柏1,陈秋勇2,严 山1,刘玉涛1,周伦江1
目的 为建立一种能同时鉴别猪伪狂犬病病毒(PRV)和猪圆环病毒2型(PCV2)混合感染的诊断方法。方法与结果 根据GenBank中公布的猪伪狂犬病病毒和圆环病毒2型的基因序列,分别设计一对特异性引物,扩增长度分别为612 bp和238 bp。将PCR产物进行测序,与PRV“Yangsan”株和PCV2“JX0301”株的同源性分别为98.6%和99.2%。通过反应条件的优化,建立同时检测PRV和PCV2的双重PCR方法。利用该方法对临床采集的78份疑似病料进行检测,其中59份为PCV2阳性,17份PRV阳性,其中11份为PRV和PCV2共感染。结论 建立的双重PCR检测方法可以用于PRV和PCV2的临床快速鉴别诊断和流行病学调查。
猪伪狂犬病病毒;猪圆环病毒病2型;双重聚合酶链式反应
猪圆环病毒病是由猪圆环病毒2型(Porcine Circovirus Type2,PCV2)感染引起的病毒性疫病,主要引起断奶猪的多系统衰竭综合征、猪皮炎与肾炎综合征、A2型先天性振颤、猪呼吸道综合征等疾病[1-3],该病毒是目前发现的一种最小的动物病毒,对猪具有免疫抑制特性[3-5]。猪伪狂犬病是由猪感染伪狂犬病病毒(Pseudorabies virus,PRV)引起的一种急性传染病,主要特征是发热和脑脊髓炎,成年猪多为隐性感染,新生仔猪出现神经症状,可引起妊娠母猪流产、死胎、木乃伊胎,尤其以产死胎较为严重[1-2,6-7]。目前,经血清学和病原学调查证实该两种病原已呈世界性分布,并给世界养猪业带来了巨大的经济损失[8-9]。猪PCV2的感染率较高,具有很强的免疫抑制作用,大大降低了猪对其它病原的抵抗力,从而引发多病原的混合感染,爆发疫病[4,10-11];PRV在猪体内多呈隐性感染,并可终生带毒,在一定条件下可激活发病并向外散毒,个体感染后难以根除[12-14]。本试验应用PCR技术建立了同时检测区分猪圆环病毒和猪伪狂犬病病毒野毒的检测方法,为猪伪狂犬病病毒和猪圆环病毒混合感染的早期诊断提供了灵敏、快速、特异的有效方法。
1 材料与方法
1.1 供试毒株 猪伪狂犬病病毒(Pseudo rabies virus,PRV)、猪圆环病毒2型(Porcine circovirus type 2,PCV2)、猪瘟病毒(Classical swine fever virus,CSFV)、猪传染性胃肠炎病毒(Porcine Transmissible gastroenteritis,TGE病毒)、猪细小病毒(Porcine parvovirus,PPV)均由本研究所分离并保存。
1.2 引物设计 根据GenBank公布的猪伪狂犬病病毒gE基因和猪圆环病毒2型cap基因的核苷酸序列,分别设计一对特异引物PRV-F、PRV-R和PCV2-F、PCV2-R,预计扩增产物大小分别为612 bp和238 bp,由宝生物工程(大连)有限公司合成。引物序列如下:
PCV2-F:5′-GGCGTTACACGGAGAGAGAC-3′
PCV2-R:5′-CCTCCTGGGGGAAGAAAGTC-3′
PRV-F:5′-AACTATGGCATGACCGCCAA-3′
PRV-R:5′-GTGGAGAAGAAGAGTCCGGC-3′
1.3 病毒核酸提取 利用Roche(罗氏)公司病毒核酸提取试剂盒,根据说明书步骤,分别提取以PK细胞分离到的PRV和PCV2病毒核酸,采用紫外线吸收法测其浓度,于-70 ℃冰箱存放备用。
1.4 PCR反应条件优化 以提取PRV和PCV2的DNA为模板,根据PCR反应的基本条件,及所设计引物的TM值温度范围,进行优化PCR反应的退火温度。
PCR反应的总体积为25 μL:2×GoTaq Master Green Mix 13.5 μL,上下游引物各0.5 μL,模板2 μL,无菌去离子水补充至终体积为25 μL。反应条件为:94 ℃预变性5 min后进入循环,循环参数为94 ℃ 1 min,退火1 min,72 ℃ 1 min,35个循环后72 ℃延伸10 min。反应结束,取5 μL于1%的琼脂糖凝胶电泳,拍照观察结果。
1.5 特异性测定 以PPV、PRV、PCV2病毒的DNA,及CSFV、TGE病毒RNA反转录成的cDNA为模板。取等量的模板进行PCR扩增,同时以无菌的去离子水做阴性对照,扩增产物经1%的琼脂糖凝胶拍照分析。
1.6 双重PCR反应条件优化 以提取的PRV和PCV2核酸为模板进行PCR扩增,并同时对两种引物进行配比和退火温度的优化,产物经1%琼脂糖凝胶电泳观察。
1.7 敏感性测定 以细胞分离的PRV和PCV2病毒,分别提取DNA,并用紫外分光的方法测定浓度,并做10倍系列稀释成浓度为1 μg/μL至1 pg/μL,分别以不同浓度的模板进行PCR扩增后,扩增产物经1%琼脂糖凝胶电泳观察。
1.8 重复性测定 将提取PRV和PCV2的DNA作为模板,以初步建立的该检测方法,做6次PCR扩增反应,检验该方法的稳定性。
1.9 临床样品的检测 从临床采集到疑是该两种病的病料共78份,经研磨反复冻融处理后,用Roche(罗氏)公司的DNA提取试剂盒分别提取病毒DNA,利用本实验建立的双重PCR方法进行检测,并设立阴阳性对照。
2 结 果
2.1 PCR结果 以提取的PRV和PCV2的DNA为模板,用设计的引物进行PCR扩增,分别得到约612 bp和238 bp大小的条带(如图1、2),与预期的结果一致,而对照样品均无特异性扩增。并将产物送至上海生工公司测序,结果与GenBank公布的PRV“Yangsan”株(登录号:AY249861)和PCV2“JX0301”株(登录号:AY651850)相对应的核苷酸序列进行比较,同源性分别为98.6%和99.2%。
2.2 双重PCR条件优化 退火温度经梯度式优化,及以PRV引物和PCV2引物的不同配比进行PCR反应,用1%琼脂糖凝胶电泳验证,其最佳的退火温度为57 ℃,两对引物的比例为2∶3最佳。
2.3 特异性试验 特异性试验结果如图3所示,该体系对PPV、TGE和CSFV的PCR反应均无扩增条带,仅对PRV和PCV2的核酸有特异性扩增,表明该双重PCR反应体系特异性强。
2.4 敏感性试验 不同浓度模板PCR扩增结果如图4所示,该体系对PRV和PCV2的核苷酸浓度为1 μg/μL-100 pg/μL均能扩增出特异性条带,对10 pg/μL和1 pg/μL无扩增,说明该体系对PRV和PCV2核苷酸的扩增下限浓度为100 pg/μL。

M: DL2000Marker; 1: PRV; 2: PCV2;3: PPV; 4: CSFV; 5: TGE; 6: Negative control (ddH2O).
图1 PCR扩增结果(PRV)
Fig.1 Result of PCR (PRV)
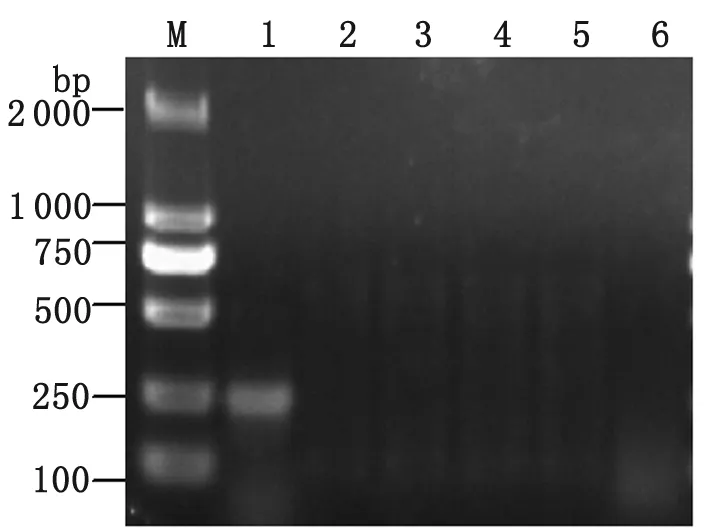
M: DL2000Marker; 1: PCV2; 2: PRV; 3: PPV; 4: CSFV; 5: TGE; 6: Negative control (ddH2O).
图2 PCR扩增结果(PCV-2)
Fig.2 Result of PCR (PCV-2)

M: DL2000 Marker; 1: PRV和PCV2; 2: PPV; 3: TGE; 4: CSFV; 5: Negative control (ddH2O).
图3 特异性试验结果
Fig.3 Specificity result of the detection method

M: DL2000 Marker; 1: 1 μg/μL; 2: 100 ng/μL; 3: 10 ng/μL; 4: 1 ng/μL; 5: 100 pg/μL; 6: 10 pg/μL; 7: 1 pg/mL; 8: Negative control (ddH2O).
图4 双重PCR检测方法的灵敏性
Fig.4 Sensitivity result of the duplex PCR
2.5 重复性试验 以PRV和PCV分离株提取的核酸,用该方法重复做6次PCR反应,均存在两条条带,大小分别为612 bp和238 bp,表明该方法具有良好的重复性。
2.6 临床样品检测 从福建省的不同地区共采集78份猪病料,用建立的双重PCR方法进行检测。结果如表1所示,PRV的阳性率为21.8%(17/78),PCV的阳性率为75.6%(59/78),两者均阳性占14.1%(11/78)。
3 讨 论
随着我国养猪业规模化集约化的发展,及调猪活动的频繁,猪伪狂犬病和猪圆环病毒病逐渐严重危害着猪群的健康[15-16]。目前临床上广泛采用PRV基因工程缺失苗进行免疫保护,也造成有些猪存在PRV潜伏感染的可能,从而导致隐性感染猪长期带毒或向外排毒,而无法使全场净化猪伪狂犬病病毒[13-15]。从2010年年底开始至今,由我国北方地区开始,多个规模化养猪场爆发了疑似PRV感染的疾病,造成了巨大的经济损失,并从发病猪病料中分离到新的毒株[17]。猪圆环病毒是目前发现的最小的动物病毒,PCV2具有免疫抑制特性,能感染猪淋巴器官中的T淋巴细胞和B淋巴细胞,并使该两种细胞的数量减少,而外周血和淋巴组织中的巨噬细胞单核细胞数量升高,同时淋巴组织中的巨噬细胞发生浸润,从而可引起继发性的免疫缺陷疾病[10-11]。在临床上PRV与PCV2感染率较高,还常形成混合感染,很难做出准确的诊断,因此对PRV和PCV2建立一种快速、准确的诊断方法,对疫病的早期诊断及有效防制有着重要的意义。国内外对PRV和PCV2进行了大量的研究,也不断从临床分离到病毒,目前也已经建立了多种检测方法,如间接免疫荧光法(IFA)、免疫组织化学法(IHC)、ELISA抗体检测方法、PCR及多重PCR检测技术等[18]。

表1 PRV和PCV2的检测结果
本研究利用PCR检测方法敏感、快速且易于操作的优点,基于PRV与PCV2病毒均为DNA病毒,根据它们的保守序列各设计一对特异性引物,成功建立了同时检测此两种病毒的双重PCR检测方法。实验结果表明:该方法同时可检测PRV和PCV2病毒,对PPV、CSFV和TGE病毒检测均为阴性。该方法具有特异性强、快速易于操作,对临床采集的病料进行检测,表明临床发病猪感染PCV2的比例要高于PRV感染的,并有14.1%发病猪同时感染两种病毒,应注意该两种疾病的疫苗免疫预防。因此,该双重PCR检测方法为PRV和PCV2的流行病学调查及临床诊断提供一种方法。
[1]Yin Z, Liu JH. Animal virology[M]. Beijing: Science Press,1997.(in Chinese) 殷震,刘景华.动物病毒学[M].北京:科学出版社,1997.
[2]Lu CP. Veterinary microbiology[M]. Beijing: Agriculture Press of China, 2001: 472. (in Chinese) 陆承平.兽医微生物学[M].北京:中国农业出版社,2001:472.
[3]Meehan BM, McNeilly F, McNair I, et al. Isolation and characterization of porcine circovirus 2 from cases of sow abortion and porcine dermatitis and nephropathy syndrome[J]. Arch Virol, 2001, 146(4): 835-842.DOI: 10.1007/s007050170152
[4]Tischer I, Gelderblom H, Vettermann W, et al. A very small porcine virus with circular single-stranded DNA[J]. Nature, 1982, 295(5844): 64-66.
[5]Todd D, Bendinelli M, Biagini P, et al. Circoviridae[R]. In: Fauquet CM, Mayo MA, Maniloff J, et al (Eds.), Virus Taxonomy, VIIIth Report of the International Committee for the Taxonomy of Viruses, 2005, 327-334.
[6]Balasch M, Pujols J, Segales J, et al. Aujeszky’s disease (pseudorabies) virus detection in cerebrospinal fluid in experimentally infected pigs[J]. Vet Microbiol,1998, 2(28): 99-106. DOI: 10.1016/S0378-1135(97)00156-9
[7]Lin HW, Chang YY, Wong ML, et al. Functional analysis of virion host shutoff protein of pseudorabies virus[J]. Virology, 2004, 324: 412-418.DOI: 10.1016/j.virol.2004.04.015
[8]Spillane P, Kennedy S, Meehan B, et al. Porcine circovirus infection in the Republic of Ireland[J]. Vet Record, 1998, 143: 511-512.
[9]Elli S, Hassard L, Clarr E, et al. Isolation of circovirus from lesions of pigs with postweaning multisystemic wasting syndrome[J]. Can Vet, 1998, 39(1): 44-51.
[10]Vincent IE, Balmelli C, Meehan B, et al. Silencing of natural interferon producing cellactivation by porcine circovirus type 2 DNA[J]. Immunology, 2007, 120(1): 47-56.
[11]Li HC, Wang J, Huang XM, et al. Progress on immune response mechanism of porcine circovirus type 2[J]. Progr Vet Med,2014,(2): 105-109. (in Chinese) 李海超,王娟,黄秀梅,等.猪圆环病毒2型免疫应答机制研究进展[J].动物医学进展,2014(2):105-109.
[12]Wheeler JG, Osorio FA. Investigation of sites of pseudorabies virus latency, using polymerase chain reaction[J]. Vet Res, 1991, 52: 1799-1803. DOI: 10.1177/104063879400600414
[13]Brittle EE, Reynolds AE, Enquist LW. Two modes of pseudorabies virus neuroinvasion and lethality in mice[J]. Virology, 2004, 78: 12951-12963. DOI: 10.1128/JVI.78.23.12951-12963.2004
[14]Yang QF, Ning GB. The progress of swine pseudorabies[J]. Anim Husband and Vet Sci Technol Information, 2010: 15-18. (in Chinese) 杨庆芳,宁官保.猪伪狂犬病的研究进展[J].畜牧兽医科技信息,2010:15-18.
[15]Yi GD, Liu SH. The new features, development and control countermeasures of Pseudorabies diseases[J]. Chin J Prevent Vet Med,2000, 9(22): 216-218. (in Chinese) 尹广东,刘胜红.猪伪狂犬病发生的新特点、发展趋势与防控对策[J].中国预防兽医学报,2000,9(22):216-218.
[16]Zhao J, Zhang XM, Zhou B, et al. Serological survey of porcine circovirus type 2 in east China from 2008 to 2010[J]. Chin J Anim Infect Dis, 2010, 9(60): 49-52. (in Chinese) 赵津,张小敏,周斌,等.2008-2010年华东部分地区猪圆环病毒2型感染血清学调查[J].中国动物传染病学报,2010,9(60):49-52.
[17]Zhang ZM, Reng DQ, Dai XL, et al. Cloning and sequence analysis of gE gene fragment of pseudorabies virus H strain[J]. Chin Anim Husband Vet Med, 2010, 3(37): 99-101. DOI: 1671-7236(2010)03-0099-03 (in Chinese) 张智明,任德强,戴秀莉,等. 猪伪狂犬病病毒H株gE基因的克隆及序列分析[J].中国畜牧兽医,2010,3(37):99-101.DOI:1671-7236(2010)03-0099-03
[18]Xing JL, Gao FC. Research progress and application of detection method for porcine pseudorabies diagnosis[J]. Shandong J Anim Sci Vet Med, 2010, 9: 91-92. DOI: 1007-1733(2010)09-0091-02 (in Chinese) 邢俊玲,高付城.猪伪狂犬病诊断检测方法的研究进展及应用[J].山东畜牧兽医,2010, 9:91-92. DOI:1007-1733(2010)09-0091-02
Establishment and application of a duplex PCR for detecting pseudorabies virus and porcine circo virus type 2
WU Xue-min1,CHEN Ru-jing1,CHE Yong-liang1,WANG Long-bai1,CHEN qiu-yong2,YAN Shan1,LIU Yu-tao1,ZHOU Lun-jiang1
(1.InstituteofAnimalHusbandryandVeterinaryMedicine,FujianAcademyofAgricultureSciences/FujianAnimalDiseaseControlTechnologyDevelopmentCenter,Fuzhou350013,China;2.CollegeofAnimalSciences,FujianAgriculturalandForestryUniversity,Fuzhou350002,China)
We established a sensitive detection method for pseudorabies virus (PRV) and porcine circovirus type 2 (PCV2). Specific primers for detecting PRV and PCV2 were designed according to the full sequences of each virus strain obtained from GenBank, the length of amplification fragment were respectively 612 bp and 238 bp. The result of sequencing showed that the nucleotide homologies were 98.6% and 99.2% respectively compared with PRVYangsanand PCV2JX0301 sequences. A multiplex PCR was established to detect PRV and PCV2 by optimizing the PCR programs. The established assay was successfully used to detect PRV and PCV2 in 78 clinical samples, of which 11 samples were positive for PRV and PCV2, 59 samples for PCV2 and 17 samples for PRV. Results indicated that the established duplex PCR assay was suitable for rapid detection and epidemic surveillance of PRV and PCV2.
pseudorabies virus; porcine circovirus type 2; duplex PCR
Zhou Lun-jiang, Email:Email:lunjiang@163.com
周伦江,Email:lunjiang@163.com
1.福建省农业科学院畜牧兽医研究所/福建省畜禽疫病防治工程技术研究中心,福州 350013; 2.福建农林大学动物科学学院,福州 350002
10.3969/cjz.j.issn.1002-2694.2015.07.008
R373.9
A
1002-2694(2015)07-0631-04
2014-09-01;
2015-09-06
福建省自然科学基金科研项目(No.2014J01107),福建省公益类科研项目(No.2012R1025-8)

Supported by the funds of Fujian Science Research Project (No. 2014J01107) and the funds of Fujian Public Research Project (No. 2012R1025-8)

