铜绿假单胞菌clpP基因缺陷株的构建
张加勤,饶慧华,2,徐巧丽,2,黄朝阳,房丽丽,马晓波,宋秀宇
铜绿假单胞菌clpP基因缺陷株的构建
张加勤1,饶慧华1,2,徐巧丽1,2,黄朝阳1,房丽丽1,马晓波1,宋秀宇3
目的 构建铜绿假单胞菌clpP基因缺陷株。方法 分别以质粒pUCGM和铜绿假单胞菌PAO1基因组为模板PCR扩增庆大霉素抗性基因(GM)和铜绿假单胞菌clpP基因及其3′、5′侧翼序列,将clpP基因及其3′、5′侧翼序列克隆至pMD19T载体,EcoRV切除clpP基因37 bp~453 bp片段后,引入庆大霉素抗性基因,构建重组质粒pCKR2;EcoRⅠ/HindⅢ双酶切重组质粒pCKR2,回收FclpP-GM-clpPR片段,与自杀质粒pEX18Tc连接,得到clpP基因缺陷的同源重组载体pCKR3;将pCKR3质粒转化大肠埃希菌SM10,与铜绿假单胞菌PAO1双亲杂交,庆大霉素筛选得到铜绿假单胞菌clpP基因缺陷株。结果 经酶切鉴定同源重组载体pCKR3构建正确;PCR和DNA测序鉴定铜绿假单胞菌clpP基因缺陷株构建成功。结论 本研究成功敲除了铜绿假单胞菌clpP基因,为进一步研究clpP基因的生物学功能奠定了基础。
铜绿假单胞菌;clpP基因;双亲杂交;同源重组
铜绿假单胞菌(Pseudomonasaeruginosa,P.aeruginosa)是一种革兰阴性条件致病菌,能够在土壤、海洋以及动植物的组织等多种环境中生长繁殖,可引起菌血症、泌尿道感染和医院获得性肺炎。其中,铜绿假单胞菌所致的肺部慢性感染是肺部囊性纤维化病人高发病率和高死亡率的主要原因[1]。细菌定植及致病过程中,易受到来自机体免疫系统的攻击,引起菌体内蛋白质的损伤及异常聚集,如不及时清除会对细菌造成致命的损伤。研究表明,在荧光假单胞菌、大肠埃希菌及低GC含量革兰氏阳性细菌中,ClpP蛋白酶在细菌清除不可逆损伤蛋白质、维持内环境稳态等生物过程中发挥着重要作用[2-6]。铜绿假单胞菌ClpP蛋白酶由clpP基因编码,基因大小642 bp,与荧光假单胞菌clpP基因同源性高达84%,编码产物ClpP蛋白酶与荧光假单胞菌同源性达81%。因此我们推断铜绿假单胞菌ClpP蛋白酶亦具有与荧光假单胞菌ClpP蛋白酶相似的生物学功能。然而,目前关于铜绿假单胞菌ClpP蛋白酶功能及结构的报道较少,为研究ClpP在铜绿假单胞菌中的生物学功能,我们采用同源重组的方法构建了铜绿假单胞菌clpP基因缺陷株。
1 材料与方法
1.1 菌株和质粒 铜绿假单胞菌PAO1、大肠埃希菌DH5α、大肠埃希菌SM10为本实验室保存。质粒pMD19T 购自TaKaRa公司;pUCGM和pEX18Tc 载体为本实验室保存。
1.2 主要试剂和仪器 DNA 连接酶、限制性内切酶购自TaKaRa公司;PfuDNA Polymerase、质粒提取试剂盒购自上海生工生物工程技术服务有限公司;2×Taq PCR MasterMix、细菌基因组提取试剂盒购自北京天根生化科技公司;PCR产物/凝胶回收纯化试剂盒购自QIAGEN公司;其余为国产或进口分析纯试剂;PCR引物合成及DNA测序均由上海立菲生物技术有限公司完成。
1.3 实验步骤
1.3.1 同源重组载体pCKR3的构建
1.3.1.1clpP基因及其3′、5′侧翼序列和GM片段的克隆及鉴定 采用细菌基因组提取试剂盒提取铜绿假单胞菌PAO1基因组,设计PCR引物:clpP-F1(5′-CTGCCGAGTTCACCGTTAC-3′)和clpP-R1(5′-TCCTTCTTGTCACGCTGGT-3′),以P. aeruginosa PAO1基因组为模板扩增clpP基因及其3′、5′侧翼序列。反应体系为25 μL,反应条件为:95 ℃预变性5 min; 95 ℃ 30 s,57 ℃ 30 s,72 ℃ 1 min,共30个循环;72 ℃延伸10 min。采用质粒提取试剂盒提取pUCGM质粒DNA ,设计PCR引物:GM-F1(5′-CTCGAATTGACATAAGCCTG-3′)和GM-R1(5′-TACATTATACGAACGGTACG-3′),以pUCGM为模板,采用PfuDNA Polymerase扩增庆大霉素抗性基因。反应体系为50 μL,反应条件为:95 ℃预变性5 min;95 ℃ 30 s,57 ℃ 30 s,72 ℃ 2 min,共30个循环;72 ℃延伸10 min。扩增产物均经1%琼脂糖凝胶电泳鉴定,PCR回收纯化试剂盒回收,至-20 ℃保存备用。
1.3.1.2 重组质粒pCKR1的构建clpP基因及其3′、5′侧翼序列克隆至pMD19T载体上,转化大肠埃希菌DH5α感受态细胞,氨苄青霉素(100 μg/mL)筛选阳性克隆,37 ℃过夜培养,提取质粒用EcoRV酶切鉴定,重组质粒命名为pCKR1。
1.3.1.3 重组质粒pCKR2的构建 限制性内切酶EcoRV酶切pCKR1,电泳,回收大片段,与GM片段连接,庆大霉素(10 μg/mL)筛选获得重组载体pCKR2。
1.3.1.4 同源重组载体pCKR3的构建 限制性内切酶EcoRⅠ/HindⅢ双酶切pCKR2,回收FclpP-GM-clpPR片段和EcoRⅠ/HindⅢ酶切的pEX18Tc连接,庆大霉素(10 μg/mL)和四环素(100 μg/mL)筛选获得重组载体pCKR3。将pCKR3转化大肠埃希菌SM10感受态,命名为SCKR1,提取质粒用EcoRⅠ和HindⅢ酶切鉴定。
1.3.2 双亲杂交构建clpP缺陷株 铜绿假单胞菌PAO1与大肠埃希菌SCKR1培养至OD600分别为0.8~1.0和0.6~0.8,收集并洗涤菌体,以1∶4的比例混合于200 μL LB中,滴加于固相滤膜上,继续培养24 h。刮取固相膜上的菌落,洗涤并重悬,涂布于含有庆大霉素(40 μg/mL)的抗性平板上,37 ℃培养48 h。挑取阳性克隆经含庆大霉素的营养肉汤增菌培养,提取基因组DNA,PCR分析和DNA测序鉴定,引物为clpP-F2(5′-CCTGGTGGTTGCTCAGTTGCT-3′)/clpP-R2(5′-GCCGATACAGGTGGTCGAGACG-3′)。
2 结 果
2.1clpP基因和GM抗性片段的克隆与鉴定 以clpP-F1和clpP-R1为引物扩增clpP基因及其3′、5′侧翼序列,产物大小1.7 kb;以GM-F1和GM-R1为引物扩增的GM抗性片段大小约0.9 kb(图1)。
2.2 重组质粒pCKR1的鉴定clpP基因及其3′、5′侧翼序列与载体pMD19T连接,转化大肠埃希菌DH5α,EcoRV酶切鉴定,得到小片段0.4 kb和大片段4.0 kb(图2),测序结果与目的片段序列一致。
2.3 重组质粒pCKR2的鉴定 GM片段与pCKR1的EcoRV酶切大片段连接,构建重组质粒pCKR2。pCKR2经EcoRⅠ和HindⅢ酶切后分别得到2.3 kb的短片段和2.6 kb的长片段(图3),测序结果与目的片段序列一致。
2.4 同源重组载体pCKR3的鉴定 回收pCKR2经EcoRⅠ/HindⅢ酶切的FclpP-GM-clpPR片段,建立与EcoRⅠ/HindⅢ酶切的自杀质粒pEX18Tc的连接体系,获得同源重组载体pCKR3。pCKR3经EcoRⅠ和HindⅢ酶切鉴定,结果出现两条大小各为2.3 kb和6.2 kb的条带(图4),测序结果与目的片段序列一致。

M: D2000 marker; 1: PCR product of GMRcassette; 2: PCR product ofclpPgene with 3′ and 5′ flanking sequences.
图1 庆大霉素抗性基因和clpP基因及其3′、5′侧翼序列的PCR结果
Fig.1 PCR products of gentamicin resistant cassette andclpPgene with 3′ and 5′ flanking sequences

M: D2 000 marker; 1:EcoRV digestion of recombinant plasmid pCKR1; 2: Recombinant plasmid pCKR1
图2 重组质粒pCKR1的酶切鉴定结果
Fig.2 Restriction enzyme digestion of the recombinant plasmid pCKR1
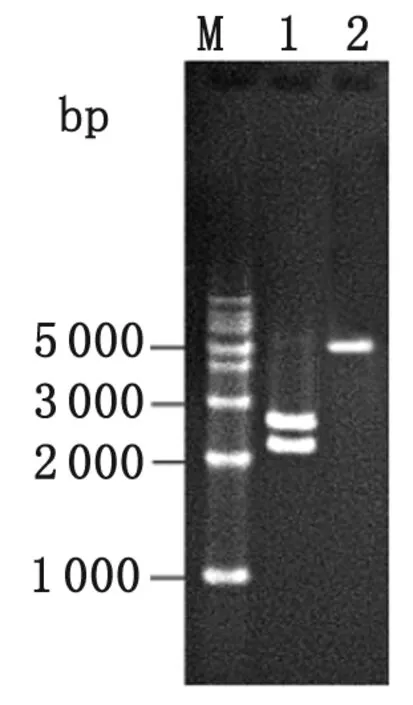
M: 1 kb marker; 1:EcoRⅠ/HindⅢ digestion of recombinant plasmid pCKR2; 2: recombinant plasmid pCKR2.
图3 重组质粒pCKR2的酶切鉴定结果
Fig.3 Restriction enzyme digestion of the recombinant plasmid pCKR2
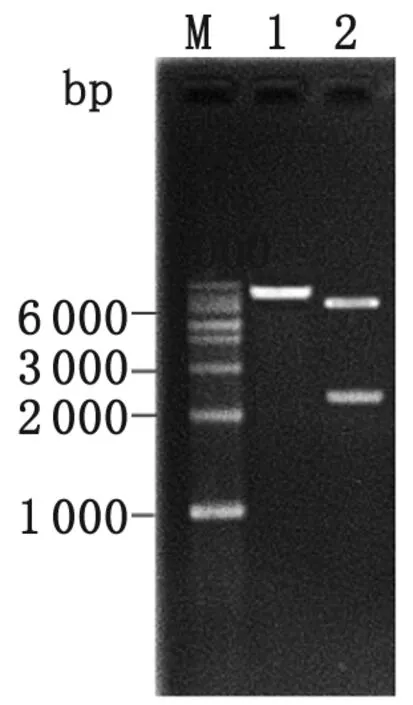
M: 1 kb marker; 1: Homologous recombinant plasmid pCKR3; 2:EcoRⅠ/HindⅢ digestion of pCKR3
图4 同源重组载体pCKR3的酶切鉴定结果
Fig.4 Restriction enzyme digestion of the homologous recombinant vector pCKR3
2.5 含有庆大霉素抗性的铜绿假单胞菌clpP缺陷株的鉴定 大肠埃希菌SCKR1与铜绿假单胞菌PAO1双亲杂交后,阳性转化株可在含有庆大霉素的培养基中生长良好,说明庆大霉素基因成功整合至铜绿假单胞菌的基因组中,并正确表达。PCR鉴定结果显示,以缺陷株基因组为模板不能扩增出clpP基因片段(图5),DNA测序显示clpP基因部分序列已被删除,且含有庆大霉素抗性基因。

M: D2000 marker; 1: PCR product ofP.aeruginosaPAO1; 2: PCR product ofclpPmutant
图5 铜绿假单胞菌clpP基因突变株的PCR鉴定结果
Fig.5 Electrophoresis ofP.areuginosamutation with deletedclpPgene
3 讨 论
构建基因功能缺失株和过表达株是后基因组时代研究基因功能最直接和最有效的方法之一。同源重组技术自20世纪70年代建立之初,即成为修饰真核、原核基因组遗传信息的常规手段,该技术可使外源基因整合入靶基因组上某一特定位点,构建目的基因缺失突变株。为研究铜绿假单胞菌ClpP蛋白酶的生物学功能,本研究采用同源重组染色体基因修饰技术构建铜绿假单胞菌clpP基因缺陷株,具有准确、高效的特点。同源重组的准确性与同源重组载体的同源度及同源臂大小密切相关,本研究在目的基因的上下游各设计500 bp ~ 1 000 bp的同源臂,既能满足重组的高度准确性,又不至于使重组片段过大而影响其进入菌体的数量。
为提高重组效率,本研究采用pEX18Tc质粒作为同源重组片段的载体,该质粒是适用于铜绿假单胞菌的自杀质粒,带有四环素抗性基因,由于铜绿假单胞菌中不含有pEX18Tc复制起始所需的复制蛋白,自杀质粒在细胞内不能复制,在外界选择性压力作用下,自杀质粒载体所携带的突变了的目的基因与宿主染色体基因组发生同源重组,利用目的基因内部插入的抗性基因筛选得到目的基因缺失突变株,而质粒载体本身由于自杀特性会随着细菌的传代从菌体内消失。采用自杀质粒不仅方便筛选,而且易于获得高浓度的重组片段,提高重组效率。
以往通常将质粒用化学或电转化的方法导入受体菌,两种方法转化效率虽高,但对于铜绿假单胞菌的转化条件要求十分严格。因为铜绿假单胞菌在其培养过程中会产生许多胞外多糖基质、纤维蛋白和脂质蛋白,包裹着菌体外层[7],采用化学方法细胞难以形成感受态,影响转化效率;若采用电转化,需选择较大的电压和较长的时间,但电压过大往往导致细胞死亡过度,电压不足时,在靶细胞壁上形成的亲水通道又不足以维持外源DNA分子的进入,导致转化效率低下。因此我们采用接合转移,双亲杂交是以含有F因子的革兰阴性菌作为供体菌,将自身含有的质粒转移至受体菌中的一种接合转移。大肠埃希菌SM10包含pir基因,可用于质粒克隆和接合。以SM10为供体菌,铜绿假单胞菌为受体菌,可将构建好的质粒例如pCKR3转移至铜绿假单胞菌,完成同源重组工作。接合转移不需要制作感受态细胞,操作简便,适用于铜绿假单胞菌的转化。本研究采用接合转移已成功构建了铜绿假单胞菌clpP基因缺陷株,并通过测序鉴定证明构建正确,这将为下一步研究clpP基因的具体生物学功能奠定基础。
[1]Qiu D, Eisinger VM, Head NE, et al. ClpXP proteases positively regulate alginate overexpression and mucoid conversion inPseudomonasaeruginosa[J]. Microbiology, 2008,154(Pt 7): 2119-2130.
[2]Dougan DA, Mogk A, Bukau B. Protein folding and degradation in bacteria: to degrade or not to degrade? That is the question[J]. Cell Mol Life Sci, 2002, 59(10): 1607-1616.
[3]Gottesman S. Proteases and their targets inEscherichiacoli[J]. Annu Rev Genet, 1996, 30: 465-506.
[4]WANG zhen-hai,SUN ye-qing. Progress in Study on Clp Protease[J]. Pharmaceutical Biotechnology,2005,12(6):412-415. 王振海,孙野青. Clp蛋白酶研究进展[J]. 药物生物技术, 2005,12(6):412-415.英文对照
[5]Yu AY, Houry WA. ClpP: a distinctive family of cylindrical energy-dependent serine proteases[J]. FEBS Lett, 2007, 581(19): 3749-3757.
[6]de Bruijn I, Raaijmakers JM. Regulation of cyclic lipopeptide biosynthesis inPseudomonasfluorescensby the ClpP protease[J]. J Bacteriol, 2009, 191(6): 1910-1923.
[7]Bjarnsholt T, Jensen PO, Fiandaca MJ, et al.Pseudomonasaeruginosabiofilms in the respiratory tract of cystic fibrosis patients[J]. Pediatr Pulmonol, 2009, 44(6): 547-558.
Construction of theclpPmutant strain ofPseudomonasaeruginosa
ZHANG Jia-qin1,RAO Hui-hua1,2,XU Qiao-li1,2,HUANG Chao-yang1,FANG Li-li1,MA Xiao-bo1,SONG Xiu-yu3
(1.DepartmentofClinicalLaboratory,theFirstAffiliatedHospitalofXiamenUniversity,Xiamen361003,China;2.TheFirstClinicalMedicalCollegeofFujianMedicalUniversity,Fuzhou350005,China;3.XiamenCentralBloodServiceStation,Xiamen361003,China)
To deleteclpPgene ofPseudomonasaeruginosaPAO1, theclpPgene with 3′ and 5′ flanking sequences was amplified by PCR using the primers clpP-F1and clpP-R1, and then the PCR product was cloned into pMD19T for construction of pCKR1. A gentamicin resistance cassette amplified from pUCGM was inserted intoEcoRV sites of pCKR1 for construction of pCKR2. Then the FclpP-GM-clpPR fragment was obtained by cutting pCKR2 withEcoRⅠ/HindⅢ and gel purification, and inserted it intoEcoRⅠ/HindⅢ sites of pEX18Tc to construct the homologous recombinant vector pCKR3. TheP.aeruginosaclpPmutant strain was obtained by conjugations betweenP.aeruginosaPAO1 andE.coliSM10 transformed with pCKR3. The homologous recombinant vector pCKR3 was verified by enzymatic digestion and the finalP.aeruginosaclpPmutant strain was verified by PCR analysis and DNA sequencing. TheclpPgene ofP.aeruginosawas successfully deleted, which laid a foundation for further study of its biological function.
Pseudomonasaeruginosa;clpPgene; conjugations; homologous recombinant
Song Xiu-yu, Email: songxyxm@126.com
国家自然科学基因(No.81000762);福建省自然科学基金(No.2010D018,2013D002)
宋秀宇,Email:songxyxm@126.com
1.厦门大学附属第一医院检验科,厦门 361003; 2.福建医科大学第一临床医学院,福州 350005; 3.厦门市中心血站,厦门 361003
10.3969/cjz.j.issn.1002-2694.2015.07.007
R378
A
1002-2694(2015)07-0627-04
2014-09-09;
2015-05-01

Supported by the National Natural Science Fundation (No. 81000762) and the Natural Science Fund of Fujian Province (Nos. 2010D018 and 2013D002)

