应用多位点VNTR分析进行铜绿假单胞菌院内感染溯源的研究*
李艳君,李妍妮,钱扬会,丁赔赔,丁毅伟,赵强元
(海军总医院检验科,北京 100048)
·论 著·
应用多位点VNTR分析进行铜绿假单胞菌院内感染溯源的研究*
李艳君,李妍妮,钱扬会,丁赔赔,丁毅伟,赵强元△
(海军总医院检验科,北京 100048)
目的 应用多位点可变数目串联重复序列(VNTR)分析方法进行多重耐药铜绿假单胞菌分子分型,为由铜绿假单胞菌引发的院内感染的溯源和流行病学调研提供依据。方法 从铜绿假单胞菌基因组中筛选12个VNTR位点,设计合成引物;对98株多重耐药铜绿假单胞菌进行PCR扩增,产物毛细管电泳;根据产物大小计算各VNTR位点的重复数,构建系统发育树,进行数据分析。结果 12个位点的多态性指数(DI)为0.45~0.88,将98株铜绿假单胞菌分成5个群,88个基因型,同病区分离的菌株具有一定的同源性。结论 多位点VNTR分析具有很高的分辨率,适用于铜绿假单胞菌基因分型和溯源研究,具有很好的应用前景。
铜绿假单胞菌; VNTR; 基因分型; 同源性
随着抗生素的广泛使用和各种侵入性治疗技术的开展,院内感染发生率居高不下,给临床治疗带来了很大困难,同时给医疗机构和患者带来巨大的经济负担。铜绿假单胞菌是院内感染最主要的病原菌之一[1],可引起多部位、多系统的感染,铜绿假单胞菌肺炎致死率达30%以上,败血症的病死率则高达80%~90%。近年来,铜绿假单胞菌耐药形势日趋严峻,多重耐药及泛耐药株的分离率呈逐年上升趋势[2-3]。因此,早期诊断并控制由铜绿假单胞菌引起的院内感染,是提高治愈率,减少病死率的关键。
卫生部《三级综合医院评审标准实施细则(2011)》中要求按照《医院感染监测规范》,监测重点环节、重点人群与高危险因素,采用监控指标管理,控制并降低医院感染风险。病原菌的溯源是院内感染监控的主要手段,能够为院内获得性感染的诊断提供流行病学依据。
然而目前对于铜绿假单胞菌引起的各类感染是否为院内获得性感染,其感染源自何处,其传播途径如何都缺乏直观、可靠的判断依据,建立一种简单、快速、可靠、普遍适用的分型方法已迫在眉睫,对医院感染的流行病学研究也有十分重要的意义。本研究应用多位点可变数目串联重复序列(VNTR)分析方法,对收集的多重耐药铜绿假单胞菌进行分型和溯源的初步研究,现报道如下。
1 材料与方法
1.1 材料 98株多重耐药铜绿假单胞菌包括分离自2012~2014年本院22个病区的89株,北京医院7株,广安门医院1株和1株标准菌株ATCC27853,所有菌株分离培养后,挑取单个菌落进行增菌,应用离心柱法提取菌株DNA。
1.2 仪器与试剂 主要仪器包括BC-subMIDI电泳仪(北京六一仪器厂);BioSens SC 810B凝胶成像仪(上海山富科学仪器有限公司);GeneAmp 9600 PCR仪(ABI公司);3730XL DNA分析仪(ABI公司)。主要试剂包括TAKARA Taq HotStart扩增试剂(TAKARA公司),高纯度甲酰胺,3100POP-4胶,ROX-500 和ROX-1000 内标(北京阅微基因技术有限公司),毛细管电泳缓冲液(美国ABI 公司)。
1.3 方法 用12对VNTR 扩增引物对菌株DNA进行扩增,采用 15 μL扩增体系,反应条件为:95 ℃预变性10 min后,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s 共进行30个循环,最后72 ℃终延伸5 min。1.0 μL产物加入相对分子质量内标和甲酰胺混合液(0.5∶8.5)9 μL,95 ℃变性3 min后上机检测。
1.4 同源性分析 采用Genescan3.7计算扩增产物的相对分子质量,计算出每株菌株在每个位点的VNTR 重复数。将 VNTR 重复数结果导入BioNumerics 6.00 软件,选择分类数据类型,使用UPGMA 方法进行聚类分析,构建系统发育树,分析铜绿假单胞菌各VNTR基因型分布特征和聚类关系,进行菌株同源性分析。
2 结 果
2.1 铜绿假单胞菌基因组中的12个VNTR位点及特征 研究所选的12个VNTR位点特征及其多态性指数(DI),见表1。
2.2 基于12个VNTR位点的铜绿假单胞菌基因分型 应用12个VNTR位点将98株多重耐药铜绿假单胞菌分成5个群,88个基因型,见图1。其中外院8株菌株和ATCC27853分布在E群,本院高压氧病区的12株菌(编号为GYY-1~12)分布在D群,ICU病区的12株菌(编号为ICU-1~12)分布在C群,心脏中心病区(编号为XZ-1~4)和干部综合内科(编号为GZ-1~2)的菌株分布在B群,呼吸内科病区的菌株(编号为HX-1~8)分布在A群,其他病区的菌株零散分布在5个群中。
2.3 部分菌株的同源性分析结果 研究中选择的8例患者的不同分离株,包括同一类型标本分离时间不同,同一患者不同类型标本来源的12个位点的重复数据,见表2。除患者GX-1在2012年和2013年分离自痰标本的2株铜绿假单胞菌在ms216和ms172位点的重复数有所不同,其他同一患者的不同分离株在12个位点的重复数均相同。
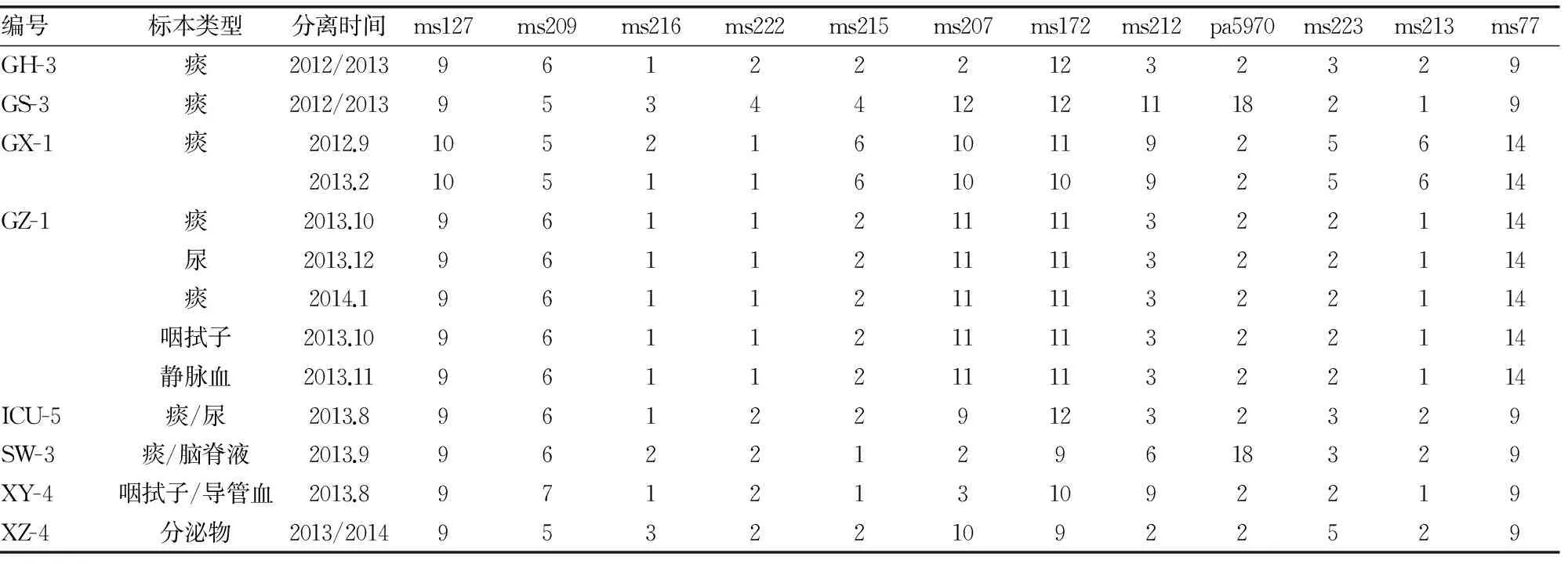
表2 来源于8例患者的不同分离株在12个VNTR位点的重复数

图1 基于12个VNTR位点的98株铜绿假
3 讨 论
铜绿假单胞菌是引发院内感染最主要的病原菌,随着多重耐药和泛耐药株的不断出现,给临床治疗带来很大的困难,进行分子分型和同源性分析,对于判断感染来源,切断传播途径,控制感染蔓延具有非常重要的流行病学意义。而目前对于铜绿假单胞菌的分型和溯源研究还很局限,有研究采用随机扩增多态性DNA(RAPD)、重复片段PCR(rep-PCR)和脉冲场凝胶电泳(PFGE)等方法对铜绿假单胞菌进行同源性分析[4-7],RAPD虽然分辨力高,但是可重复性较差,而且实验步骤繁琐,需要用到同位素;rep-PCR操作相对简单,但是分辨力不够,很难区分近缘菌株,而且数据分析对软件要求较高,很难在普通实验室普及。
VNTR是真核及原核生物基因组中广泛存在的一种重复序列,相同的序列以首尾相连的形式串联在一起,在不同个体间由于重复次数的不同而实现区分。近年来,VNTR作为一种高分辨力的分型溯源方法应用日益广泛,目前已经用于对鼠疫耶尔森菌、流感嗜血杆菌、结核分枝杆菌、炭疽芽孢杆菌和嗜肺军团菌等进行基因分型和基因组多态性研究[8-10]。
近年来,国外已有报道应用VNTR对铜绿假单胞菌进行基因分型的研究[11-13],本研究在此基础上,对本院及外院98株多重耐药的铜绿假单胞菌进行分型和同源性分析。本研究中所选用的VNTR位点,其中11个为前期研究选用的成熟位点[11],pa5970为本研究通过生物信息学手段,从20株完成全基因组测序的铜绿假单胞菌基因组中筛选的新位点。DI是评价VNTR分型能力的指标,DI值过低,分型能力不足,难以将近源菌株进行区分,DI值过高,容易导致非同源相似性。本研究选择的12个位点,DI分布适中,在0.48~0.89之间,一方面具有一定的分型能力,另一方面可避免高突变导致的非同源相似性。
多位点VNTR分析方法具有很高的分辨率,本研究中12个位点将98株铜绿假单胞菌分成5个群(A~E),88个基因型(图1)。除同一患者不同分离株具备同一基因型外,其他菌株各成一型,说明多位点VNTR分析的分型能力非常强大。从图1可见,本院多重耐药铜绿假单胞菌主要分布在高压氧病区(GYY)为主的D群、ICU为主的C群、心脏中心病区(XZ)和干部综合内科病区(GZ)为主的B群和呼吸科病区(HX)为主的A群,其他病区的菌株呈现散在分布,分析可能是由于这些患者在不同病区间进行过治疗,携带的菌株不具有科室特异性。另外,本研究中选用的8株外院菌株和ATCC27853自成一群(A群),与本院各科室的菌株实现了很好的区分,说明基于12个VNTR位点的分型能够区分和判断外来的感染。
本研究对基于VNTR的同源性分析也进行了初步探讨,选择了8例患者的不同分离株进行VNTR分析(见表2)。结果除了来自干部病房心血管内科(GX)的患者在2012年和2013年分别分离的2株菌在ms216和ms172位点的重复数有所不同以外,其他7例患者的不同分离株在12个位点的数据完全一致,由此可以判断患者感染的原发灶。例如患者GZ-1,2013年10月首先在痰中分离出铜绿假单胞菌,同月在咽拭子标本中分离出第2株分离株,11月从血培养标本中分离出第3株分离株,12月患者发生尿路感染,培养分离出第4株铜绿假单胞菌,2014年1月又从患者痰液标本分离出第5株分离株,经VNTR分析,这5株不同时间、不同来源的铜绿假单胞菌为同一克隆株,推测患者首先通过呼吸道感染,后来入血,又导致了尿路感染,呼吸道可疑为原发灶。
本研究通过应用生物信息学方法筛选铜绿假单胞菌基因组中的VNTR位点,探讨其分布及其特征,对保存的多重耐药菌株进行基因分型研究,摸索实验方法和条件,初步建立了基于多位点VNTR分析的同源性检测技术方法,积累部分病区的多样性数据资源,为铜绿假单胞菌引起的院内感染和溯源流行病学监控提供了技术方法和诊断依据,具有一定的临床应用价值和广阔的应用前景。
[1]夏静鸿,林玮,李夏明,等.2008~2009年铜绿假单胞菌的分离率及耐药情况分析[J].临床肺科杂志,2011,16(4):493-496.
[2]丁艳苓,陈亚红,姚婉贞,等.多重耐药铜绿假单胞菌的耐药性分析[J].中国抗生素杂志,2012,37(1):63-67.
[3]施晓群,孙景勇,倪语星,等.2011年中国CHINET铜绿假单胞菌耐药性监测[J].中国感染与化疗杂志,2013,13(3):218-221.
[4]Wolska K,Kot B.Twitching motility activity,biofilm formation,and genetic typing for clinical isolates of Pseudomonas aeruginosaby random amplified DNA PCR[J].Acta Microbiol Immunol Hung,2013,60(3):313-328.
[5]孙晶,常军霞,刘巍.ERIC-PCR与PFGE检测铜绿假单胞菌同源性的方法学比较[J].中国抗生素杂志,2013,38(4):297-302.
[6]Wolska K,Szweda P.A comparative evaluation of PCR ribotyping and ERIC PCR for determining the diversity of clinical Pseudomonas aeruginosa isolates[J].Pol J Microbiol,2008,57(2):157-163.
[7]Pappa O,Mandilara G,Vatopoulos A,et al.Typing of Pseudomonas aeruginosa strains isolated from Greek water samples by three typing methods:serotyping,Random Amplified Polymorphic DNA(RAPD) and Pulsed Field Gel Electrophoresis(PFGE)[J].Water Sci Technol,2013,67(6):1380-1388.
[8]Ortatatli M,Karagoz A,Percin D,et al.Antimicrobial susceptibility and molecular subtyping of 55 Turkish Bacillus anthracis strains using 25-loci multiple-locus VNTR analysis[J].Comp Immunol Microbiol Infect Dis,2012,35(4):355-361.
[9]Li Y,Cui Y,Cui B,et al.Features of variable number of tandem repeats in Yersinia pestis and the development of a hierarchical genotyping scheme[J].PLoS One,2013,8(6):e66567.
[10]Lee J,Kang H,Kim S,et al.Optimal combination of VNTR typing for discrimination of isolated mycobacterium tuberculosis in Korea[J].Tuberc Respir Dis,2014,76(2):59-65.
[11]Vu-Thien H,Corbineau G,Hormigos K,et al.Multiple-locus variable-number tandem-repeat analysis for longitudinal survey of sources of Pseudomonas aeruginosa infection in cystic fibrosis patients[J].J Clin Microbiol,2007,45(10):3175-3183.
[12]Larché J,Pouillot F,Essoh C,et al.Rapid identification of international multidrug resistant Pseudomonas aeruginosa clones by multiple-locus variable number of tandem repeats analysis and investigation of their susceptibility to lytic bacteriophages[J].Antimicrob Agents Chemother,2012,56(12):6175-6180.
[13]Sobral D,Mariani-Kurkdjian P,Bingen E,et al.A new highly discriminatory multiplex capillary-based MLVA assay as a tool for the epidemiological survey of Pseudomonas aeruginosa in cystic fibrosis patients[J].Eur J Clin Microbiol Infect Dis,2012,31(9):2247-2256.
Study of traceability of nosocomial infection of Pseudomonas aeruginosa by multi-loci VNTR*
LIYan-jun,LIYan-ni,QIANYang-hui,DINGPei-pei,DINGYi-wei,ZHAOQiang-yuan△
(DepartmentofClinicalLaboratory,NavyGeneralHospital,Beijing100048,China)
Objective To conduct the molecular typing of multi-drug-resistance Pseudomonas aeruginosa by using the multi-loci VNTR analysis to provide the basis for the traceability the nosocomial infection caused by Pseudomonas aeruginosa and epidemiological survey and research.Methods 12 VNTR loci were screened from the Pseudomonas aeruginosa genome and the PCR primers were designed.98 strains of multi-drug-resistance Pseudomonas aeruginosa were perfromed the PCR amplification by using the above primers and the products were conducted the capillary electrophoresis.The repeat numbers of various loci were calculated according to the products size and the phylogenetic tree was constructed for conducting the data analysis.Results The diversity index(DI) of 12 loci ranged from 0.45-0.88,and 98 strains of Pseudomonas aeruginosa were grouped into 5 clusters,88 genotypes.The isolates from the same ward presented certain homology.Conclusion The multi-loci VNTR analysis presents higher discrimination power and suitable for genotyping and traceability research of Pseudomonas aeruginosa,and has good application prospect.
Pseudomonas aeruginosa; VNTR; genotype; homology
国家自然科学基金资助项目(31170008)。
李艳君,女,博士,副主任医师,主要从事医学微生物研究。
△通讯作者,E-mail:zhaoqiangyuan001@126.com。
10.3969/j.issn.1672-9455.2015.19.001
A
1672-9455(2015)19-2811-03
2015-03-05
2015-06-10)

