pH值对乙二醇溶胶-凝胶法制备BiVO4光催化性能的影响
王 敏,郑浩岩,杨长秀,高兴莹,董竹希文,罗 洋,陈 垚
(沈阳理工大学 环境与化学工程学院,沈阳 110159)
pH值对乙二醇溶胶-凝胶法制备BiVO4光催化性能的影响
王 敏,郑浩岩,杨长秀,高兴莹,董竹希文,罗 洋,陈 垚
(沈阳理工大学 环境与化学工程学院,沈阳 110159)
采用乙二醇溶胶-凝胶法制备了BiVO4样品,研究了不同反应pH值对样品的形貌及光催化活性的影响。通过SEM,XRD,XPS和UV-Vis等表征手段对样品的形貌、物相以及光学性能进行表征和分析。结果表明:所制备的样品纯度较高,均为单斜型BiVO4光催化剂,并且随着反应pH值的改变,样品的形貌及光学性能也随之改变;当pH值为5时,产物为不规则的片状结构;当pH值增至7和9时,产物片状结构大量减少,表现出明显的颗粒状结构;当反应 pH值增至11和13时,产物颗粒状结构团聚明显。当pH值为9时,所制备的样品具有最小的禁带宽度以及最小的晶体粒径,并且表现出最高的光催化活性,在250W金属卤化物灯下光照50min,对甲基橙的脱色率可达66.23%。
钒酸铋;乙二醇;光催化;甲基橙;溶胶-凝胶
随着能源短缺和环境污染问题的日益严重,节能环保已经成为当今世界各国面临的重要课题。近年来,光催化剂在环保方面表现出的优良特性,获得了人们的广泛关注[1-3]。其中TiO2以其低成本,无毒性和良好的光催化性能,已经在环境治理方面得到了一定的应用[4-6],但由于其光响应区域只局限于紫外光范围,限制了TiO2的进一步发展[7],因此促使科学家们寻求利用可见光作为能源的替代材料[8,9]。
科学家们发现禁带宽度为2.4eV的单斜型BiVO4在可见光下具有良好的光催化效果,从而能够利用可见光催化降解污染物,使其成为最有前景的可见光催化材料之一[10-13]。
目前BiVO4合成方法基本都采用水热法[14],Zhang等[15]采用水热法合成了复合相的BiVO4光催化剂,并研究了不同反应pH对催化剂形貌及活性的影响。Obregón等[16]采用水热法,通过改变基本反应条件合成了不同形貌的BiVO4光催化剂,结果表明当BiVO4的形貌为针状时表现出最高的光催化活性。而采用溶胶-凝胶法制备BiVO4的研究鲜见报道[17]。本工作以硝酸铋、偏钒酸铵为原料,乙二醇为溶剂,采用溶胶-凝胶法合成钒酸铋前驱体,通过改变前驱体反应pH值,制备得到系列BiVO4光催化材料,同时利用XRD,SEM,XPS和UV-Vis等手段对样品的物相、形貌、元素价态和光吸收性能进行表征和分析,并通过降解模拟废水(甲基橙溶液),探讨了pH值与制备的系列样品的光催化性能之间的关系。与传统柠檬酸溶胶-凝胶法相比,乙二醇溶胶-凝胶法具有反应成胶可控性好、前驱体易得、煅烧充分等优势,为BiVO4的合成提供了新的途径。
1 实验材料与方法
1.1 光催化剂的制备
本实验以Bi(NO3)3·5H2O(97%,质量分数,下同),NH4VO3(98.5%)为源物质,乙二醇为溶剂,采用溶胶-凝胶过程制备BiVO4粉体。将5mmol Bi(NO3)3·5H2O和5mmol NH4VO3分别溶于25mL乙二醇溶剂中,持续加热(80℃)搅拌15min,Bi(NO3)3·5H2O完全溶解,形成无色透明溶液A,NH4VO3完全溶解,形成棕色溶液B;然后将溶液B缓慢加入溶液A中,通过改变氨水添加量,调节溶液的pH值(分别为5,7,9,11和13),形成黄色乳状液,持续恒温搅拌,使溶剂大量蒸发,直到形成灰色溶胶;之后将其前躯体置于80℃的烘箱中烘干,研磨后在马弗炉中以550℃煅烧5h,自然冷却取出后,加无水乙醇二次研磨待用。
1.2 光催化剂的表征
采用D/max-RB X射线衍射仪(XRD)(Cu靶,Kα射线,40kV,100mA,λ=0.15418nm)对催化剂的晶相进行分析;采用Hitach S-3400N 扫描电子显微镜(SEM)观察样品的微观结构和表面形貌。采用Hitach 1800紫外-可见吸收光谱仪(UV-Vis),积分球,BaSO4为背底,扫描速率为200nm/min。采用 Thermo ESCALAB 250Xi X射线光电子能谱(XPS)分析催化剂的元素组成和价态,以本体的污染碳C1s结合能(284.6eV)为标准,对样品进行校正,从而确定元素的结合能。
1.3 催化剂活性评价
向250mL烧杯中加入50mL质量浓度为15mg/L的甲基橙溶液和0.03g催化剂样品。首先避光磁力搅拌30min,以建立吸附-脱附平衡及暗态反应平衡。磁力搅拌使催化剂在甲基橙溶液中呈悬浮状态。采用250W金属卤化物灯为可见光光源,灯距上液面14cm,并且在光源下放置一片滤光光阑(型号:UPG-320,λ为400~1100nm,厚度为2mm),使λ>400nm的可见光通过光阑,以保证光催化反应是在可见光下进行。在实验过程中不断磁力搅拌,每隔10min取样1次,静置片刻,取其上层清液用φ45μm滤膜过滤后再用紫外-可见分光光度仪在波长452nm处测定其吸光度,计算甲基橙的降解率。
2 结果与讨论
2.1 样品的XRD分析
图1为不同pH值下制备的样品的XRD图谱,样品在(110),(011),(121),(040),(200)等晶面出现了较强的衍射峰。从图1可以看出,在给定的实验条件下,当pH为5,7,9,11和13时所制备的样品的衍射峰与标准卡号JSCD 14-688衍射数据相吻合,样品中没有出现其他杂质的峰,说明样品的纯度较好,所制得样品均为单斜型BiVO4。由(110)晶面,通过Scherrer公式d=0.89λ/βcosθ,计算各pH值下制备的样品的晶体粒径分别为44.39,43.90,42.08,43.20,43.66nm,这说明酸性条件下,随着反应溶液pH的增大,晶体的粒径随之减小。在碱性条件下,随着反应溶液pH的增大,晶体的粒径随之增大。这与SEM表征结果基本相符。通过进一步计算得到样品的晶胞体积及晶胞参数见表1。晶胞体积的变化规律与计算所得的平均粒径结果相符。
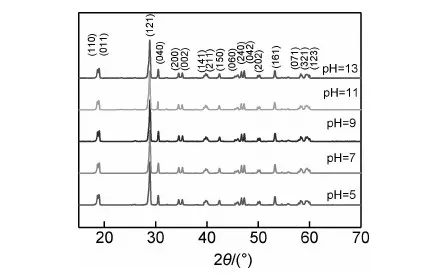
图1 不同pH值下制备的BiVO4的XRD图谱Fig.1 XRD patterns of BiVO4 samples at different pH values

Samplea/nmb/nmc/nmv/nm3JSCD14⁃6885.1960011.701005.09200309.52pH=55.2010911.711365.09649310.44pH=75.1996411.693265.09557309.81pH=95.1944811.700175.09002309.39pH=115.1998211.699285.09517309.96pH=135.2011211.701485.09609310.15
2.2 样品的SEM分析
图2为不同pH值下制备的BiVO4样品的SEM图。由图2可以看出,不同pH值下制得样品的形貌呈现一定规律的变化,当反应pH为5时样品是无规则的片状结构,并且夹杂着少量的颗粒状结构;当pH值逐渐升高到7,9,11,13时片状结构大量减少,表现为明显的颗粒状结构;当反应pH为7,9时制得的样品的颗粒分布均匀,无明显的粘连现象,并且可以看出,样品的颗粒较pH为5时制得的样品颗粒有所减小;当反应pH升高到11,13时样品的团聚现象愈加明显。从图2中还可以看出,随着pH的逐渐升高样品颗粒呈现先减小后增大的趋势,这与XRD表征结果的规律是一致的。当反应pH为9时,所制得样品的颗粒分布均匀,并且无明显的团聚现象,这可能是该样品较其他样品活性高的原因之一。

图2 不同pH值下制备的BiVO4的SEM图 (a)pH=5;(b)pH=7;(c)pH=9;(d)pH=11;(e)pH=13Fig.2 SEM images of BiVO4 at different pH values (a)pH=5;(b)pH=7;(c)pH=9;(d)pH=11;(e)pH=13
2.3 样品的UV-Vis分析
图3为不同pH值下制备的BiVO4样品的紫外-可见漫反射光谱。由图3(a)可以看出,不同pH值下制备的样品在可见光(390~770nm)区域都有较强的吸收性能,且不同pH值下制备的BiVO4对可见光的吸收相似。作为一种半导体光催化材料,BiVO4的禁带宽度遵循如下公式:
αhν=A(hν-Eg)
(1)
式中:α为光吸收系数;h为普朗克常数;ν为光频率;A为常数;Eg为能带隙。依据式(1)得出光吸收系数(αhν)0.5对能量(hν)的关系曲线(见图3(b)),并对所得曲线做切线,当αhν=0时对应的切线值即为不同pH条件下制得样品的直接禁带宽度。由图3(b)可得,在pH值为5,7,9,11和13时制备的样品的禁带宽度分别为 2.48,2.47,2.39,2.45,2.47eV。结果表明:当pH=9时样品的禁带宽度最小,其他条件制备的样品的禁带宽度变化不大,这也是pH=9时制得的样品较其他条件下制得的样品活性高的原因之一,且与光催化活性测定的结果相吻合。

图3 样品的UV-Vis图(a)与样品的禁带宽度图(b)Fig.3 UV-Vis absorption (a) and band gap spectra(b) of samples
2.4 样品的XPS分析
为了研究样品的价态和化学组成,对pH=9时制备的样品进行XPS表征,图4(a)为pH=9时制得样品的XPS全扫描图谱,图谱显示样品中含有Bi,V,O和C元素,其中C元素为检测仪中污染所致,这与预期结果相符。
图4(b)为pH=9时BiVO4样品Bi4f的高分辨率双峰能图谱,其中样品的Bi4f在Eb=159.05,164.32eV处出现两个明显的特征峰,分别为Bi4f7/2与Bi4f5/2的结合能,与特征图谱对比,可以得出所制备的样品中Bi均以+3价态存在[18]。
图4(c)为pH=9时BiVO4样品V2p2/3的高分辨
率能图谱,其中不对称的V2p2/3特征峰,可以分解为两个结合能位于516.79eV 和516.27eV的两个特征峰,与特征图谱对比,两个特征峰值分别对应的是V4+和V5+,根据电中性原理,可以推测所制备的BiVO4样品存在氧空位。
图4(d)为pH=9时BiVO4样品O1s2/3的高分辨率能图谱,其中不对称的O1s2/3特征峰,可以分解为两个结合能位于529.42eV和530.04eV的两个特征峰,与特征图谱对比,两个特征峰值分别归属为样品Bi—O键中的晶格氧(Olatt)和表面吸附氧(Oads),且表面吸附氧的存在有助于光催化活性的提高[17]。
通过计算BiVO4样品表面Bi与V摩尔比为1.14,说明制备的样品较纯净,这与XRD表征结果一致。 V4+与V5+摩尔比为0.91,Oads与Olatt摩尔比为0.39。V4+与V5+摩尔比和Oads与Olatt摩尔比标志着氧空位浓度的高低,其中氧空位的存在是光催化活性较高的理论依据之一。
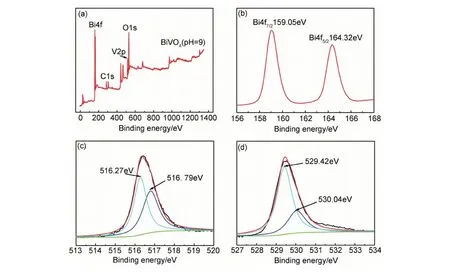
图4 样品pH=9时BiVO4的XPS谱图 (a)全扫描;(b)Bi4f;(c)V2p;(d)O1sFig.4 XPS spectra of BiVO4 samples at pH=9 (a)full scan;(b)Bi4f;(c)V2p;(d)O1s
2.5 光催化活性分析
图5为光催化降解甲基橙机理图,当用能量等于或大于禁带宽度的光照射BiVO4时,其价带上的电子就会被激发,从价带越过禁带到达导带,从而在价带和导带上分别形成光生空穴和光生电子。光生空穴具有强氧化性,能将OH-氧化为OH,OH具有更强的氧化性,能够氧化催化剂表面的甲基橙;而光生电子具有强还原性,能将O2还原成O2-,从而参与氧化还原反应。

图5 光催化降解甲基橙机理图Fig.5 Proposed degradation mechanism of methyl orange by BiVO4 under visible light irradiation
图6为不同pH值下制备的样品对甲基橙的降解率,通过对甲基橙的脱色率来评价所制得样品的光催化活性,由图6可知,当pH值为5,7,9,11和13时制得的样品在250W金属卤化物灯下光照50min后,对甲基橙的脱色率分别达到38.61%,63.23%,66.23%,38.63%,37.81%。综上所述:当pH值为9时所制得的催化剂效果最好,光照50min对甲基橙的脱色率达66.23%。这说明存在最佳制备pH值。分析活性提高的主要原因有:(1)不同pH值下,BiVO4结晶习性存在一定差异,这是由于不同pH值下BiVO4不同晶面的吸附H+和吸附OH-存在明显差异,使不同方向上的晶面生长速度各不相同,从而改变结晶习性[19]。(2)带隙能的降低,导致光吸收能力的增强,从而更有效地利用可见光,进而提高了光催化活性。这与UV-Vis表征时pH=9的样品具有较小的带隙能存在一定的关系。(3)pH值为9时制得的样品可能产生较多的氧空位,相关文献报道[17],氧空位的增加有助于光催化活性的提高。

图6 不同pH值下制备的样品对甲基橙的降解率Fig.6 Methyl orange degradation rate under visible light illumination at different pH values
为了进一步探讨样品的光催化活性,对样品的可见光降解反应进行了动力学方面的研究。首先,甲基橙的降解为一级反应,则其速率方程为:
-ln(Ct/C0)=kt
(2)
式中:Ct为任意时刻浓度;C0为甲基橙的初始浓度;k为反应速率常数。将图6的纵坐标数据用-ln(Ct/C0)表示,横坐标为时间t,可得图7。由图7可知,其一级反应相关系数R均大于0.97,说明催化剂光降解规律遵从一级反应动力学,并且可以看出pH=9时所制得的样品反应速率常数最大,表现出最佳的光催化活性。

图7 催化剂的-ln(Ct/C0)与可见光照射时间t的关系Fig.7 -ln(Ct/C0) as a function of t on the catalysts irradiated under visible light
3 结论
(1)本实验成功制备了单斜相BiVO4光催化剂,并通过改变反应pH值制备出具有不同禁带宽度和不同形貌的BiVO4样品。当反应pH值为5时,产物大多为不规则的片状结构,禁带宽度为2.48eV。当pH值增至7和9时,产物片状结构大量减少,表现出明显的颗粒状结构,并且禁带宽度逐渐减小,分别为2.47eV和2.39eV。当反应 pH值增至11和13时, 产物颗粒状结构团聚明显,并且禁带宽度有所增大,分别为2.45eV和2.47eV。
(2)pH=9时所制备的样品表现出最高的光催化活性,在250W金属卤化物灯下光照 50min,对甲基橙的脱色率达66.23 %,这与其较小的禁带宽度、较小的晶体粒径、大量的氧空位及表面吸附氧有着直接的关系。
[1] TAN G Q, ZHANG L L, REN H J, et al. Microwave hydrothermal synthesis of N-doped BiVO4nanoplates with exposed (040) facets and enhanced visible-light photocatalytic properties[J].Ceramics International,2014,40 (7):9541-9547.
[2] SHANG M, WANG W Z, ZHANG L, et al. 3D Bi2WO6/TiO2hierarchical heterostructure: controllable synthesis and enhanced visible photocatalytic degradation performances[J]. Journal of Physical Chemistry C, 2009,113(33): 14727-14731.
[3] LEE D K, CHO I, LEE S, et al.Effects of carbon content on the photocatalytic activity of C/BiVO4composites under visible light irradiation[J].Materials Chemistry and Physics, 2010,119(1-2):106-111.
[4] 李朋,赵昆渝,郭军,等.TiO2纳米孔到纳米管结构转变的因素及其机理研究[J].材料工程,2014,(1):58-63.
LI Peng, ZHAO Kun-yu, GUO Jun, et al. Factors and mechanism for transition of TiO2from nanopores to nanotubes[J]. Journal of Materials Engineering, 2014, (1):58-63. [5] CHENG L J, KANG Y, TONG F. Effect of preparation conditions on characteristics of hollow TiO2fibers fabricated by chemical deposition and template method[J].Applied Surface Science,2012,263:223-229. [6] 顾建军, 刘鹏飞, 韩金荣, 等. Fe 掺杂量和退火氛围对TiO2薄膜晶体结构和磁性能的影响[J].材料工程,2014,(10):101-105.
GU Jian-jun, LIU Peng-fei, HAN Jin-rong, et al. Influence of Fe-doping and annealing atmosphere on crystalline structure and magnetism of TiO2thin films[J].Journal of Materials Engineering, 2014, (10):101-105.
[7] LI Y K, DONG S Y, WANG Y F,et al. Reduced graphene oxide on a dumbbell-shaped BiVO4photocatalyst for an augmented natural sunlight photocatalytic activity[J].Journal of Molecular Catalysis A:Chemical, 2014, 387:138-146.
[8] ZHU Z F, ZHANG L, LI J Q, et al. Synthesis and photocatalytic behavior of BiVO4with decahedral structure[J]. Ceramics International, 2013, 39(7): 7461-7465. [9] 王敏, 车寅生, 董占军, 等.B-Eu共掺杂BiVO4及对甲基橙的可见光光催化降解[J].材料热处理学报,2014,35(7):9-14.
WANG Min, CHE Yin-sheng, DONG Zhan-jun, et al. Synthesis of B-Er co-doped BiVO4photocatalyst and its photodegradation of methyl orange under visible-light irradiation[J]. Transactions of Materials and Heat Treatment, 2014, 35 (7): 9-14.
[10] GAO X M, FU F, ZHANG L P, et al. The preparation of Ag-BiVO4metal composite oxides and its application in efficient photocatalytic oxidative thiophene[J]. Physica B:Condensed Matter,2013, 419:80-85.
[11] ZHANG X F, DU L L, WANG H, et al.Highly ordered mesoporous BiVO4: controllable ordering degree and super photocatalytic ability under visible light[J].Microporous and Mesoporous Materials,2013,173:175-180.
[12] ZHU G Q, HOJAMBERDIEV M, QUE W X, et al.Hydrothermal synthesis and visible-light photocatalytic activity of porous peanut-like BiVO4and BiVO4/Fe3O4submicron structures[J].Ceramics International, 2013, 39(8):9163-9172.
[13] ZHAO Z X, DAI H X, DENG J G, et al. Effect of sulfur doping on the photocatalytic performance of BiVO4under visible light illumination[J]. Chinese Journal of Catalysis,2013,34(8):1617-1626.
[14] LU Y, LUO Y S, KONG D Z, et al. Large-scale controllable synthesis of dumbbell-like BiVO4photocatalysts with enhanced visible-light photocatalytic activity[J]. Journal of Solid State Chemistry,2012,186: 255-260.
[15] ZHANG L L, LONG J X, PAN W W,et al. Efficient removal of methylene blue over composite-phase BiVO4fabricated by hydrothermal control synthesis[J].Materials Chemistry and Physics,2012,136(2-3): 897-902.
[16] OBREGON S, CABALLERO A, COLON G.Hydrothermal synthesis of BiVO4: structural and morphological influence on the photocatalytic activity[J]. Applied Catalysis B:Environmental, 2012,117-118: 59-66.
[17] WANG M, CHE Y S, NIU C, et al. Effective visible light-active boron and europium co-doped BiVO4synthesized by sol-gel method for photodegradation of methyl orange[J].Journal of Hazardous Materials, 2013,262:447-455.
[18] WANG M, CHE Y S, NIU C, et al. Lanthanum and boron co-doped BiVO4with enhanced visible light photocatalytic activity for degradation of methyl orange[J]. Journal of Rare Earths,2013,31(9):878-884.
[19] KARUNAKARAN C, KALAIVANI S, VINAYAGAMOORTHY P, et al.Electrical, optical and visible light-photocatalytic properties of monoclinic BiVO4nanoparticles synthesized hydrothermally at different pH[J].Materials Science in Semiconductor Processing,2014,21: 122-131.
Effect of pH Value on Photocatalytic Properties of BiVO4Prepared by Ethylene Glycol Sol-gel
WANG Min,ZHENG Hao-yan,YANG Chang-xiu,GAO Xing-ying, DONG Zhu-xi-wen,LUO Yang,CHEN Yao
(School of Environmental and Chemical Engineering, Shenyang Ligong University,Shenyang 110159,China)
The visible-light-driven BiVO4photocatalysts were synthesized by ethylene glycol sol-gel method. The effect of different pH values on microstructure and photocatalytic properties of BiVO4was studied. The samples were characterized by SEM, XRD, XPS and UV-Vis DRS analyses. The results show that all samples have high purity and all samples are monoclinic.The morphology and photocatalytic properties of the samples change when the pH value changes. When the pH value is 5, the sample is irregular lamellar structure;when the pH value increases to 7 and 9, the sample shows obvious granular structure and much less sample for the irregular structure; when the pH value increases to 11 and 13, the granular structure has the phenomenon of aggregation. The sample of pH=9 has the smallest band gap energy and the minimum grain size, and shows the highest photocatalytic activity. The total decoloration rate of methyl orange is 66.23% under 250W metal halide light for 50min.
bismuth vanadate;ethylene glycol;photocatalysis;methyl orange;sol-gel
10.11868/j.issn.1001-4381.2015.09.002
O643
A
1001-4381(2015)09-0006-06
国家自然科学基金青年项目(21207093);中华环境保护基金会“格平绿色助学行动-辽宁环境科研教育‘123工程’”(CEPF2012-123-2-2);辽宁省高等学校优秀人才支持计划(LJQ2014023)
2014-12-01;
2015-07-07
王敏(1975-),女,副教授,博士,研究方向:光催化材料,联系地址:辽宁省沈阳市浑南新区南屏中路6号沈阳理工大学环境与化学工程学院(110159), E-mail:minwang62@msn.com.

